幽门螺杆菌感染及根除与类风湿性关节炎关系的Meta分析
2022-09-16刘彦希张秉强
幽门螺杆菌(Helicobacter pylori,
)是一种定植于胃、十二指肠等多个区域的革兰氏阴性微需氧细菌,其感染可引起胃黏膜轻度慢性炎症改变,并导致胃炎、消化道溃疡、胃黏膜相关淋巴组织(gastric mucosa associated lymphoid tissue,MALT)淋巴瘤、胃癌等多种上消化道疾病的发生
。
感染与胃内疾病的关系毋庸置疑,但近年来,随着相关研究的深入,
感染与胃肠外疾病,尤其是胃肠外自身免疫性疾病的关系逐渐引起人们的注意
。大多数自身免疫性疾病的病因尚不明确,现有观点认为,宿主和环境的共同作用在其发病过程中占据重要地位。研究
表明,感染因素作为环境的一部分,可能通过分子抗原模拟、多克隆淋巴细胞激活、表位扩散、旁位激活、超抗原激活等机制诱发自身免疫性疾病的发生。
是备受关注的感染因子之一,有文献
报道,
感染与类风湿性关节炎的发病有关,同时对
阳性的类风湿性关节炎患者予以根除
治疗后其疾病活动度会有所降低,但也有研究
报道表明两者之间不相关,因此,
感染与类风湿性关节炎是否存在关系亟待进一步研究。本研究使用Meta分析以及描述性评价的方法,首先比较了类风湿性关节炎患者及普通人群中
的感染率,其次探讨了根除
后类风湿性关节炎的疾病活动度是否改变,以期为临床诊疗提供新的辅助治疗策略。
1 资料与方法
对Web of Science、PubMed、Cochrane Library、Embase数据库进行系统检索,检索时间设为建库至2021年5月,检索策略为(‘Helicobacter pylori’ OR ‘
’ OR ‘HP’)AND(‘Rheumatoid arthritis’ OR ‘RA’ OR ‘autoimmune disease’ OR ‘immune diseases’ OR ‘connective tissue disorder’),对CNKI、VIP、万方数据库、CBM进行检索,检索策略为(幽门螺杆菌)AND(‘类风湿性关节炎’OR‘自身免疫病’OR‘结缔组织病’),同时对相关文献的参考文献进行筛查以保证检索范围足够全面。
本文设置类风湿性关节炎患者的
感染率作为主要结局指标,并设置
阳性的类风湿性关节炎患者进行
根除治疗后的关节肿胀数目、C反应蛋白(C-reactive protein,CRP)水平、以及血沉(erythrocyte sedimentation rate,ESR)水平作为三项次要结局指标。
国外有研究认为大肠埃希菌菌株起源与系统发育群有关,同一个系统发育群的菌株可能存在共同的祖先,不同系统发育群致病力亦不相同[12,27]。Wang等[5]研究发现血流感染中大肠埃希菌主要是B2群,其次是D群、B1群和A群。本研究结果显示,引起血流感染的大肠埃希菌主要为B2群,而F群菌株数量仅次于B2群,与Wang等[5]报道并不一致,原因可能是本研究采用最新的分群方法[16],更加细分出F群,目前采用这种新方法进行血流感染大肠埃希菌分群的文献报道罕见,关于F群菌株的特征有待进一步研究。
1.2.1
感染与类风湿性关节炎:文献纳入标准:(1)关于
感染与类风湿性关节炎关系的病例对照研究;(2)研究同时设置观察组及对照组,观察组为类风湿性关节炎患者,对照组为健康人群或其他无风湿疾病患病人群;(3)研究提供了观察组及对照组中
感染人数的原始数据;(4)类风湿性关节炎诊断标准明确;(5)
感染诊断标准明确:
C尿素呼气试验、组织学检查或血清学抗
抗体阳性。文献排除标准:(1)仅设置观察组,未设置对照组;(2)重复文献;(3)无法获得原始文献内容或缺少原始数据。
目前,红秀《延安 延安》已成为党员干部、青少年进行爱国主义教育、革命传统教育、延安精神教育的情景教学课,是陕西乃至全国红色文化旅游和中国革命精神标识之旅的金字招牌。
1.3.1 数据提取:两名研究人员独立阅读检索文献的题目与摘要,排除明显与研究不相关的研究后,对剩余文献进行全文阅读,根据制定的纳入及排除标准进行文献筛选,若意见不一致则重新核对讨论。分别进行文献的质量评价及资料提取,采用NOS量表
对病例对照研究进行质量评价,采用MINORS条目
对非随机对照干预性研究进行质量评价。提取数据,提取内容包括文献作者、发表时间、研究类型、研究对象特征、样本量、干预措施、比值比(
)等。
1.3.2 资料分析:① 异质性检验:采用
检验分析评估纳入研究之间的异质性,以
及
值评估异质性大小,若
<50
,
>0.05,则认为纳入的各项研究之间异质性较小,采用固定效应模型进行Meta分析,反之则采用随机效应模型,必要时进行描述性分析。② Meta分析:提取整合原始研究中的数据,根据异质性检验结果,对
感染率分析采用Mantel-Haenszel固定效应模型,对
根除治疗后类风湿性关节炎患者的关节肿胀数目、CRP、ESR水平分析采用DerSimonian Laird随机效应模型
,同时进行描述性分析,并根据纳入人群地区进行亚组分析以探索异质性来源。③ 敏感性分析:以每次减少1篇文献的方法进行敏感性分析,以评估单篇研究对本Meta分析结果的影响。使用平均差(mean difference,MD)来进行连续性变量的统计学分析,使用
值来进行二分类变量的统计学分析。④ 发表偏倚:在以
感染率为研究指标的研究中通过制作漏斗图评估各项研究之间是否存在发表偏倚。
2 结果
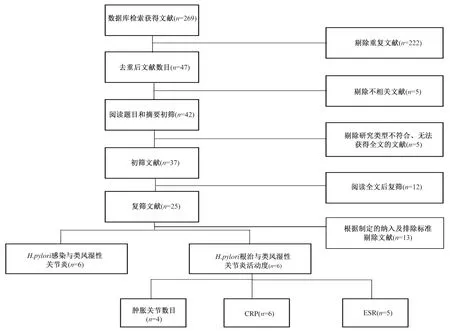
根据设定的检索策略进行初步检索,共检索到文献269篇。剔除重复文献后,通过阅读文章题目和文献摘要进行筛选,初步纳入文献25篇。对剩余25篇文献阅读全文,根据制定的纳入及排除标准,最终纳入有关类风湿性关节炎与
感染的文献共6篇
,有关类风湿性关节炎根除
治疗后的关节肿胀数目、CRP水平、ESR水平分别纳入4项
、6项
、5项
文献,详细筛选过程如图1所示。
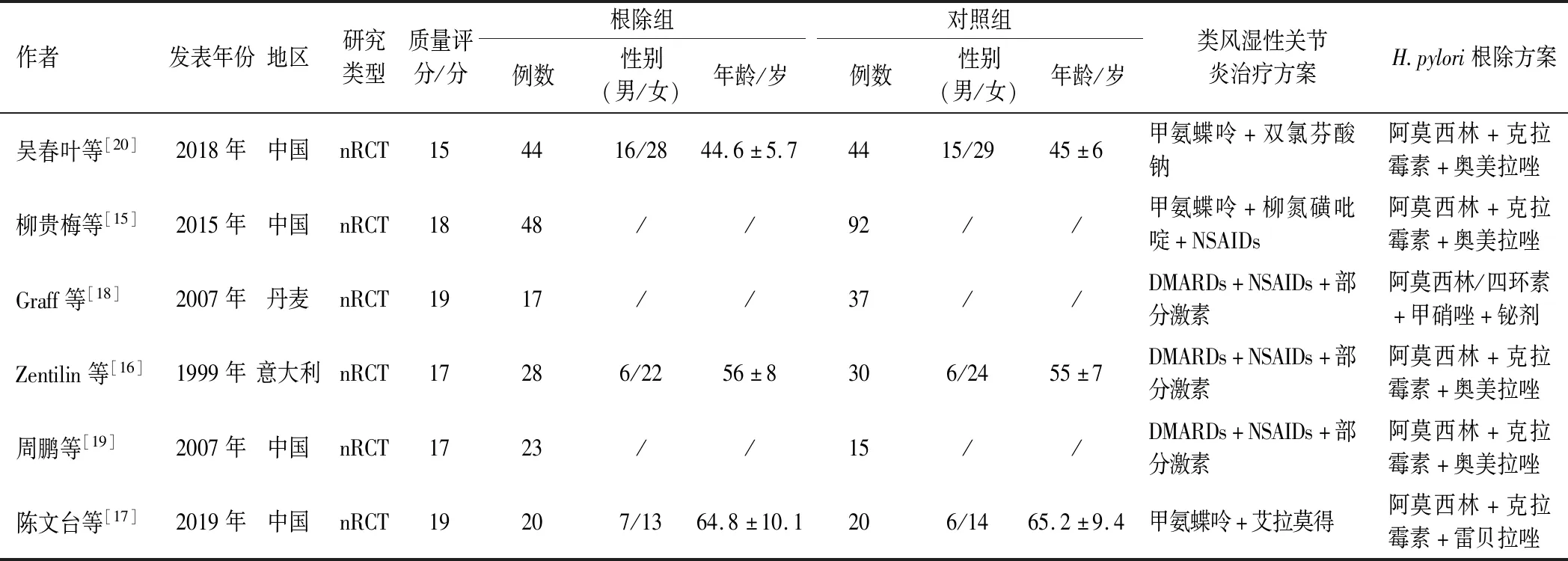
收集了包括第一作者、研究地区、研究类型、人群年龄、性别等资料。对病例对照研究采用NOS量表进行质量评价。非随机对照研究(nRCT)采用MINORS条目进行质量评价(见表1~2)。

该阶段需要完成的工作主要包括以下几个方面:接收相关的设计委托书,并签订合同;在规定时间内,有序地完成各项设计工作。设计难度由浅入深,并将各个工种区分开来,按照工种合理分配设计任务;设计团队需要定期召开交流会,协调好各方面的设计关系,保证设计进度的同时,把握住设计的大方向;在提升商场内部美观程度的同时,要严格按照各项标准进行设计,使建筑稳定性得到有力保证[1]。
2.3.1 类风湿性关节炎与
感染:6项研究
经异质性检验
值为7
48,
=0.19,采用固定效应模型进行Meta分析。
2.3.2 类风湿性关节炎与
根除:① 肿胀关节数目:4项研究
经异质性检验
值为254
10,
<0.05,研究之间存在异质性,采用随机效应模型进行Meta分析,同时进行描述性分析。② CRP水平:6项研究
经异质性检验
值为67
52,
<0.05,研究之间存在异质性,采用随机效应模型进行Meta分析,同时进行描述性分析。③ ESR水平:5项研究
经异质性检验
值为33
11,
<0.05,研究之间存在异质性,采用随机效应模型进行Meta分析,同时进行描述性分析。
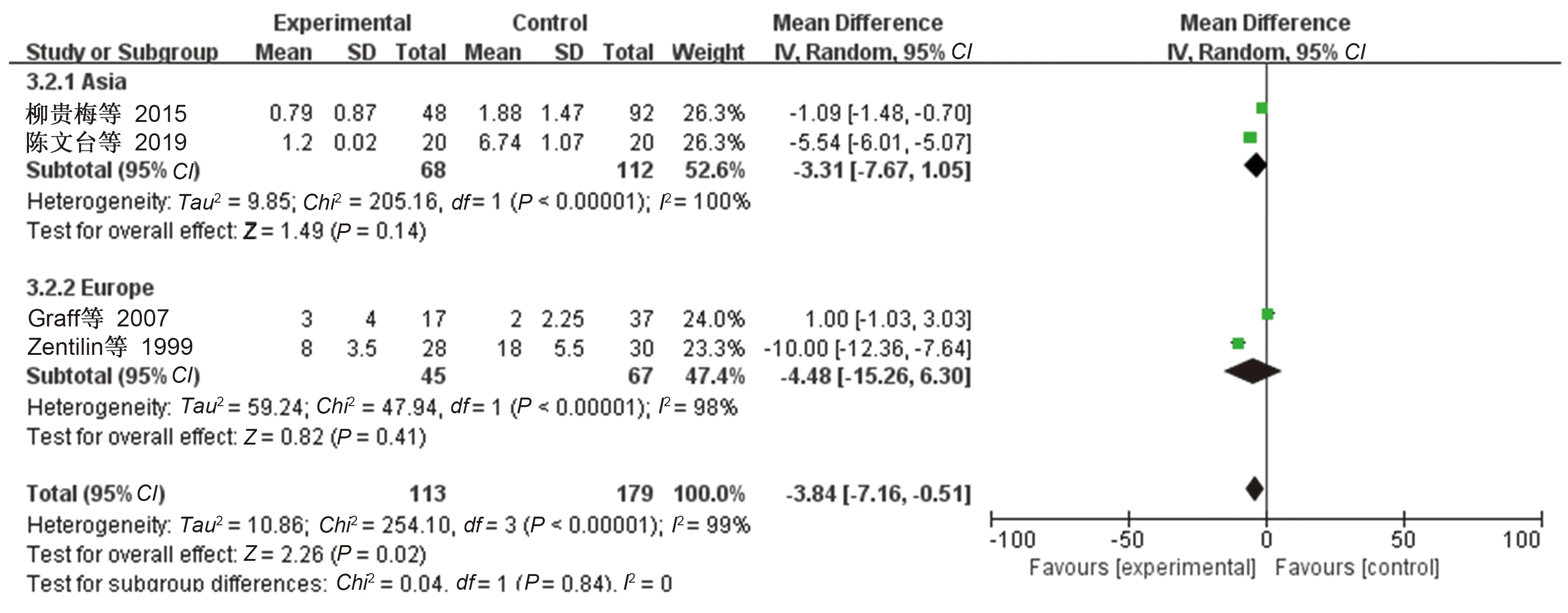
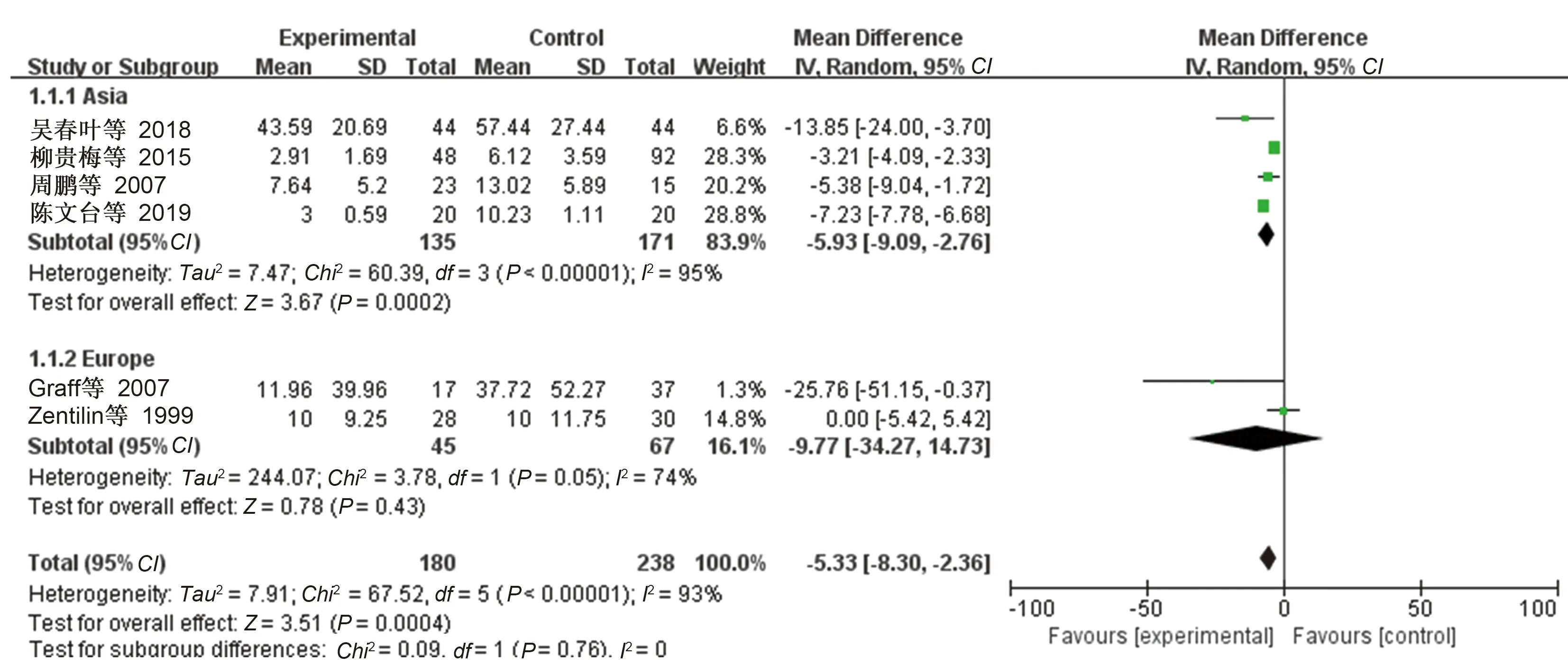
按照研究的地区进行亚组分析,结果显示各亚组的合并效应值之间差异无统计学意义(见图6~8),考虑地区并不是各项研究结果之间存在异质性的重要影响因素。
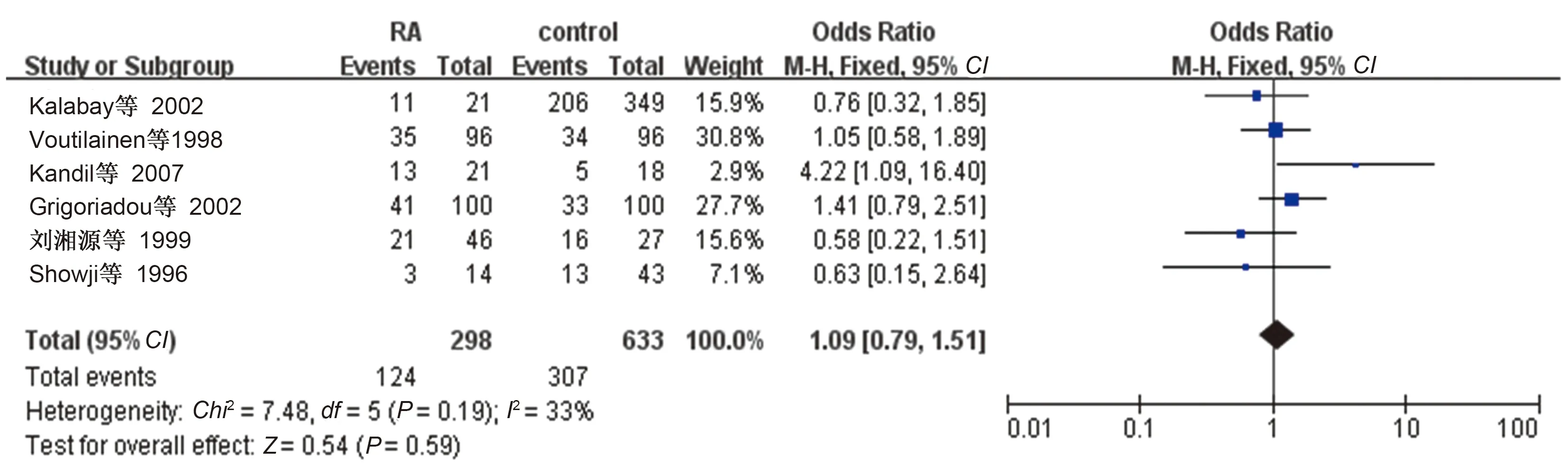
2.4.1 类风湿性关节炎患者中的
感染率:6项满足纳入标准研究
报道了类风湿性关节炎组与对照组
感染的情况。共931例,其中类风湿性关节炎组298例,
阳性患者124例,
感染率41.61%,对照组633例,
阳性患者307例,
感染率48.50%。Meta分析结果显示:
=1
09,95
:0
79~1
51,
=0.59,合并效应量差异无统计学意义,类风湿性关节炎患者的
感染率与人群中
感染率差异无统计学意义(见图2)。
诗词的规律是什么?《诗经》是我国诗歌现实主义的源头,《离骚》是烂漫主义的先驱。无论《诗经》还是《离骚》,它们都是用来配乐吟唱的,都具有鲜明的地方色彩。《诗经》中的《国风》就是当地流行的民谣,主张复唱,琅琅上口,特别适合配乐吟唱。《离骚》语句中间插入“兮”,不仅增强了节奏感,更加强了语气,使上下文咏一致,一气贯通。后来的律诗和绝句,虽然形式要求更严格了,但是节奏、押韵、平仄的要求都关乎诵读。词就更不必细说,它本来就是配乐齐唱的。走进古诗词的第一步就是诵读,配乐演唱更是不错的选择。
1.2.2
根除治疗与类风湿性关节炎疾病活动度的关系:文献纳入标准:(1)对感染
的类风湿性关节炎患者进行
根除治疗的临床研究;(2)同时设置试验组及对照组,试验组为进行根除
治疗的
阳性的类风湿性关节炎患者,对照组为
阴性或阳性但未行根除治疗的类风湿性关节炎患者;(3)研究提供了试验组及对照组中
阳性及阴性人数,以及研究结局指标的原始数据,包括
根除前后试验组及对照组的关节肿胀数目、CRP、ESR等指标;(4)类风湿性关节炎诊断标准明确;(5)
感染诊断标准明确:
C尿素呼气试验、组织学检查或血清学抗
抗体阳性。文献排除标准:(1)仅设置试验组,未设置对照组;(2)重复文献;(3)无法获得全文或原始数据。
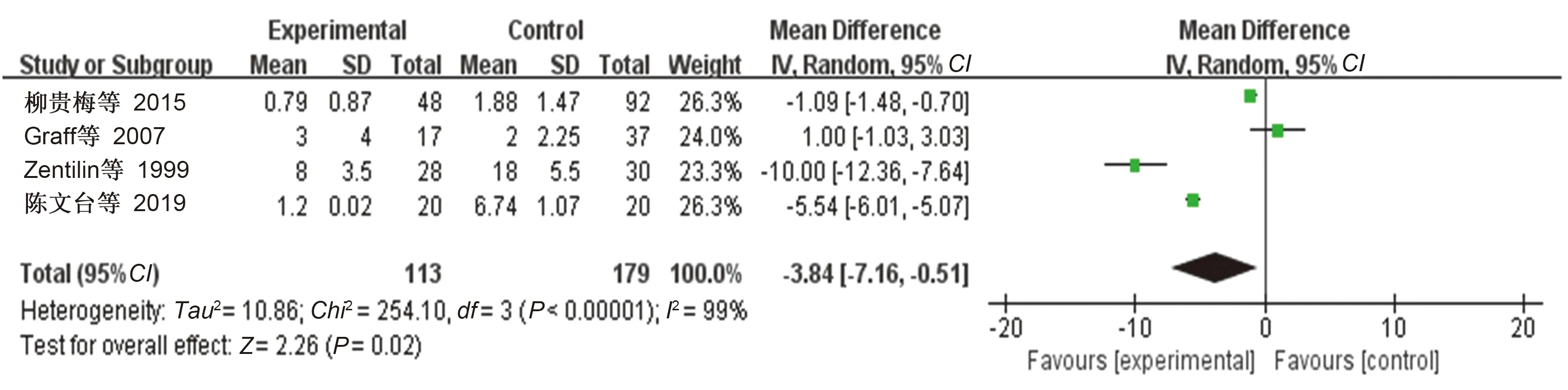
2.4.2
阳性的类风湿性关节炎患者根除
后的肿胀关节数目:① 描述性分析结果:4项非随机对照研究
描述了类风湿性关节炎患者进行抗
治疗后关节肿胀数目的变化情况。在柳贵梅等
的研究中,进行
根除治疗的类风湿性关节炎患者共48例,关节肿胀数目(个)基线水平为10.73±2.90,对照组共92例,关节肿胀数目(个)基线水平为10.41±2.79,两组数据之间经
检验差异无统计学意义。所有患者均予以相同方案进行抗风湿常规治疗,同时试验组进行
根除治疗,12周后随访各组肿胀关节数目,试验组患者关节肿胀数目(个)水平为0.79±0.87,对照组关节肿胀数目(个)水平为1.88±1.47,同样采取
检验,结果显示两组数据之间差异有统计学意义,试验组关节肿胀数目少于对照组。Zentilin等
、陈文台等
的研究也得到了相似的结论。但在Graff等
的研究中,对类风湿性关节炎患者进行根除
治疗后,随访至研究终点,虽然患者的大多数临床症状及实验室指标较基线水平得到了改善,但试验组与对照组两组数据之间经
检验差异无统计学意义。② 定量分析结果:4项研究
符合文献纳入标准,报道了
阳性的类风湿性关节炎患者根除
治疗前后关节肿胀的数目。共292例,行
根除治疗的类风湿性关节炎患者113例,对照组179例。Meta分析结果:
=-3
84,95
:-7
16~-0
51,
=0.02,合并效应量有统计学意义(见图3),可以认为
阳性的类风湿性关节炎患者根除
治疗后关节肿胀数目少于对照组。
2.4.3
阳性的类风湿性关节炎患者根除
后的CRP水平:① 描述性分析结果:6项非随机对照研究
描述了类风湿性关节炎患者进行抗
治疗后CRP水平变化情况。在6项研究中,除Zentilin等
的研究,其余5项研究均显示,随访至研究终点,
阳性的类风湿性关节炎患者根除
后CRP水平低于对照组CRP水平,差异有统计学意义。而在Zentilin等
的研究中,尽管研究终点两组CRP水平差异无统计学意义,但在研究起始时,CRP、ESR这两项炎性指标在
感染的类风湿性关节炎患者中高于
阴性的患者,且差异有统计学意义,故该项研究作者仍支持对
阳性的类风湿性关节炎患者进行
根除治疗。② 定量分析结果:6项研究
符合文献纳入标准,报道了
阳性的类风湿性关节炎患者进行根除
治疗前后CRP的水平。共418例,行
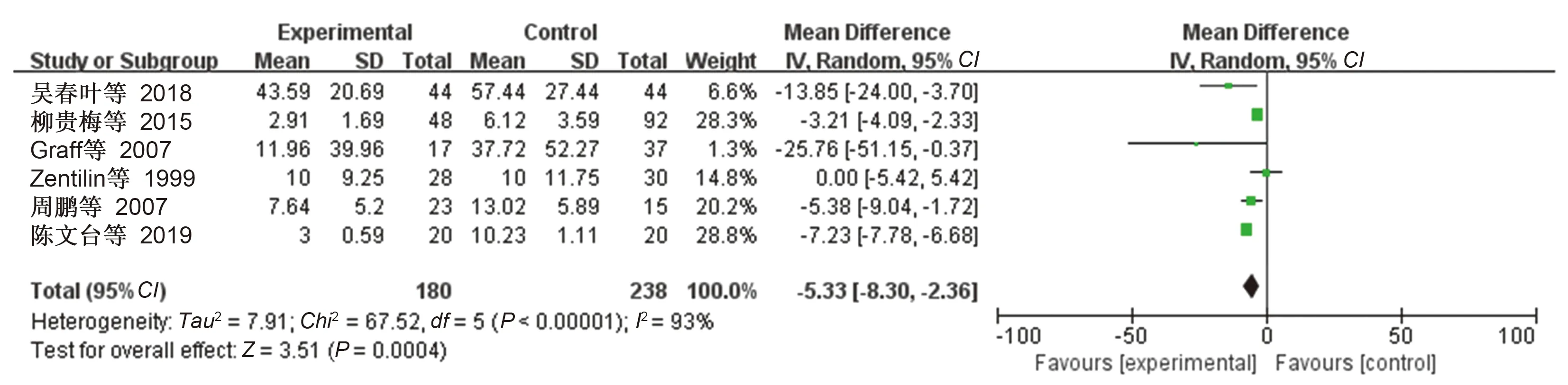
根除治疗的类风湿性关节炎患者180例,对照组238例。Meta分析结果:
=-5
33,95
:-8
30~-2
36,
=0.0004,合并效应量有统计学意义(见图4),可以认为
阳性的类风湿性关节炎患者根除
治疗后CRP水平低于对照组。
2.4.4
阳性的类风湿性关节炎患者根除
后的ESR水平:① 描述性分析结果:5项非随机对照研究
描述了类风湿性关节炎患者进行抗
治疗后ESR水平变化情况。在周鹏等
的研究中,
阳性的类风湿性关节炎患者进行根除
治疗后的ESR水平低于对照组,但差异无统计学意义(
>0.05),余4项研究中,随访至研究终点,
阳性的类风湿性关节炎患者根除
治疗后ESR水平较对照组更低,且差异有统计学意义。② 定量分析结果:5项研究
符合文献纳入标准,报道了
阳性的类风湿性关节炎患者进行根除
治疗前后ESR的水平。共378例,行
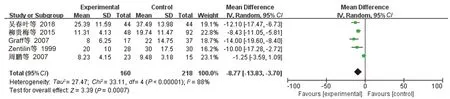
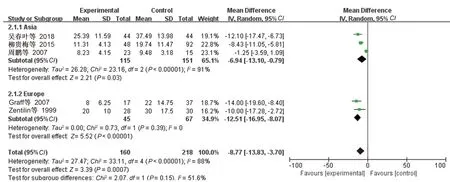
根除治疗的类风湿性关节炎患者160例,对照组218例。Meta分析结果结果显示:
=-8
77,95
:-13
83~-3
70,
=0.0007(见图5),合并效应量有统计学意义,可以认为
阳性的类风湿性关节炎患者根除
治疗后ESR水平低于对照组。
采用每次减少1篇纳入研究的方式进行敏感性分析,结果显示在4项Meta分析中,分别去除单篇研究后,Meta分析的结果均不变,提示本研究结果的稳定性较好,结果较为可信。
对学生的安全教育不能是空洞和空泛地开展,要针对小学生的特点,对他们进行 “润物细无声”的熏陶,这样的教育才能浸入孩子们的心脾,影响到思想,触动到灵魂深处。如:通过学校安全橱窗内的安全知识宣传以及楼道安全标语的警示,还有安全黑板报、手抄报等灵活多样的方式,使小学生从多方面多渠道地了解掌握安全知识,在时时处处都重视安全的浓郁氛围下受到感染,从而培养学生重视安全的意识和养成安全的良好行为习惯。
本研究进行的4项Meta研究分别纳入文献数量为6、4、6、5篇,因纳入文献的数量较少,检测发表偏倚意义较小,故未行发表偏倚检测。
混合共识的2个重要部分是时期内共识和重配置。时期内共识是指在协议正常运行过程中,协议以时期为单位推进,每个时期包括多个轮。在每个时期,委员会的配置是固定的,即委员会成员身份确定且委员会领导者确定。委员会领导者一般通过每一时期的随机数决定,负责每一轮区块的提议。通常来说,每一轮委员会内部运行类似于PBFT的分布式经典共识协议,生成一个新的区块,一个时期对应多个区块的生成。
3 讨论
作为一种慢性系统性自身免疫性疾病,类风湿性关节炎常以关节滑膜组织、软骨、骨骼炎性改变为主要表现,其起病被认为基于遗传与环境的协同作用。部分研究
表明,人体内微生物群的变化与特定的自身免疫性疾病之间存在联系,du Teil Espina等
等发现,类风湿性关节炎患者口腔和肠道微生物群变化会引起机体对自身抗原的耐受性降低甚至消失,导致关节炎症损害加重。消化道微生物群调节宿主免疫稳态且与许多人类代谢紊乱有关
,随着宿主-微生物相互作用可介导自身免疫性疾病发病的理论得到支持,
作为最常见的细菌病原体之一,其与自身免疫性疾病是否存在关系逐渐被研究者关注。
感染与免疫性血小板减少性紫癜、自身免疫性甲状腺炎等疾病之间的关系已被研究证实,其对炎症性肠病、多发性硬化症等疾病具有保护作用的观点也被普遍认可
。但
感染与类风湿性关节炎是否有关,目前仍存在争议。
淋巴结总数≥20个组与淋巴结总数<20个组术后复发率,差异无统计学意义(χ2=7.254,P=0.264)。其中Ⅰ期、Ⅱ期患者淋巴结总数≥20个与淋巴结总数<20个术后复发率差异均无统计学意义(χ2=3.194,P=0.297,χ2=5.285,P=0.642),Ⅲ期患者淋巴结总数≥20个与淋巴结总数<20个差异有统计学意义(P=0.007)。Ⅳ期只有2例,都切除腹主动脉旁淋巴结,因此不进行统计学分析。详见表1。
本研究发现类风湿性关节炎患者的
感染率与正常人群对比差异无统计学意义,
感染并不是类风湿性关节炎的病因,也不能诱导类风湿性关节炎起病,但我们仍不能完全否认
感染与类风湿性关节炎之间可能存在一定的联系,因为进行根除
治疗后,与仅进行常规抗风湿治疗的对照组相比,
根除组的关节肿胀数目更少、CRP水平、ESR水平更低,且治疗后改善更为显著。
感染在类风湿性关节炎疾病过程中发挥了怎样的作用尚未明确,有报道
称,
中的脲酶成分可以直接与机体B-1型细胞上的Toll样受体结合并相互作用,激活B-1细胞产生自身抗体,从而诱发自身免疫性疾病。而在机体感染
后,微生物作为抗原刺激物持续存在,会诱导机体产生持续慢性的炎症反应,根除
以后,抗原刺激物带来的炎症刺激减少,进而使类风湿性关节炎患者的临床表现及炎症指标得到改善。Zentilin等
认为,
在胃内定植介导IL-8、IL-6等炎症因子增加,而上述增加的炎症因子同样可以作用于胃肠外,进一步放大类风湿性关节炎的相关炎症因子表达。故而进行
根除治疗有助于控制类风湿性关节炎患者的炎症活动。Nie等
认为,类风湿性关节炎患者通过炎性滑膜释放大量TNF-α进入关节液,致使类风湿性关节炎患者关节中存在的调节T细胞(Treg)失去正常的免疫抑制活性,Treg的功能受损将导致自身免疫性疾病进一步失控。而Zhao等
报道了
感染患者中TNF-α及其受体的表达增加,根除
可能通过下调TNF-α的表达来改善类风湿性关节炎的炎症活动度。
在类风湿性关节炎中的作用机制说法不一,亟待更多的研究证明。根据现有的证据,我们认为
具有病原学作用的可能性较小,更可能的是有助于疾病中炎症状态的维持,所以在根除
后我们可以观察到类风湿性关节炎患者的临床症状改善及炎症指标下降。值得注意的是,部分抗菌药物似乎在类风湿性关节炎治疗中起效。所以,尽管根据本Meta分析的研究结果,根除
对于改善类风湿性关节炎活动度起到良好作用,但由于根除
的方案中包含了至少一种抗菌药物的使用,所以我们很难确定在治疗过程中究竟是
的根除带来的正面效果,或仅仅是由于根除方案中抗菌药物通过抗炎或免疫调节等机制在类风湿性关节炎的治疗中起效。Astbury等
使用了两种磺胺类药物进行了研究,结果显示这两种磺胺类药物应用于类风湿性关节炎治疗时未观察到任何有意义的临床改善。这似乎更支持药物的非抗菌活性在类风湿性关节炎治疗中起效,使本篇Meta分析的结果更为可靠。但归根结底,我们纳入的研究中缺乏接受抗菌药物治疗的类风湿性关节炎感染患者的对照组,该组的设置不以根除
为目的,而是为了排除抗菌药物给治疗带来的影响。
本研究纳入文献数量有限,检测发表偏倚的意义不大,敏感性分析的结果提示结论稳定可信,但仍存在以下缺陷:(1)在探索
感染与类风湿性关节炎关系的Meta分析中,由于这是一项相关性研究,纳入文献的类型均为病例对照研究,而在关于
根治对类风湿性关节炎活动度影响的研究中,不进行
根治存在伦理问题,故纳入研究均为非随机对照试验,其证据力度无法与随机对照研究相提并论;(2)纳入分析的原始研究样本量较小;(3)在
根除治疗的三项Meta分析中,纳入研究间存在异质性,且根据地区进行亚组分析,完善敏感性分析均未找到异质性来源,考虑研究之间的异质性来源于临床多样性,如各项研究之间类风湿性关节炎治疗的基础方案的差异、
感染的检测方法、根除方法不同等。
类风湿性关节炎患者中
感染率与普通人群无差异,
感染诱导类风湿性关节炎起病的证据不足,但对
阳性的类风湿性关节炎患者进行
根除治疗后,根除组的临床症状及实验室指标缓解程度较单纯常规治疗的对照组改善更为明显。根据本Meta分析结果,我们仍建议对类风湿性关节炎患者进行
检测,并对阳性患者予以根除治疗。但证明我们的结论还需要更多质量高、样本量大的临床研究。
[1] Pezzi JS, Shiau YF. Helicobacter pylori and gastrointestinal disease [J]. Am Fam Physician, 1995, 52(6): 1717-1724, 1729. PMID: 7484682.
[2] Smyk DS, Koutsoumpas AL, Mytilinaiou MG, et al. Helicobacter pylori and autoimmune disease: cause or bystander [J]. World J Gastroenterol, 2014, 20(3): 613-629. DOI: 10.3748/wjg.v20.i3.613.
[3] Ram M, Barzilai O, Shapira Y, et al. Helicobacter pylori serology in autoimmune diseases-fact or fiction? [J]. Clin Chem Lab Med, 2013, 51(5): 1075-1082. DOI: 10.1515/cclm-2012-0477.
[4] Ebrahimi A, Soofizadeh B, Ebrahimi F, et al. Relationship between Helicobacter pylori cytotoxin-associated gene A protein with clinical outcomes in patients with rheumatoid arthritis [J]. Immunol Lett, 2019, 211: 49-52. DOI: 10.1016/j.imlet.2019.05.014.
[5] Bartels LE, Pedersen AB, Kristensen NR, et al. Helicobacter pylori infection is not associated with rheumatoid arthritis [J]. Scand J Rheumatol, 2019, 48(1): 24-31. DOI: 10.1080/03009742.2018.1464205.
[6] Wells G. The Newcastle-Ottawa Scale (NOS) for assessing the quality of non-randomised studies in Meta-analyses [C]. Symposium on Systematic Reviews: Beyond the Basics, 2014.
[7] 曾宪涛, 刘慧, 陈曦, 等. Meta分析系列之四:观察性研究的质量评价工具[J]. 中国循证心血管医学杂志, 2012, 4(4): 297-299. DOI: 10.3969/j.1674-4055.2012.04.004.
[8] Takkouche B, Cadarso-Suárez C, Spiegelman D. Evaluation of old and new tests of heterogeneity in epidemiologic meta-analysis [J]. Am J Epidemiol, 1999, 150(2): 206-215. DOI: 10.1093/oxfordjournals.aje.a009981.
[9] Kalabay L, Fekete B, Czirják L, et al. Helicobacter pylori infection in connective tissue disorders is associated with high levels of antibodies to mycobacterial hsp65 but not to human hsp60 [J]. Helicobacter, 2002, 7(4): 250-256. DOI: 10.1046/j.1523-5378.2002.00092.x.
[10] Voutilainen M, Sokka T, Juhola M, et al. Nonsteroidal anti-inflammatory drug-associated upper gastrointestinal lesions in rheumatoid arthritis patients: relationships to gastric histology, Helicobacter pylori infection, and other risk factors for peptic ulcer [J]. Scand J Gastroenterol, 1998, 33(8): 811-816. DOI: 10.1080/00365529850171459.
[11] Kandil ME, El Hamshary A, Emara N. Seroprevalence of Helicobacter pylori in juvenile rheumatoid arthritis and its relation to disease severity [J]. J Med Sci, 2007, 7(5): 716-723.
[12] Showji Y, Nozawa R, Sato K, et al. Seroprevalence of Helicobacter pylori infection in patients with connective tissue diseases [J]. Microbiol Immunol, 1996, 40(7): 499-503. DOI: 10.1111/j.1348-0421.1996.tb01100.x.
[13] Grigoriadou S, Quraishi A, Saravanna J, et al. What effect does Helicobacter pylori infection have on the risk of peptic ulceration in patients receiving NSAIDs for rheumatoid arthritis? [J]. Eur J Intern Med, 2002, 13(4): 269-273. DOI: 10.1016/s0953-6205(02)00039-0.
[14] 刘湘源, 施桂英. 类风湿关节炎患者胃肠损害与幽门螺杆菌感染的相关性研究[J]. 中华风湿病学杂志, 1999, 3(2): 106. DOI: 10.3760/j:issn:1007-7480.1999.02.013.
[15] 柳贵梅, 周雪莲, 赵巧凤. 根除幽门螺杆菌治疗对类风湿关节炎患者血清IL-8、IL-18水平的影响[J]. 中国免疫学杂志, 2015, (8): 1098-1100, 1104. DOI: 10.3969/j.issn.1000-484X.2015.08.022.
Liu GM, Zhou XL, Zhao QF. Impact on level of serum IL-8 and IL-18 by Helicobacter pylori eradication therapy in patients with rheumatoid arthritis [J]. Chin J Immunol, 2015, (8): 1098-1100, 1104. DOI: 10.3969/j.issn.1000-484X.2015.08.022.
[16] Zentilin P, Savarino V, Garnero A, et al. Is Helicobacter pylori infection a risk factor for disease severity in rheumatoid arthritis? [J]. Gastroenterology, 1999, 116(2): 503-504. DOI: 10.1016/S0016-5085(99)70161-7.
[17] 陈文台, 林捷, 郭锋, 等. 根除幽门螺杆菌治疗对类风湿关节炎幽门螺杆菌阳性患者血清IL-8、IL-18水平的影响[J]. 中外医学研究, 2019, 17(29): 6-8. DOI: 10.14033/j.cnki.cfmr.2019.29.003.
Chen WT, Lin J, Guo F, et al. Effect of eradication of Hp on serum IL-8, IL-18 level in patients with rheumatoid arthritis with positive Hp [J]. Chinese and Foreign Medical Research, 2019, 17(29): 6-8. DOI: 10.14033/j.cnki.cfmr.2019.29.003.
[18] Graff LB, Andersen LP, Gernow A, et al. Effect of eradication of Helicobacter pylori in rheumatoid arthritis patients [J]. Journal of Pre-Clinical and Clinical Research, 2007, 1(1): 74-79.
[19] 周鹏, 朱家沂, 周震萍. 类风湿性关节炎患者根治幽门螺杆菌感染后C反应蛋白水平的观察[J]. 现代医药卫生, 2007, 23(21): 3199-3200. DOI: 10.3969/j.issn.1009-5519.2007.21.026.
[20] 吴春叶, 赵晶晶, 李力. 抗幽门螺杆菌三联疗法辅助治疗类风湿关节炎临床观察[J]. 中国药业, 2018, 27(18): 43-45. DOI: 10.3969/j.issn.1006-4931.2018.18.014.
Wu CY, Zhao JJ, Li L, et al. Clinical observation on anti-Helicobacter pylori triple therapy in the adjuvant treatment of rheumatoid arthritis [J]. China Pharmaceuticals, 2018, 27(18): 43-45. DOI: 10.3969/j.issn.1006-4931.2018.18.014.
[21] Wekerle H. The gut-brain connection: triggering of brain autoimmune disease by commensal gut bacteria [J]. Rheumatology (Oxford), 2016, 55(suppl 2): ii68-ii75. DOI: 10.1093/rheumatology/kew353.
[22] Yanagisawa N, Haruta I, Kikuchi K, et al. Are dysregulated inflammatory responses to commensal bacteria involved in the pathogenesis of hepatobiliary-pancreatic autoimmune disease? An analysis using mice models of primary biliary cirrhosis and autoimmune pancreatitis [J]. ISRN Gastroenterology, 2011, 2011: 513514. DOI: 10.5402/2011/513514.
[23] du Teil Espina M, Gabarrini G, Harmsen HJM, et al. Talk to your gut: the oral-gut microbiome axis and its immunomodulatory role in the etiology of rheumatoid arthritis [J]. FEMS Microbiol Rev, 2018, 43(1): 1-18. DOI: 10.1093/femsre/fuy035.
[24] 魏舒纯, 党旖旎, 彭磊, 等. 幽门螺杆菌与胃肠微生态的研究[J]. 胃肠病学和肝病学杂志, 2019, 28(3): 262-266. DOI: 10.3969/j.issn.1006-5709.2019.03.005.
Wei SC, Dang YN, Peng L, et al. Research of Helicobacter pylori and gastrointestinal microecology [J]. Chin J Gastroenterol Hepatol, 2019, 28(3): 262-266. DOI: 10.3969/j.issn.1006-5709.2019.03.005.
[25] Youssefi M, Tafaghodi M, Farsiani H, et al. Helicobacter pylori infection and autoimmune diseases; Is there an association with systemic lupus erythematosus, rheumatoid arthritis, autoimmune atrophy gastritis and autoimmune pancreatitis? A systematic review and meta-analysis study [J]. J Microbiol Immunol Infect, 2020, 54(3): 359-369. DOI: 10.1016/j.jmii.2020.08.011.
[26] Jafarzadeh A, Nemati M, Rezayati MT, et al. Higher serum levels of rheumatoid factor and anti-nuclear antibodies in helicobacter pylori-infected peptic ulcer patients [J]. Oman Med J, 2013, 28(4): 264-269. DOI: 10.5001/omj.2013.74.
[27] Nie H, Zheng Y, Li R, et al. Phosphorylation of FOXP3 controls regulatory T cell function and is inhibited by TNF-α in rheumatoid arthritis [J]. Nat Med, 2013, 19(3): 322-328. DOI: 10.1038/nm.3085.
[28] Zhao C, Lu X, Bu X, et al. Involvement of tumor necrosis factor-alpha in the upregulation of CXCR4 expression in gastric cancer induced by Helicobacter pylori [J]. BMC Cancer, 2010, 10: 419. DOI: 10.1186/1471-2407-10-419.
[29] Astbury C, Hill J, Bird HA. Co-trimoxazole in rheumatoid arthritis: a comparison with sulphapyridine [J]. Ann Rheum Dis, 1988, 47(4): 323-327. DOI: 10.1136/ard.47.4.323.
