镧系金属螯合物作为CEST磁共振造影剂的研究进展
2022-09-15杨景霞焦静静
杨景霞, 焦静静
镧系金属螯合物作为CEST磁共振造影剂的研究进展
杨景霞, 焦静静*
(上海师范大学 化学与材料科学学院,上海 200234)
化学交换饱和转移(CEST)成像是一种基于化学位移现象的新型磁共振成像(MRI),通过检测水质子信号变化来间接测定可交换质子的信息,而镧系金属螯合物的顺磁化学位移大,质子共振位移更远离水的信号,可实现更多的选择性饱和,提高MRI的对比性,因此非常适合用作CEST造影剂. 镧系金属螯合物CEST造影剂具有进一步扩展磁共振功能和分子成像的巨大潜力,文章主要介绍了此类物质的类型及应用.
镧系金属螯合物; 化学交换饱和转移(CEST); 磁共振成像(MRI); 造影剂
0 引 言
磁共振成像(MRI)是现如今临床放射学和生物医学研究中最有效的诊断方法之一.与计算机断层扫描(CT)相比,MRI无电离辐射,可在身体不同软组织之间提供更强的对比度.MRI是指在特定的频率激发下质子数为奇数的原子核(如氢质子)会因为能量共振而被激发,停止激发后,被激发的原子核释放能量,回到基态而产生弛豫现象,通过对氢质子信号的采集处理,可得到MRI.在现代医学中,MRI已经成为诊断和治疗人类疾病最有力的技术之一.传统MRI为了缩短弛豫时间和突出正常组织与病变组织的对比,引入了能够引起MRI信号变化的造影剂,大多数MRI造影剂都基于顺磁性螯合物,但为了降低对生理的影响,造影剂均在较低浓度下使用,这在一定程度上限制了MRI灵敏度及空间分辨率[1-2].改变组织对比度的另一种方法是更改在成像实验中检测到的水量。2005年,WOESSNER等[3]提出了具有缓慢交换氨基(—NH)或羟基(—OH)质子的低分子量化合物也可通过预饱和自旋向大体积水的化学交换饱和转移(CEST)来改变组织对比度.
作为一种新兴的MRI技术,CEST是基于化学交换,通过使用射频脉冲选择性饱和可交换质子,将饱和转移到水质子,即饱和转移(ST)效应,经过多次累加,使水质子被部分饱和,水信号下降,通过记录水信号下降的程度,间接测定可交换质子的信息,如图1所示.一般情况下,可交换质子的浓度都较低,通过CEST方法,检测水质子信号的变化大幅提高了低浓度质子的检测灵敏度.最初使用的CEST造影剂有糖类、氨基酸类、铵离子、杂环化合物等,由于其与水质子化学位移差距(Δ)较小,不能达到很好的ST效应,信号较差.要想获得较好的CEST造影效果,除了具有较大的Δ外,还应该满足以下两个条件:1) Δ≥ex,ex表示水交换速率;2) 纵向弛豫率(1)≤ex.其中条件1)要求交换速度在慢交换到中等交换区间之间,否则CEST难以检测;条件2)要求水质子可以被有效饱和,即交换速率要大于水质子的1,以保证水质子信号可以累加[4-5].
CEST造影剂可分为内源性CEST及外源性CEST造影剂.内源性CEST造影剂包括组织中含有羟基、氨基、酰胺基的物质,主要存在于细胞内[4].外源性CEST造影剂主要包括合成的不含金属的碘类CEST造影剂和顺磁性金属螯合物,由于后者中含顺磁性金属,通过伪接触位移作用(PCS)改变配位水质子或螯合结构中可交换质子的化学位移,然后通过配位水质子或螯合结构中可交换质子与自由水质子发生交换,实现CEST效果.相比于内源性CEST,外源性金属螯合物CEST结合水质子后,化学位移相化学位移差距更大,有利于获得较高的特异性检测.另外螯合物的结构和可交换质子的化学位移与环境的pH值、温度、离子等因素有关,因此镧系金属螯合物CEST常被设计成响应性CEST探针.此外,为了提高CEST检测灵敏度,AIME等[6]发现了第一个脂质体(Liposomes)CEST造影剂(简称LipoCEST),使用脂质体容纳大量的水分子,将顺磁性金属螯合物包裹在内,改变脂质体内水分子化学位移,提高可交换质子浓度,进而提高检测灵敏度.本文将主要介绍近些年开发的顺磁性镧系金属CEST造影剂以及镧系金属的脂质体造影剂[4, 7].
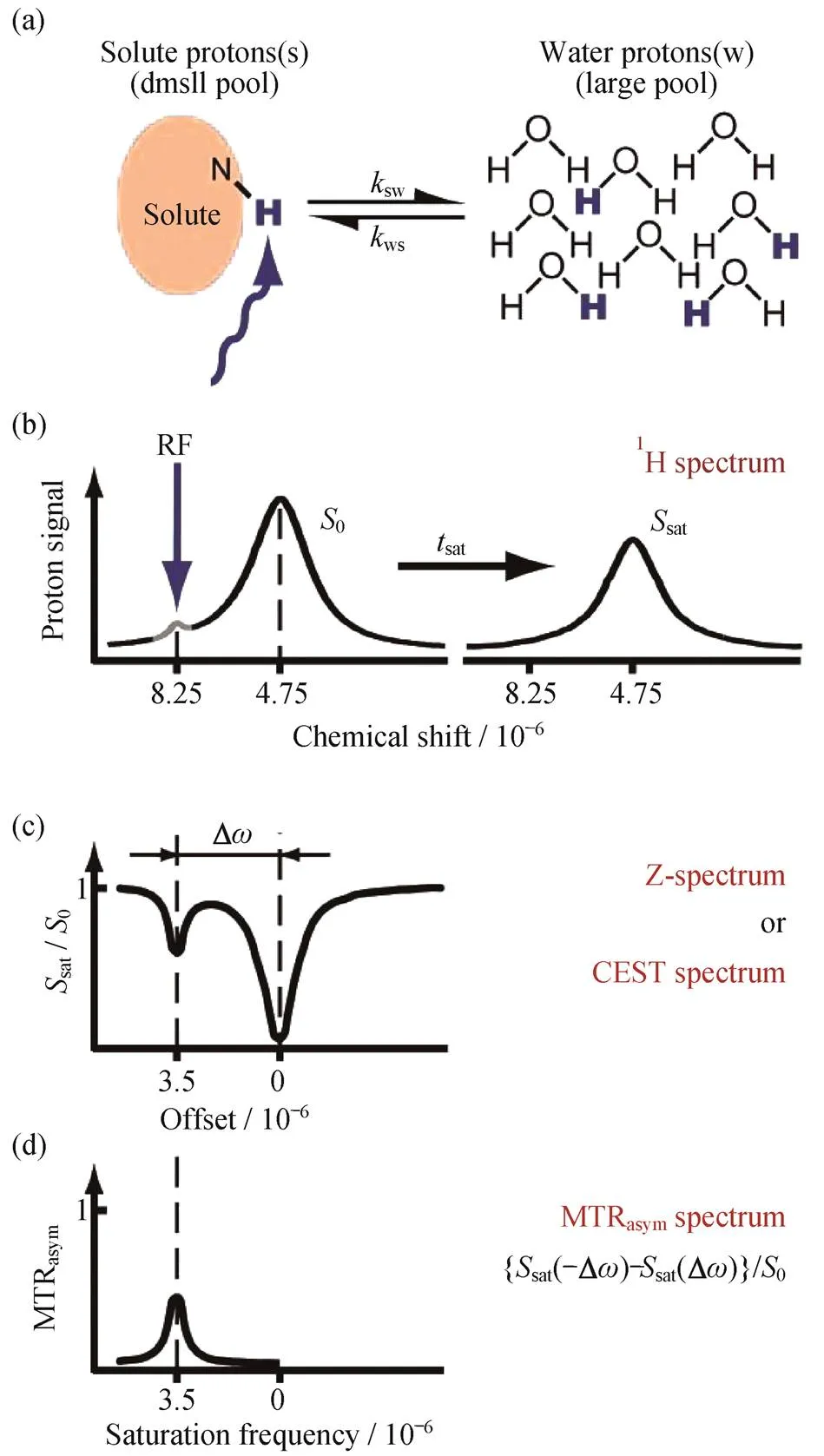
图1 CEST成像的原理及ST效应的测量方式
1 镧系金属螯合物CEST造影剂
镧系金属螯合物的顺磁化学位移高度偏移,源于自由水和配体或配位水分子上质子之间的质子交换,可以提高CEST造影剂的对比性,而且它们的质子共振远离水信号,因此能够实现选择性的饱和[8].其中,脂质体CEST是近些年来用于提高生物相容性和检测技术灵敏性的新型镧系金属螯合物CEST造影剂.
传统顺磁性螯合物的MRI效率取决于其影响周围水质子核弛豫率的能力,表现在与金属离子直接配位的水分子数(水合数:),结合水与水分子的交换速率(ex),以及螯合物的旋转动力学(旋转相关时间:R)这三个方面,如图2(a)所示.而CEST则代表了另一种产生磁共振图像的对比机制.在这里,将选择性射频辐射脉冲施加到外源或内源分子(CEST剂)的质子上,这些质子与组织本体水的质子进行缓慢的化学交换,如图2(b)所示.因此,它们具有更高的氢质子交换率(H),并且仍保持在缓慢的交换区间,获得更强的CEST效应[9].

图2 弛豫原理图.
(a) 传统影响稀土(Ln3+)螯合物弛豫性参数的示意图;(b) 具有质子与大量水缓慢交换的顺磁CEST造影剂
1.1 顺磁CEST剂
为了使CEST剂有效,应该在可移动质子的共振频率下施加预饱和脉冲,通过饱和镧系金属螯合物质子与本体水质子进行交换,减少本体水质子共振,这可以通过增加磁场强度或使用顺磁性CEST剂来实现.镧系和过渡金属系列的一些顺磁性金属离子可以在近1H核的信号中引起较大顺磁性位移,因此,顺磁性剂更可能满足中慢交换条件,从而提高对比度[10-12].
AIME等[13-14]报道了3种简单的DOTA-四酰胺配体(DOTAM,DTMA和DOTTA)的镧系金属螯合物的一些基本特性,如图3(a)所示.例如,AIME等[10, 15]在2002年报道了Yb-DOTAM-Gly的pH值在5.5~8.1范围内,是一种有效的pH响应探针,如图3(b)所示.对乳酸浓度敏感的[Yb(MBDO3AM)]3+(DOTA的衍生物MBDO3AM)如图3(c)所示.WOODS等[16]的研究影响了之后MRI造影剂的设计,包括响应性成像剂的设计,为顺磁化学交换饱和剂的开发奠定了基础.
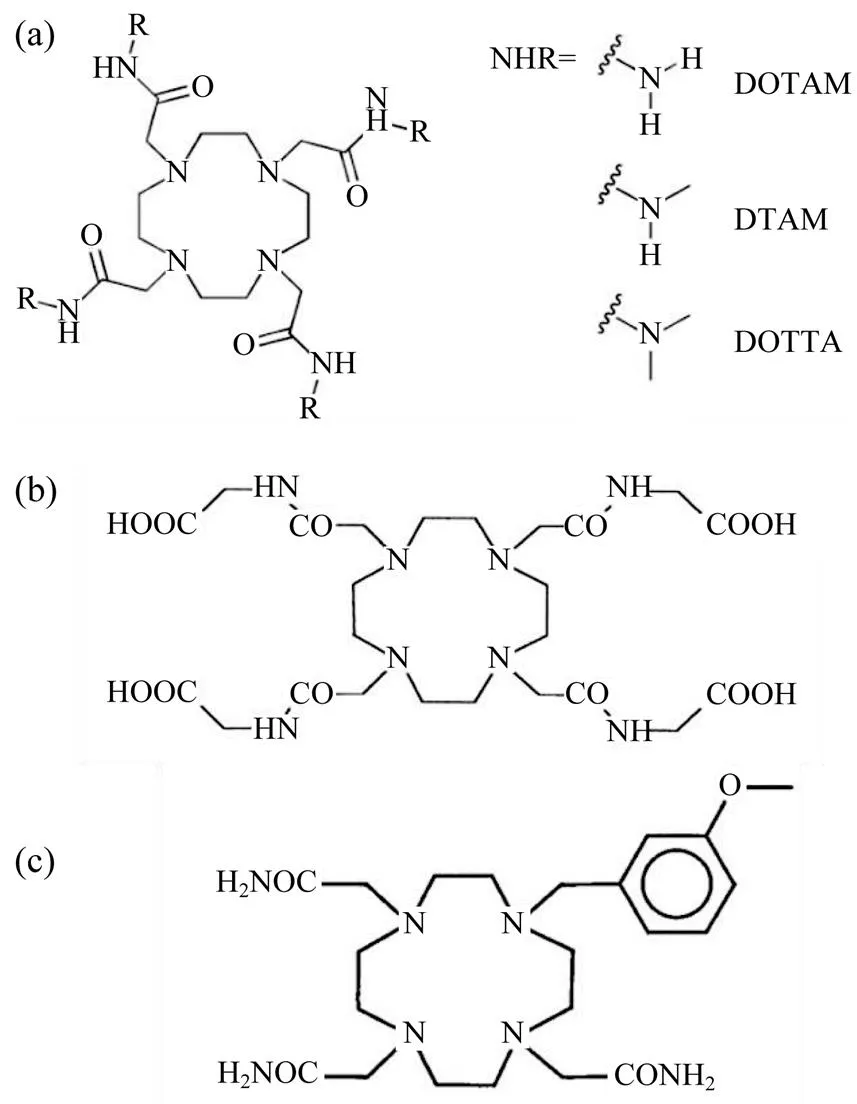
图3 常见顺磁CEST剂配体结构.
(a) DOTA-四酰胺配体(DOTAM,DTMA和DOTTA)的镧系金属螯合物;(b) DOTAM-Gly配体;(c) MBDO3AM配体
1.2 脂质体包裹镧系螯合物CEST剂
由于良好的生物相容性和多功能性,脂质体是一种应用广泛的纳米载体,是医学诊断和治疗中应用最多的纳米系统之一.脂质体由磷脂双分子层组成,具有亲水内核和疏水层,因此可作为纳米胶囊携带亲水性、疏水性或两亲性物质进入生物体内.脂质体是开发高灵敏度CEST剂的理想系统,能够将水截留在其纳米腔内.此外,脂质体膜是水可渗透的,可以通过改变脂质体膜的组成来适当地调节脂质体内水质子的交换速率.作为CEST造影剂,脂质体内水质子的共振频率必须与本体水质子不同,在脂质体腔中包封顺磁性镧系金属元素螯合物,可以改变脂质体内水分子的弛豫率.脂质体中心内核构成一个水质子池,可以使用射频脉冲选择性饱和,随后饱和被转移到主体相的未化学位移的水中,实现CEST成像.磁化传递的量以及CEST对比度由跨膜水扩散速率、脂质体内水的量和用于选择性饱和的射频功率决定[17].
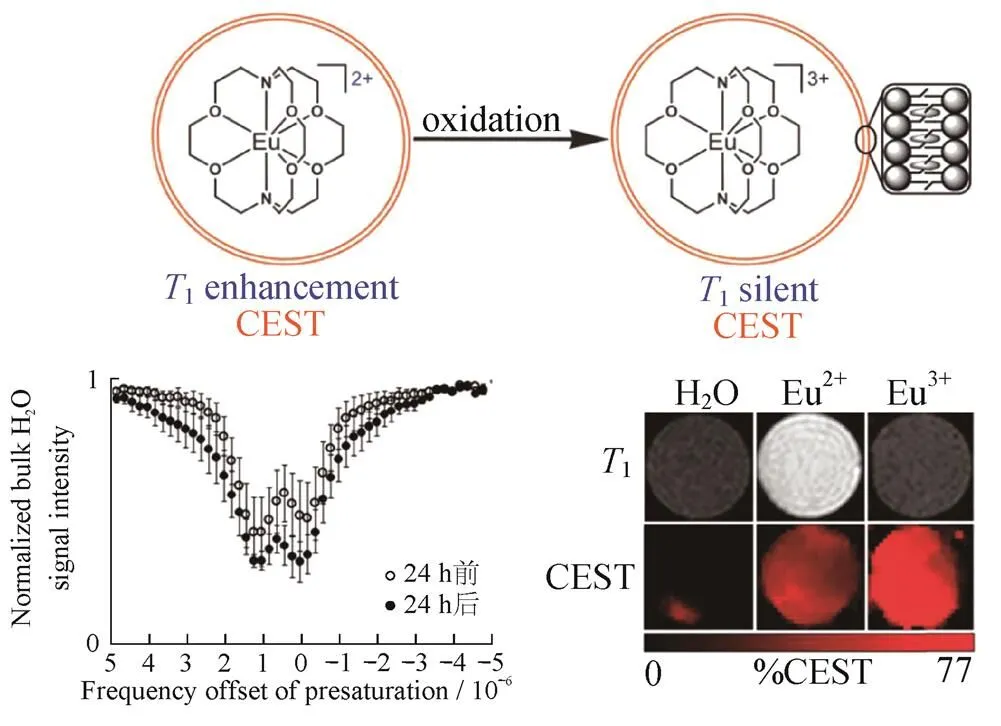
图4 脂质体Eu螯合物结构及性质.
(a) 脂质体包裹的Eu螯合物(1增强和CEST效应)氧化形成充满Eu3+的脂质体(1沉默和CEST效应);(b) 暴露于空气中24 h前和后脂质体包裹的Eu螯合物MRI图像及CEST图像
EKANGER等[18]报道了一种脂质体包封铕(Eu)的螯合物,因为Eu2+和Eu3+氧化态分别正交增强MRI中的纵向弛豫(1)加权图像和CEST图像,使用Eu2+螯合物和脂质体合成了用于MRI的氧化响应造影剂,因为用Eu2+观察到正对比度增强,在Eu3+氧化前后观察到CEST,氧化Eu2+螯合物(1增强剂)形成Eu3+(1沉默),如图4所示.Eu2+/3+氧化态开关为增强氧化响应对比度提供了理想的平台.该系统将为使用Eu2+/3+氧化还原开关的分子成像打开大门[18].
2 镧系金属螯合物CEST造影剂的应用
在过去的10年中,研究人员已经研究了许多分子作为CEST造影剂,CEST技术已经得到了广泛的应用,目前已开发出具有响应性CEST造影剂,用来检测生理环境的变化,如pH、温度、离子等,以及定量检测生物大分子浓度,如蛋白质、多肽、多糖等,具有很好的临床应用前景[19].
2.1 pH成像
镧系螯合物CEST造影剂本身对pH值具备固有的敏感性.曾经报道过的几种对pH敏感的顺磁CEST试剂基于交换Ln3+结合水分子作为CEST信号,但由于横向弛豫(2)交换,大量水信号会额外地使谱线加宽.RATNAKAR等[20]报道了一种对pH敏感的CEST剂Yb(1),如图5所示.该CEST剂缺少内部球形水分子,但含有一个用于CEST活化的Ln结合羟基基团.Yb3+螯合物显示出单个高度偏移的CEST峰,该峰源自可交换的Yb-OH质子,其频率在生物学相关的pH范围内变化.CEST峰的频率显示了在pH为6.1~7.3时,相当大的化学位移色散证明了该试剂具备pH成像的潜力[20].

图5 Yb(1)用于细胞成像.
(a) Yb(1)的结构;(b) 不同pH值下Yb(1)的CEST光谱图(9.4 T,25 ℃);(c) 在不同pH值(9.4 T,25 ℃)下,Yb(1)的CEST谱图;(d) 在25℃下,化学位移对pH的校正曲线,以及这些数据与膦酸酯基质子化常数的拟合(实线);(e) 在不同pH值下,25 mmol·L-1Yb(1)的伪彩色CEST图像;(f) 显示CEST测量的pH与电极测量之间的一致性的线性图
2.2 细胞标记
MRI已被广泛用于跟踪体内植入的细胞,这些细胞先前已经用弛豫增强剂标记.然而,这种方法不适合跟踪多个细胞群,因为如果造影剂从标记细胞中释放,可能会导致结果混淆.FERRAUTO等[21]演示了如何使用CEST造影剂来克服这些问题.在封装顺磁性镧系金属位移试剂后,可以改变细胞内水共振的吸收频率,从而产生频率编码的CEST响应细胞,通过施加适当的射频辐射,这些细胞可以在MRI中可见.如图6所示,这些细胞分别用位于体内或胞质溶胶中的4种螯合物标记.含有Gd-HPDO3A的细胞信号强度较高,对于未标记的细胞,内源性可交换质子会产生2.5×10-6的信号.在含有用顺磁剂标记细胞的所有其他样本中,可检测到位移更大的CEST信号.细胞内水共振位移的幅度严格取决于所用的Ln-HPDO3A种类及其定位,从最低2.9×10-6(Eu-HPDO3A标记的细胞)到最高8×10-6(Dy-HPDO3A标记的细胞)不等[21].
(a) Ln-HPDO3A的化学结构;(b)1成像,2~5中细胞为Gd-HPDO3A,Eu-HPDO3A,Tm-HPDO3A或Dy-HPDO3A通过胞吞作用标记;6~9中细胞为Gd-HPDO3A,Eu-HPDO3A,TmHPDO3A或Dy-HPDO3A低渗溶胀标记;(c)2成像;(d,e) Dy-HPDO3A,Eu-HPDO3A,GdHPDO3A和Tm-HPDO3A标记的细胞的CEST谱(d)和ST谱(e)(其中虚线表示低渗性肿胀标记的细胞,实线表示由胞吞作用标记的细胞)
2.3 阳离子检测
由于内源性阳离子在生命系统中起重要作用,参与许多基本的生物过程,是所有生物生长和发育的基本要素,其检测受到越来越多的关注.金属的积累、转运、分布和输出受细胞及转运蛋白等的密切调控.金属离子稳态的破坏与许多病理现象有关,如癌症、神经退行性疾病或中风.因此,需要通过非侵入性技术对活系统中的这些离子进行成像和定量,以更好地了解它们的作用和分布,并进行早期临床诊断[22].
通过MRI评估细胞外钙浓度的变化是监测大脑神经元活动有价值的生物医学研究工具.ANGELOVSKI等[22]报道了一种新的Yb3+和Eu3+螯合物——EuL1和YbL1,用于与Ca2+结合,对Ca2+的存在作出反应.结合后,CEST效应显著降低(YbL1从60%降至20%,EuL1从35%降至10%),如图7所示.

图7 Yb3+和Eu3+螯合物用于阳离子检测.
(a) EuL1和YbL1的合成路线及结构;(b) 相对于预饱和频率的溶剂水信号强度(CEST 光谱),在纯材料EuL1、物质的量之比(EuL1)∶(Ca2+)为1∶5以及1∶100的情况下,20 mmol·L-1EuL1水溶液的CEST光谱;(c) 在纯材料YbL1、物质的量之比(YbL1)∶(Ca2+)为1∶5以及1∶100的情况下,20 mmol·L-1的 YbL1水溶液的CEST光谱
2.4 组织代谢测定
以高空间分辨率对葡萄糖的组织分布进行成像有助于对其代谢进行研究,绘制各器官中葡萄糖的分布图,确定哪些组织在产生葡萄糖(甚至可以定量检测到梯度分布),实时评估组织对葡萄糖利用的差异.这可以提供有关葡萄糖的生产、储存、运输和使用以及代谢的情况,该信息对于糖尿病患者的治疗是非常宝贵的[23].
JIMIN等[24]报道了一种对葡萄糖(Glc)具有显著结合亲和力和选择性的含苯硼酸盐的顺磁性CEST试剂.这一发现为通过CEST MRI监测器官中的葡萄糖水平提供了新的可能.如图8所示,该试剂含有顺磁性镧系金属Eu3+,与含有葡萄糖识别位点的大环配体螯合.通过相同成像条件比较两个分离的灌注肝脏的CEST图像,在37 ℃下,通过观察来自灌注的饲喂小鼠肝脏和24 h禁食小鼠肝脏的CEST谱,显示在42×10-6的预饱和脉冲处葡萄糖诱导的CEST峰进行对比,证明了在分离的灌注肝脏中进行葡萄糖的CEST可行性检测,并证实在这些肝脏中发现的图像对比度确实是由于葡萄糖含量所致.

图8 EuDOTAM-2M-2PB用于组织代谢测定.
(a) EuDOTAM-2M-2PB的结构式(左)和与葡萄糖分子的结合模型(右);(b) 灌注喂养的小鼠肝脏和禁食24 h的小鼠肝脏的CEST谱(c) 对于预饱和脉冲不在42×10-6的CEST图像,显示两个肝脏之间对比度没有明显差异;(d) 显示喂食肝脏相对于禁食小鼠肝脏在42×10-6时图像变暗;(e) 显示了进食和禁食小鼠肝脏之间葡萄糖诱导的CEST对比
3 结 论
作为一种极具发展前景的MRI造影剂,CEST技术以其独特的非侵入性、无辐射、空间分辨率高、可利用人体内的物质作为MRI造影剂等优点得到了广泛的研究.从上述例子可知,镧系金属螯合物CEST造影剂可以应用于pH、温度、多糖、组织代谢及离子等检测,应用面十分广泛,为治疗诊断学提供了独特的机会.镧系金属螯合物CEST造影剂的体内应用迄今仍受到一定限制,但是它们清楚地表明了CEST检测技术对于组织pH、代谢、阳离子测定及细胞标记等的可行性,这也为将来CEST造影剂应用到临床提供重要的指导.镧系金属的磁性与螯合物的多样性为镧系金属螯合物CEST造影剂创造了一些新的想法以及机会.希望在不久的将来,镧系金属螯合物CEST造影剂对MRI领域的贡献能越来越多.
[1] BONNET C S, ÉVA T. Magnetic resonance imaging contrast agents [J]. Supramolecular Chemistry, 2012.DOI: 10.1002/9780470661345.smc104.
[2] JONES K M, POLLARD A C, PAGEL M D. Clinical applications of chemical exchange saturation transfer (CEST) MRI [J]. Journal of Magnetic Resonance Imaging, 2018,47(1):11-27.
[3] WOESSNER D E, ZHANG S, MERRITT M E, et al. Numerical solution of the Bloch equations provides insights into the optimum design of PARACEST agents for MRI [J]. Magnetic Resonance in Medicine, 2005,53(4):790-799.
[4] VINOGRADOV E, SHERRY A D, LENKINSKI R E. CEST: from basic principles to applications, challenges and opportunities [J]. Journal of Magnetic Resonance, 2013,229:155-172.
[5] VAN ZIJL P C, YADAV N N. Chemical exchange saturation transfer (CEST): what is in a name and what isn’t? [J]. Magnetic Resonance in Medicine, 2011,65(4):927-948.
[6] AIME S, DELLI CASTELLI D, LAWSON D, et al. Gd-loaded liposomes as1, susceptibility, and CEST agents, all in one [J]. Journal of the American Chemical Society, 2007,129(9):2430-2431.
[7] WOODS M, WOESSNER D E, SHERRY A D. Paramagnetic lanthanide complexes as PARACEST agents for medical imaging [J]. Chemical Society Reviews, 2006,35(6):500-511.
[8] HAN Z, LIU G. CEST MRI trackable nanoparticle drug delivery systems [J]. Biomedical Materials, 2021,16(2): 024103.
[9] LACERDA S, TOTH E. Lanthanide complexes in molecular magnetic resonance imaging and theranostics [J]. Chem Med Chem, 2017,12(12):883-894.
[10] AIME S, DELLI C D, FEDELI F, et al. A paramagnetic MRI-CEST agent responsive to lactate concentration [J]. Journal of the American Chemical Society, 2002,124(32):9364-9365.
[11] HUANG C H, MORROW J R. A PARACEST agent responsive to inner-and outer-sphere phosphate ester interactions for MRI applications [J]. Journal of the American Chemical Society, 2009,131(12):4206-4207.
[12] WAHSNER J, GALE E M, RODRIGUEZ-RODRIGUEZ A, et al. Chemistry of MRI contrast agents: current challenges and new frontiers [J]. Chemical Reviews, 2019,119(2):957-1057.
[13] AIME S, BARGE A, BOTTA M, et al. Prototropicvswhole water exchange contributions to the solvent relaxation enhancement in the aqueous solution of a cationic Gd3+macrocyclic complex [J]. Journal of the American Chemical Society, 1997, 119(20): 4767-4768.
[14] AIME S, BARGE A, BRUCE J I, et al. NMR, relaxometric, and structural studies of the hydration and exchange dynamics of cationic lanthanide complexes of macrocyclic tetraamide ligands [J]. Journal of the American Chemical Society, 1999,121(24):5762-5771.
[15] AIME S, BARGE A, DELLI C D, et al. Paramagnetic lanthanide(III) complexes as pH-sensitive chemical exchange saturation transfer (CEST) contrast agents for MRI applications [J]. Magnetic Resonance in Medicine, 2002,47(4):639-648.
[16] WOODS M, PASHA A, ZHAO P, et al. Investigations into whole water, prototropic and amide proton exchange in lanthanide(III) DOTA-tetraamide chelates [J]. Dalton Transactions, 2011,40(25):6759-6764.
[17] TRIPEPI M, FERRAUTO G, BENNARDI P O, et al. Multilamellar LipoCEST agents obtained from osmotic shrinkage of paramagnetically loaded giant unilamellar vescicles (GUVs) [J]. Angewandte Chemie International Edition, 2020,59(6):2279-2283.
[18] EKANGER L A, ALI M M, ALLEN M J. Oxidation-responsive Eu(2+/3+)-liposomal contrast agent for dual-mode magnetic resonance imaging [J]. Chemical Communications, 2014,50(94):14835-14838.
[19] CARNIATO F, FERRAUTO G, MUÑOZ-ÚBEDA M, et al. Water diffusion modulates the CEST effect on Tb(III)-mesoporous silica probes [J]. Magnetochemistry, 2020,6(3):54-67.
[20] RATNAKAR S J, CHIRAYIL S, FUNK A M, et al. A frequency-selective pH-responsive paraCEST agent [J]. Angewandte Chemie International Edition, 2020,59(48):21671-21676.
[21] FERRAUTO G, DI GREGORIO E, DELLI C D, et al. CEST-MRI studies of cells loaded with lanthanide shift reagents [J]. Magnetic Resonance in Medicine, 2018,80(4):1626-1637.
[22] ANGELOVSKI G, CHAUVIN T, POHMANN R, et al. Calcium-responsive paramagnetic CEST agents [J]. Bioorganic and Medicinal Chemistry, 2011,19(3):1097-1105.
[23] CAMERON J D, CRUICKSHANK J K. Glucose, insulin, diabetes and mechanisms of arterial dysfunction [J]. Clinical and Experimental Pharmacology and Physiology, 2007,34(7):677-682.
[24] JIMIN R R T, ZHANG S R,CRAIG R M, et al. Imaging the tissue distribution of glucose in livers using a paraCEST sensor [J]. Magnetic Resonance in Medicine, 2008,60:1047-1055.
Research progress of lanthanide metal chelates as CEST MRI contrast agents
YANGJingxia, JIAOJingjing*
(College of Chemistry and Materials Science, Shanghai Normal University, Shanghai 200234, China)
Chemical exchange saturation transfer(CEST) imaging is a novel magnetic resonance imaging(MRI) method based on the phenomenon of chemical shift. The information of exchangeable protons can be indirectly determined by detecting the change of water proton signal. The lanthanide metal chelates have large paramagnetic chemical shifts and their proton resonance shifts are farther away from the water signal, which is feasible to achieve more selective saturation and improve the contrast of MRI. Therefore, the lanthanide metal chelates are very suitable as CEST contrast agents and have great potentials in further expanding their magnetic resonance function and molecular imaging capabilities. This review mainly summarizes the types and applications of the lanthanide metal chelates as CEST MRI contrast agents.
lanthanide metal chelate; chemical exchange saturation transfer(CEST); magnetic resonance imaging(MRI); contrast agents
10.3969/J.ISSN.1000-5137.2022.04.010
2021-05-27
国家自然科学基金青年项目(21901164);上海市晨光计划(18CG48);上海市科技扬帆计划(19YF1436100)
杨景霞(1997—), 女, 硕士研究生, 主要从事铁基配合物的设计合成及其在磁共振成像应用方面的研究. E-mail: yangjx0730@163.com
焦静静(1989—), 女, 讲师, 主要从事具有生物相容性的超分子笼的设计组装和应用方面的研究. E-mail: jiaojj@shnu.edu.cn
杨景霞, 焦静静. 镧系金属螯合物作为CEST磁共振造影剂的研究进展 [J]. 上海师范大学学报(自然科学版), 2022,51(4):458‒466.
YANG J X, JIAO J J. Research progress of lanthanide metal chelates as CEST MRI contrast agents [J].Journal of Shanghai Normal University(Natural Sciences), 2022,51(4):458‒466.
O 614.33; R 318.6
A
1000-5137(2022)04-0458-09
(责任编辑:郁慧)
