一氧化氮治疗肿瘤的研究进展
2022-09-15王丽凯田娅吴惠霞
王丽凯, 田娅, 吴惠霞
一氧化氮治疗肿瘤的研究进展
王丽凯, 田娅, 吴惠霞*
(上海师范大学 化学与材料科学学院,上海 200234)
一氧化氮(NO)是一种半衰期很短的气体分子,对细胞膜具有高穿透性,能在人体内传递重要信息,并具有调节细胞的功能.NO气体分子既能维持正常细胞的生理功能和活性,又能选择性地快速耗尽肿瘤细胞的能量,诱导肿瘤细胞凋亡.研究表明:NO可以通过多种机制实现肿瘤治疗.已有一些NO供体药物表现出良好的抗肿瘤活性,精确控制NO在肿瘤部位的释放,可杀死肿瘤细胞.因此,NO气体疗法作为一种肿瘤治疗策略具有一定的应用前景.文章简述了NO的生理学特性和几种典型的NO供体,以及释放NO的生物材料在生物医学领域的应用进展.
一氧化氮(NO); NO供体; 肿瘤; 气体治疗; 生物材料
0 引 言
一氧化氮(NO)是一氧化氮合酶(NOS)作用产生的半衰期仅为3-5 s的分子.NO分子中有一个未成对电子,可形成自由基,对多种生物分子具有很高的反应性.NO具有脂溶性,可以快速透过生物膜扩散,在体内极不稳定,能迅速被血红蛋白、氧自由基或氢醌等灭活.NO可以对血管生成和舒张、细胞周期、细胞凋亡、侵袭和转移等过程进行调节,从而影响细胞功能.NO还能与二氧化氮(NO2)反应生成三氧化二氮(N2O3),并能与超氧化物反应生成过氧亚硝酸盐(ONOO-).N2O3和ONOO-这2种分子均可通过亚硝化或氧化应激引起DNA损伤:N2O3可以通过胺的亚硝化作用导致N‒亚硝胺的形成,进而损伤DNA;过氧亚硝酸盐可以氧化和硝化DNA,并导致单链DNA断裂[1].NO的生物效应通常取决于分子的形成、代谢、NOS的类型和NO的浓度等.
在过去的几十年中,人们一直在努力研究NO对癌生物学的影响.多年来,NO在致癌和抗肿瘤进展中有着较大的误解和争议,因为它同时具有促进肿瘤细胞生长和杀死肿瘤细胞的能力.然而,确定哪种作用占优势是很复杂的,包括但不限于NO存在的时间、位置、浓度和肿瘤微环境[2].NO生成过多或者生成不足都会引起基因突变、肿瘤等.近年来,许多气体纳米发生器已经能够通过被动或主动靶向聚集在肿瘤部位,在内源性或外源性刺激下有效控制气体分子的释放.因此,无论是单独使用NO还是与其他治疗方式联合使用,这些发现都使NO广泛应用于抗癌剂[3].目前,气体治疗已成为一种新兴的、安全有效的抗癌治疗策略.
1 NO的生理学特性
1.1 NO的生物合成
细胞合成NO的主要途径是通过NOS的酶促作用将L‒精氨酸转化为L‒瓜氨酸,并释放出NO,如图1所示[4].NOS是一种同工酶,选择性分布在不同脑区的神经元中,其同工酶有3种亚型,即神经型一氧化氮合酶(nNOS)、诱导型一氧化氮合酶(iNOS)和内皮型一氧化氮合酶(eNOS).其中,eNOS和nNOS在细胞处于生理状态下即可组成性表达,并可因细胞内钙增加而被钙调蛋白激活;iNOS是非钙依赖型的,当细胞受到内源性或外源性刺激时,可在较短的时间内产生高浓度的NO[4].
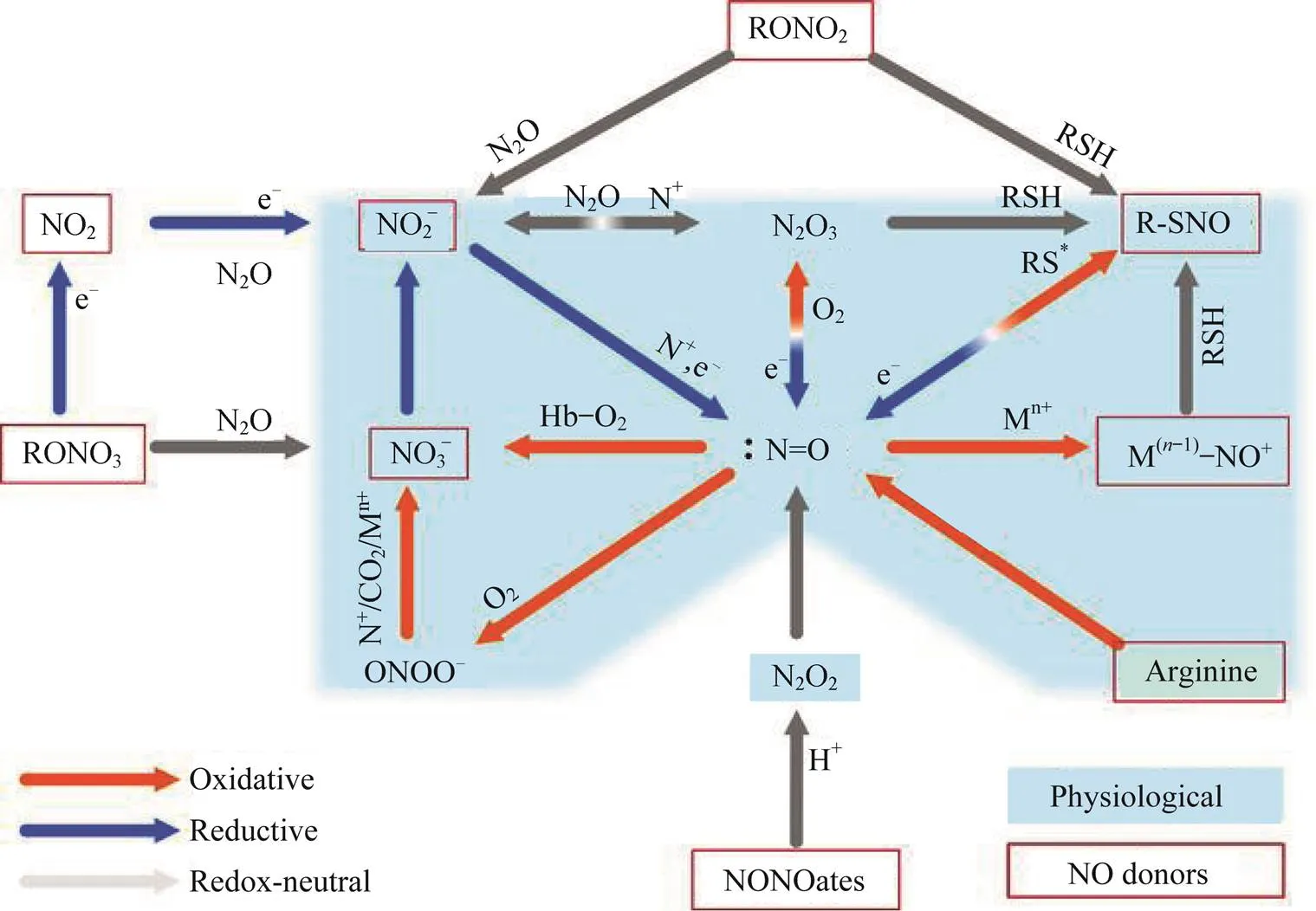
图1 NO的生物合成和代谢示意图
此外,还可以通过硝酸盐→亚硝酸盐→NO途径合成NO.体内的硝酸盐主要来自膳食和自身合成.在生物体内,循环的硝酸盐被唾液腺主动摄取,并被口腔中的细菌还原为亚硝酸盐,在血液和组织中进一步代谢为NO和其他生物活性氮氧化物[5].亚硝酸盐是氮氧化物的氧化还原过程中的中间产物,在血液和组织中比较稳定,且可被多种物质还原成NO,包括肌红蛋白、血红蛋白、抗坏血酸、黄嘌呤氧化还原酶、质子和多酚[5].这些途径产生的NO会因缺氧和酸中毒条件而增加,因而可以保证NO的产量.
1.2 NO的生物学作用
NO可以自由地通过生物膜并参与一系列生理和病理过程,如神经信号传递、血管扩张、血小板黏附和聚集等,在生物体内发挥着至关重要的作用.NO的生物学作用是通过直接或间接的化学反应产生的.例如,NO直接与不同蛋白质的金属配合物结合形成金属亚硝酰基配合物来调节靶蛋白的生物学活性.NO还可以与多种内源性自由基反应,产生活性氮氧化合物,这些强毒性的活性氮氧化合物将导致线粒体损伤,进而诱导细胞凋亡.
NO在生物体内像一把双刃剑,因为它既具有杀死肿瘤细胞的作用,又具有促进肿瘤细胞生长的作用.在低生理水平下,NO可作为抗氧化剂,减少芬顿反应,终止自由基链式反应,并抑制过氧化物酶和氧化酶的活性.较高浓度的NO能够舒张血管,改善组织缺氧状态,有利于化疗药物的渗透,对肿瘤细胞具有杀伤作用[6].但是,持续过量的NO将产生神经毒性,影响体内平衡和改变蛋白质功能,从而导致基因突变,最终使正常黏膜癌变[7].
不同组织中的生理过程对NO的需求量各不相同,浓度过高或者过低都会对组织造成一定的损伤,引起疾病的发生[8].只要将适当浓度的NO递送至肿瘤部位,NO的靶向释放也可能增强化学疗法和放射疗法的疗效.因此,如何将适当浓度的NO靶向释放至肿瘤,已成为近年来生物医学领域的研究重点.
2 NO供体
直接使用外源性或内源性NO的缺点是其半衰期极短,且易受各种谷胱甘肽(GSH)、超氧化物和血红蛋白等物质的影响.因此,将NO供体载入纳米平台中,直接和精确地控制NO的靶向释放,有很好的应用前景.NO供体是指在体内经酶促反应或非酶促反应释放NO的一类化合物,如有机硝酸盐、有机亚硝酸盐、S‒亚硝基硫醇(RSNO)、金属配合物等多种化学物质已被用作NO供体,用于各种生物或医学领域[9],如图2所示.
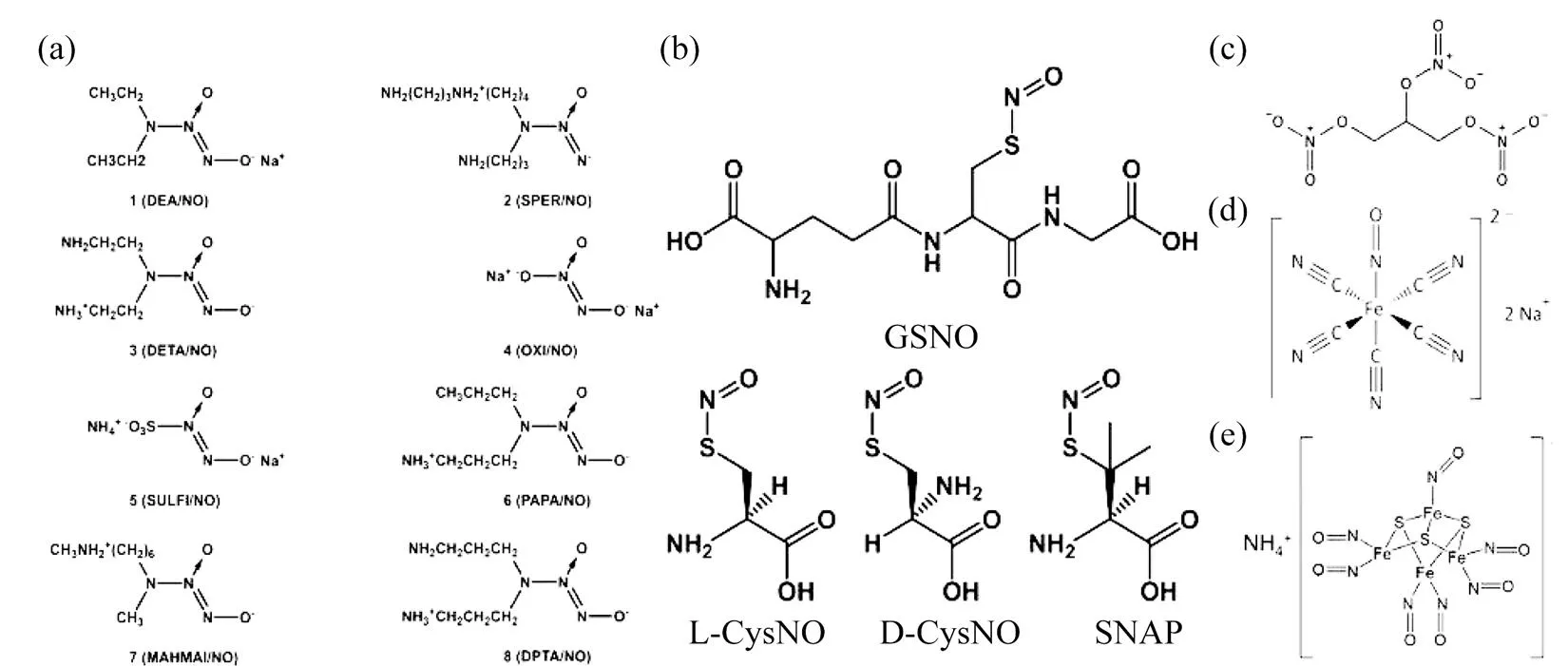
图2 常用的NO供体的化学结构
(a) 偶氮二醇烯鎓盐;(b) S‒亚硝基硫醇;(c) 硝化甘油;(d) 硝普钠;(e) 陆森黑盐
2.1 有机硝酸酯(RONO2)及有机亚硝酸酯类
RONO2是醇的硝酸酯,是最早的、目前最常用的NO供体.它们可以通过相应醇的酯化反应或烷基卤化物与AgNO3的反应来合成,如图3所示[10].这类供体的优点是给药途径比较广,但容易产生耐药性.硝酸甘油(GTN)和单硝酸异山梨酯(ISMN)是临床研究中使用最广泛的NO供体类药物.它们有几个既定的临床应用:GTN是一种廉价又有效的、能快速逆转与急性心绞痛有关疼痛的药物;ISMN是RONO2中释放NO较慢的一种,已被用于治疗慢性心绞痛[11].
与RONO2类似,有机亚硝酸酯是醇类和亚硝酸酯化形成的酯.它们主要通过醇与亚硝酰氯(NOCl)反应或醇与NO和氧气(O2)经过酯化反应来合成,如图3所示[12].有机亚硝酸酯的主要作用是舒张静脉和降低血压,例如,亚硝酸丁酯(BN)、亚硝酸异丁酯(ISBN)和亚硝酸叔丁酯(TBN)已在临床上用作血管扩张剂[13].与GTN等RONO2相比,它们对酶的依赖性更低、作用效力更高,且不易引起耐药性.但是,它们缺乏选择性和生物利用度,以及细胞毒性和致癌性较高,因此不如RONO2常用[14].

图3 RONO2和有机亚硝酸酯的合成机理
2.2 RSNO类
RSNO是贮存、运输和释放NO的重要载体,在生物体内具有重要的生理作用.RSNO普遍存在于生物体的血液和组织中,只需要一个电子就能引发NO的释放,因此,可通过光、热、碱性pH值、过渡金属离子、抗坏血酸和酶等促使RSNO自发均裂反应产生NO[15].人工合成的RSNO是新型的NO供体类药物,通过静脉等途径进入体内后,可以参与呼吸、心血管、消化等多个系统疾病的诊断和治疗[16].
2.3 金属-一氧化氮配合物
NO是金属配合物中的强配体,它的结合常数比一氧化碳(CO)和O2高得多,具有多种氧化态,氧化价态的高低决定了配合物中NO的反应性.NO调节信号通路的主要机制是与金属中心原子(如铁(Fe)、钌(Ru)等)结合,如图4所示[12],如血红素基团或蛋白质的铁硫簇.硝普钠(SNP)已经广泛应用于急性降压药物和动静脉血管扩张剂,其血管舒张作用是由NO的产生而造成的[17].SNP晶体在避光且干燥的条件下可以长时间保存,光和O2会促使其水溶液分解,并释放出NO和氰化物,从而导致“氰化物毒性”,对机体造成伤害[18].
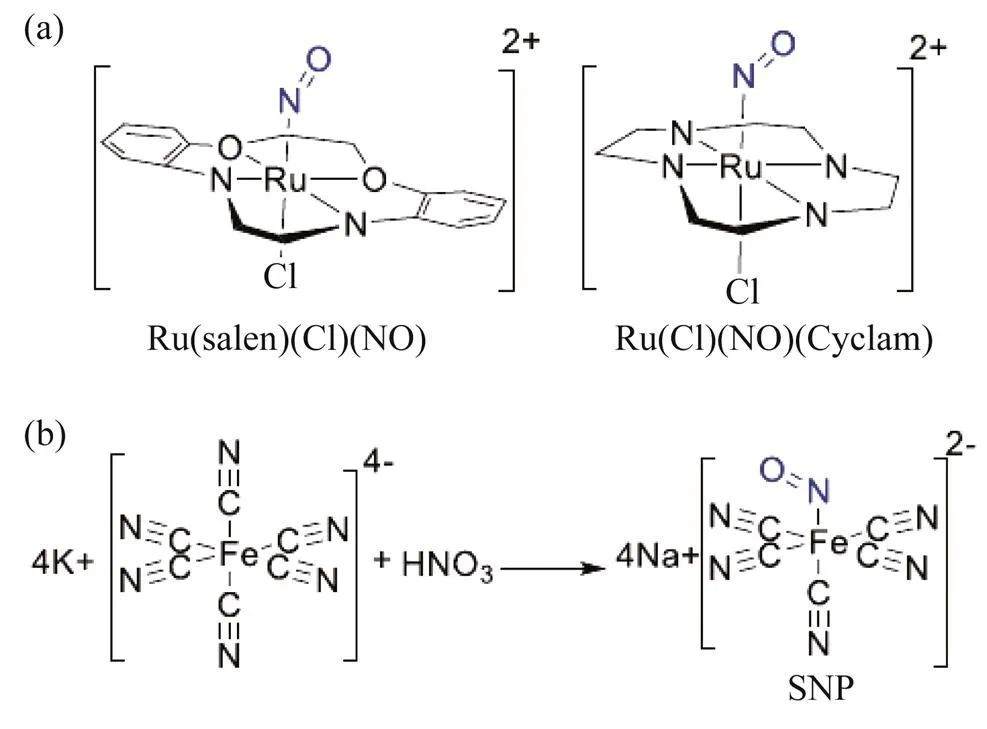
图4 (a) 释放NO的金属配合物的结构示例以及(b) SNP合成的机理示意图
除了Fe之外,Ru对NO也有很高的亲和力,且Ru对NO的亲和力可以随着其他配体的改变而变化,以便调节NO的释放.光活性Ru配合物热稳定性好,且能在紫外光照射下释放NO.然而,NO的有效释放需要使用对组织有害的高功率紫外线,这一缺陷阻碍了该类NO供体的临床应用[19].
2.4 其他供体
1956年MAGEE等[20]发现了二甲基亚硝胺和亚硝胺二甲胺均可致大鼠肝癌.其致癌作用是由于N-亚硝基化合物会导致蛋白质和核酸的烷基化.但是,N-亚硝胺却是一种能舒张血管的NO供体.链脲霉素(STZ)含有N-亚硝胺基团,具有抗肿瘤、致糖尿病和致癌作用[21].胰腺β细胞具有低水平的活性氧(ROS)清除酶,对NO和ROS比较敏感,STZ能在胰岛β细胞中释放NO,使细胞的DNA受到损害[22].因此,可将此类NO供体作为抗癌药物进行研究.
偶氮二醇烯鎓盐(NONOates)释放NO的机制遵循动力学且不受细胞代谢产物或酶的催化.它们以固体形态稳定存在,但在生理条件下会自发分解生成NO,分解速率会因结构、温度和pH值而改变[23].因此,可以通过它们在体外的分解速率直接预测药物的持续作用时间.研究证明:NONOates能够降低多种肿瘤细胞的增长速率,抑制肿瘤细胞的生长[24].
3 应 用
3.1 NO与癌症治疗
3.1.1乳腺癌
乳腺癌组织及细胞系中NOS的活性明显高于正常乳腺组织和良性乳腺疾病,乳腺癌组织级别越高,NOS的活性越强,NOS阳性表达的患者预后极差[25].研究表明:NO在乳腺癌治疗中的作用具有浓度依赖性.低生理浓度的NO可以促进肿瘤的生长;超生理浓度的NO可激活p53的表达,并终止DNA修复酶的功能,从而抑制肿瘤生长和诱导细胞凋亡[26].因此,可以利用NO供体药物使NO的浓度达到细胞毒性水平来实现癌症治疗.此外,NO还能降低肿瘤细胞P-gp转运蛋白的活性,逆转肿瘤细胞的多药耐药性.
3.1.2肺 癌
肺癌的致病因素主要是吸烟.吸烟会导致白细胞增多,进一步导致NO和其他ROS代谢物积累.研究表明:蛋白的硝基化作用可能损害抗氧化蛋白质和参与细胞代谢的蛋白质,从而造成肺癌的发生[27].NO供体药物可能会将NO浓度提高到细胞毒性水平,绕过肿瘤发生的生理机制,可起到抑制肿瘤生长的作用[28].
3.1.3胃 癌
胃癌的主要致病因素之一是长期摄入亚硝基化合物.胃酸和抗坏血酸会使亚硝酸盐降解,并产生NO,损害DNA,从而诱发细胞凋亡.细胞凋亡的增加会导致萎缩性胃炎,进而促进胃黏膜细胞的增殖,最终造成胃癌的发生[29].NO供体药物使肿瘤微环境中NO水平升高,而NO气体分子能通过调节细胞代谢和相关基因表达实现抗肿瘤作用[30].
3.1.4其他癌症
iNOS在多数肿瘤组织中高表达,包括脑、泌尿生殖系统、皮肤、甲状腺和头颈部肿瘤[31].iNOS催化产生高浓度的NO,NO在超氧化物的作用下产生强毒性的活性氮氧化合物,损伤线粒体和DNA,导致基因突变,致使正常细胞癌变.此外,NO还可以通过线粒体和DNA的亚硝化作用直接或间接损伤DNA或抑制DNA的修复,从而杀死癌细胞.NO的复杂性和广泛地潜在相互作用,很容易影响到肿瘤附近或远处的正常细胞,使NO气体治疗的临床应用存在诸多问题,但是NO气体治疗的应用仍有很好的前景.
3.2 供体和联合疗法
由于大多数NO供体药物不稳定且生物利用度低,因此,非常需要开发载有NO供体的纳米递送系统,精准控制NO的输送和释放,并严格调节局部NO浓度,同时最大限度地减少副作用.研制的各种高生物安全性的纳米平台已经实现了NO的可控释放.
SUNG等[32]构建了一种具有延长的半衰期和持续释放机制的纳米释放系统(NanoNO).研究者以肝细胞癌为研究模型,利用NanoNO在肿瘤微环境中建立NO梯度,增强周细胞覆盖,增加血管灌注,减少肿瘤缺氧,从而促进肿瘤血管正常化,进而增强小分子抗癌药物和大分子抗癌药物在肝细胞癌模型中的传递,达到抑制肿瘤的目的,如图5所示.
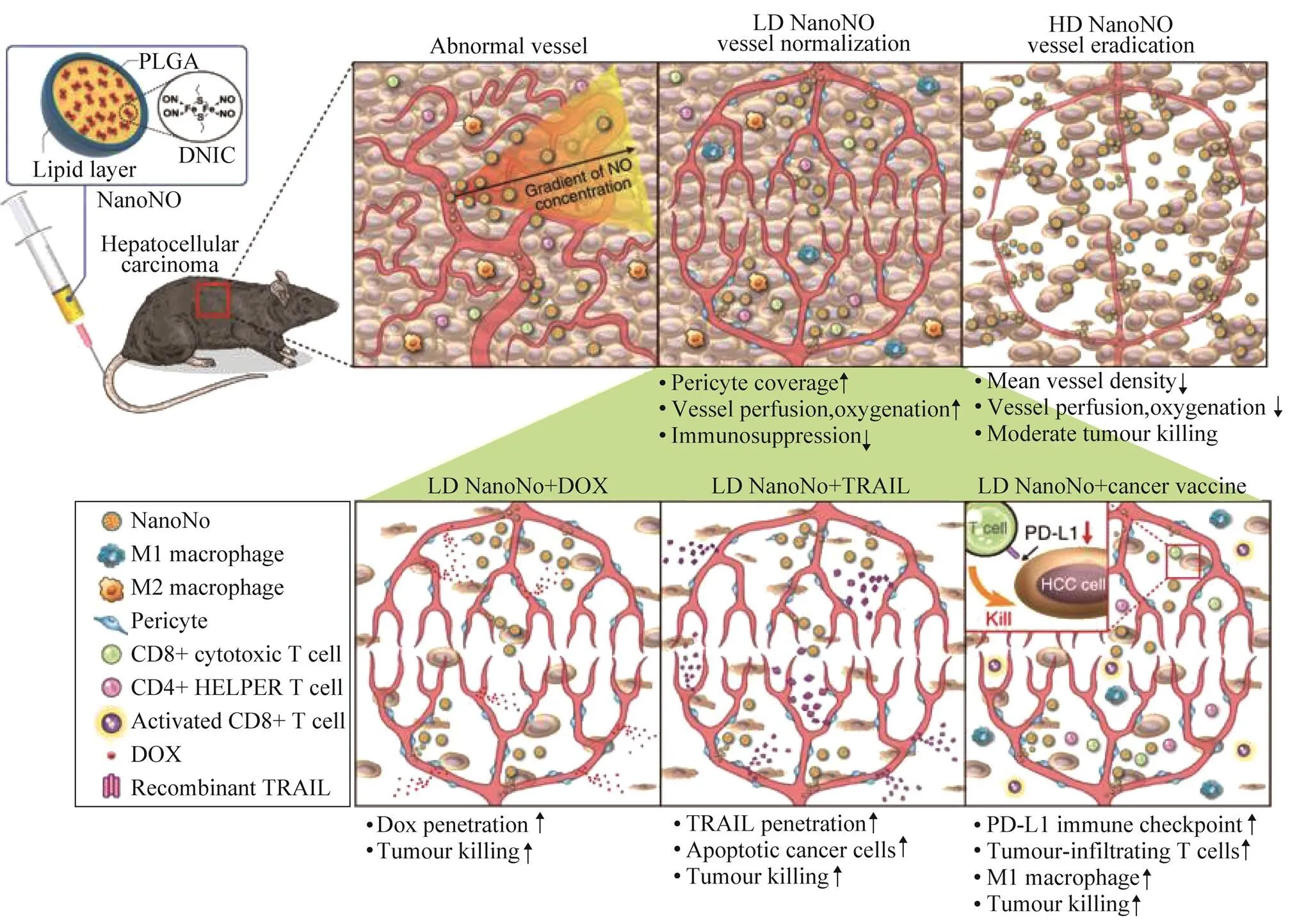
图5 NanoNO抑制小鼠肝细胞癌的机制示意图
LI等[33]报道了一种可植入的NO释放装置,以实现对癌症长期、远距离、远程可控的气体治疗.该装置由一个无线供电的发光二极管(wLED)和用聚二甲基硅氧烷(PDMS)包裹的S-亚硝基谷胱甘肽组成,从而获得一种可植入的NO释放装置(NO-wLED).该研究表明:当植入的NO-wLED通过无线充电辐照时,可以释放浓度达到0.43×10-6mol·L-1·min-1的NO,不仅明显抑制了原位癌的生长,还可以预防癌症的复发,如图6所示.
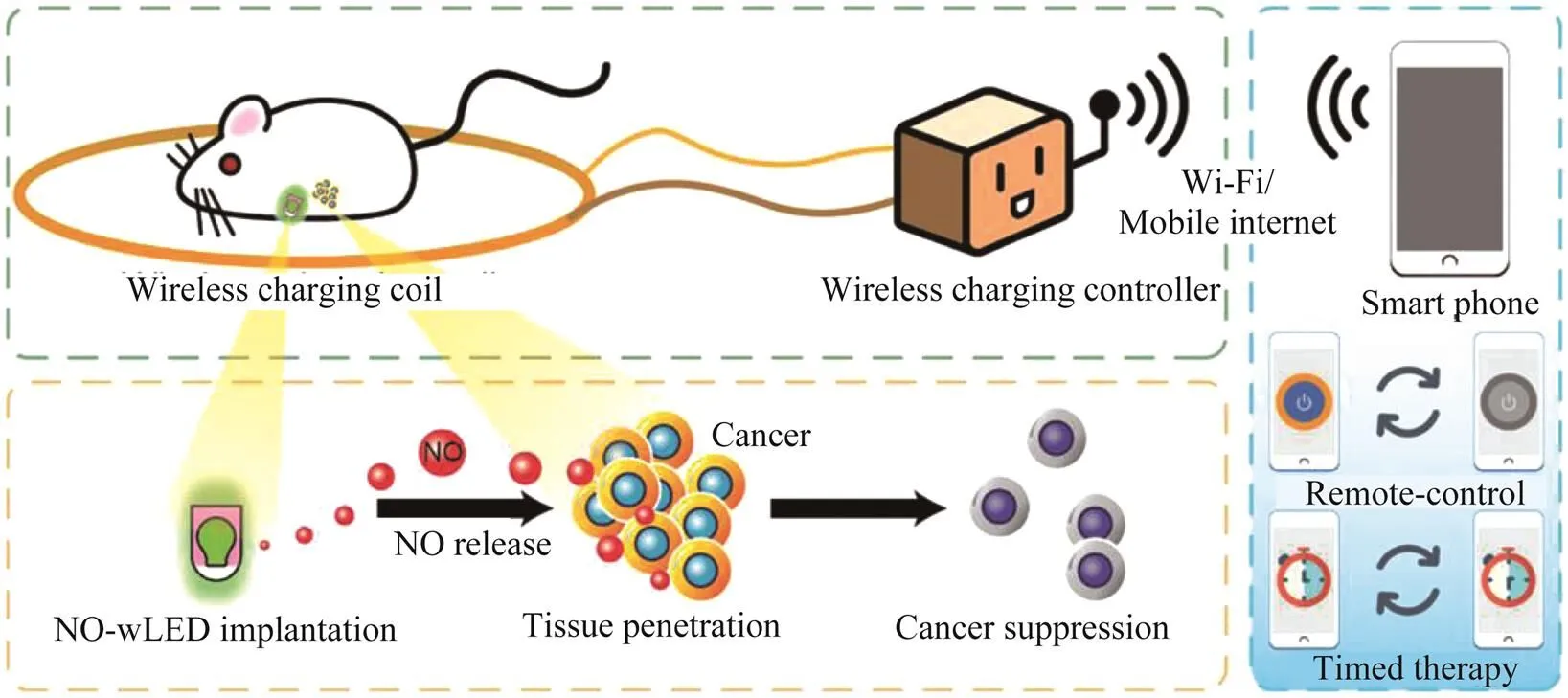
图6 通过无线充电的NO-wLED远程控制NO释放来进行癌症治疗的示意图
JIANG等[34]通过将稀土闪烁体纳米材料(NaYF4:Gd/Tb)与光响应性NO供体(RBS)相结合,设计了一种新型的、软X射线激活的、持续发光的纳米传感器(NaYF4:Gd/Tb-RBS),实现了对NO可控的、长时间释放的和深部组织(高达3 cm)的抗癌治疗.所设计的基于稀土闪烁体的NO气体递质在超低剂量(45 kVp,0.18-0.85 mGy)软X射线照射下对肿瘤生长有显著的抑制作用,为深度非依赖性气体敏化治疗应用提供了一种新的NO释放策略,如图7所示.

图7 设计NaYF4:Gd/Tb-RBS纳米复合材料用于超低剂量软X射线触发NO释放的示意图
ZHENG等[35]开发了一种基于氧化石墨相氮化碳(OCN)纳米片的纳米平台,用于声动力学和NO联合治疗癌症.依次用氨基封端的六臂聚乙二醇(PEG)、二氢卟吩e6(Ce6)和钆离子(Gd3+)修饰OCN纳米片,再载上NO供体(BNN6)后,即可得到OCN-PEG-(Ce6-Gd3+)/BNN6纳米复合材料.该纳米复合材料在超声(US)照射下可诱导ROS生成,并同时释放NO分子,有效杀死癌细胞,从而显著抑制肿瘤生长.通过尾静脉注射该纳米复合材料后,在肿瘤部位可获得良好的体内纵向弛豫(1)加权磁共振成像(MRI)对比效果.因此,OCN-PEG-(Ce6-Gd3+)/BNN6可作为MRI引导的声动力学-NO联合治疗的一种非常有前景的治疗药物,如图8所示.

图8 OCN-PEG-(Ce6-Gd3+)/BNN6在MRI引导的声动力学-NO联合疗法中的应用
4 总结和展望
NO作为一种自由基信号分子参与生物体内各种生理和病理过程,如神经信号传递、细胞凋亡、血管生成和免疫反应等.大量的研究表明NO可能通过多种机制实现肿瘤治疗:1) 使细胞能量代谢紊乱,诱导癌细胞死亡;2) 通过调节巨噬细胞的激活,阻碍肿瘤转移;3) 通过激活p53蛋白的表达,促进肿瘤细胞凋亡;4) 与超氧化物反应产生更致命的活性氮氧化合物,损害线粒体和DNA. NO气体治疗能够与声动力疗法、放射疗法、免疫疗法和化学疗法等相结合,增强现有药物的功效.
近年来,已经开发了多种可控释放NO的递送系统,它们可以精确调节局部NO的浓度,同时最大限度地减少对正常细胞的副作用.因而,NO气体治疗已成为一种非常有前景的癌症治疗新策略.但NO向肿瘤部位的受控递送仍然是治疗策略中的主要挑战内容.随着生物材料的进步,NO作为抗癌药物在临床研究中的应用将会越来越广泛.
[1] XU W, LIU L Z, LOIZIDOU M, et al. The role of nitric oxide in cancer [J]. Cell Research, 2002,12(5/6):311-320.
[2] SONI Y, SOFTNESS K, ARORA H, et al. The yin yang role of nitric oxide in prostate cancer [J].American Journal of Men’s Health, 2020,14(1):1557988320903191.
[3] HABIB S, ALI A. Biochemistry of nitric oxide[J]. Indian Journal of Clinical Biochemistry, 2011,26(1):3-17.
[4] MONCADA S, PALMER R M J, HIGGS E A. Biosynthesis of nitric oxide from l-arginine [J]. Biochemical Pharmacology, 1989,38(11):1709-1715.
[5] COSBY K, PARTOVI K S, CRAWFORD J H, et al. Nitrite reduction to nitric oxide by deoxyhemoglobin vasodilates the human circulation [J]. Nature Medicine, 2003,9(12):1498-1505.
[6] POSTOVIT L M, ADAMS M A, LASH G E, et al. Oxygen-mediated regulation of tumor cell invasiveness: involvement of a nitric oxide signaling pathway [J]. Journal of Biological Chemistry, 2002,277(38):35730-35737.
[7] ASTIER J, ROSSI J, CHATELAIN P, et al. Nitric oxide production and signalling in algae [J]. Journal of Experimental Botany, 2021,72(3):781-792.
[8] CARPENTER A W, SCHOENFISCH M H. Nitric oxide release: Part II. therapeutic applications [J]. Chemical Society Reviews, 2012,41(10):3742-3752.
[9] JIN G, GAO Z, LIU Y, et al. Polymeric nitric oxide delivery nanoplatforms for treating cancer, cardiovascular diseases, and infection[J]. Advanced Healthcare Materials, 2021,10(3):2001550.
[10] SUBAPRIYA R, KUMARAGURUPARAN R, RAMACHANDRAN C R, et al. Oxidant-antioxidant status in patients with oral squamous cell carcinomas at different intraoral sites[J]. Clinical Biochemistry, 2002,35(6):489-493.
[11] YELLON D M, HE Z, KHAMBATA R, et al. The GTN patch: a simple and effective new approach to cardioprotection? [J]. Basic Research in Cardiology, 2018,113(3):20.
[12] ALIMORADI H, GREISH K, GAMBLE A B, et al. Controlled delivery of nitric oxide for cancer therapy [J].Pharmaceutical Nanotechnology, 2019,7(4):279-303.
[13] KHALIGH N G. Recent advances and applications of tert-butyl nitrite (TBN) in organic synthesis [J]. Mini-Reviews in Organic Chemistry, 2020,17(1):3-25.
[14] LOPEZ M, MALACARNE P F, GAJOS-DRAUS A, et al. Vascular biotransformation of organic nitrates is independent of cytochrome P450 monooxygenases [J]. British Journal of Pharmacology, 2021,178(7):1495-1506.
[15] ZHANG Z, LUO X, YANG Y. From spontaneous to photo-triggered and photo-calibrated nitric oxide donors [J]. Israel Journal of Chemistry, 2020,61(3/4):159-168.
[16] POPTIC A L, ZHANG S. Iron(Ⅱ/Ⅲ) halide complexes promote the interconversion of nitric oxide and S-nitrosothiols through reversible Fe-S interaction [J]. Inorganic Chemistry, 2021,60(7):5190-5197.
[17] VILLARREAL E G, FLORES S, KRIZ C, et al. Sodium nitroprusside versus nicardipine for hypertension management after surgery: a systematic review and meta-analysis [J]. Journal of Cardiac Surgery,2020,35(5):1021-1028.
[18] BOTHOF G, RHEE K PVAN, KOOMEN E, et al. Change in national dosing advice of nitroprusside after potentially fatal cyanide intoxication [J]. SN Comprehensive Clinical Medicine, 2020,2(5):522-525.
[19] SILVA RODRIGUES G L, ROCHA W R. Nature of the bond, reduction potential, and solvation properties of ruthenium nitrosyl complexes of the type trans-[Ru(NH3)4(L)(NO)]2+/3+and [Ru(salen)(L)(NO)]2+/3+in different charge and spin states [J]. International Journal of Quantum Chemistry, 2020,121(4):e26476.
[20] MAGEE P N, BARNES J M. The production of malignant primary hepatic tumours in the rat by feeding dimethylnitrosamine [J]. British Journal of Cancer, 1956,10(1):114-122.
[21] HOU Y, XIE W, JANCZUK A J, et al. O-alkylation of cupferron: aiming at the design and synthesis of controlled nitric oxide releasing agents [J]. Journal of Organic Chemistry, 2000,65(14):4333-4337.
[22] BURILLO J, FERNANDEZ-RHODES M, PIQUERO M, et al. Human amylin aggregates release within exosomes as a protective mechanism in pancreatic beta cells: pancreatic beta-hippocampal cell communication [J]. Biochimica et Biophysica Acta-Molecular Cell Research, 2021,1868(5):118971.
[23] BULUT A S, ERDEN E, SAK S D, et al. Significance of inducible nitric oxide synthase expression in benign and malignant breast epithelium: an immunohistochemical study of 151 cases [J]. Virchows Archiv, 2005,447(1):24-30.
[24] ZHAI R, HE X, MEI K, et al. Ultrahigh nitric oxide capture by tetrakis(azolyl)borate ionic liquid through multiple-sites uniform interaction [J]. ACS Sustainable Chemistry and Engineering, 2021,9(8):3357-3362.
[25] DAVILA-GONZALEZ D, CHANG J C, BILLIAR T R. NO and COX2: dual targeting for aggressive cancers [J].Proceedings of the National Academy of Sciences of the United States of America, 2017,114(52):13591-13593.
[26] NATH N, CHATTOPADHYAY M, RODES D B, et al. Nitric oxide-releasing aspirin suppresses nf-kappab signaling in estrogen receptor negative breast cancer cellso ando [J]. Molecules, 2015,20(7):12481-12499.
[27] MASRI F A, COMHAIR S A, KOECK T, et al. Abnormalities in nitric oxide and its derivatives in lung cancer [J].American Journal of Respiratory and Critical Care Medicine, 2005,172(5):597-605.
[28] YONGSANGUANCHAI N, PONGRAKHANANON V, MUTIRANGURA A, et al. Nitric oxide induces cancer stem cell-like phenotypes in human lung cancer cells [J]. American Journal of Physiology-Cell Physiology, 2015,308(2):C89-C100.
[29] IIJIMA K, GRANT J, MCELROY K, et al. Novel mechanism of nitrosative stress from dietary nitrate with relevance to gastro-oesophageal junction cancers [J]. Carcinogenesis, 2003,24(12):1951-1960.
[30] BORUTAITE V, MORKUNIENE R, BROWN G C. Nitric oxide donors, nitrosothiols and mitochondrial respiration inhibitors induce caspase activation by different mechanisms [J]. FEBS Letters, 2000,467(2/3):155-159.
[31] SEABRA A B, DURAN N. Nitric oxide donors for prostate and bladder cancers: current state and challenges [J].European Journal of Pharmacology, 2018,826(7):158-168.
[32] SUNG Y C, JIN P R, CHU L A, et al. Delivery of nitric oxide with a nanocarrier promotes tumour vessel normalization and potentiates anti-cancer therapies [J]. Nature Nanotechnology, 2019,14(12):1160-1169.
[33] LI B, JI P, PENG S Y, et al. Nitric oxide release device for remote-controlled cancer therapy by wireless charging [J].Advanced Materials, 2020,32(16):e2000376.
[34] JIANG M, XUE Z, LI Y, et al. A soft X-ray activated lanthanide scintillator for controllable NO release and gas-sensitized cancer therapy [J]. Nanoscale Horizons, 2020,5(2):268-273.
[35] ZHENG Y, LIU Y, WEI F, et al. Functionalized g-C3N4nanosheets for potential use in magnetic resonance imaging-guided sonodynamic and nitric oxide combination therapy [J]. Acta Biomaterialia, 2021,121(17):592-604.
Research progress of nitric oxide in the treatment of tumor
WANGLikai, TIANYa, WUHuixia*
(College of Chemistry and Materials Science, Shanghai Normal University, Shanghai 200234, China)
Nitric oxide (NO) is a ubiquitous gas molecule with a short half-life. It is highly permeable to cell membranes and can transmit important information and regulate cellular functions in the human body. NO molecules can not only maintain the physiological function and activity of normal cells, but also selectively and rapidly deplete the energy of tumor cells and induce their apoptosis. Studies have shown that NO may achieve tumor therapy through a variety of mechanisms. Some NO donor drugs have shown good anti-tumor activity and can be used to precisely control the release of NO at tumor sites and kill tumor cells. Therefore, NO gas therapy is a promising tumor treatment strategy. This review covers the physiological characteristics of NO, several typical NO donors, and the application progress of NO releasing biomaterials in biomedical field.
nitric oxide(NO); NO donors; tumor; gas therapy; biomaterials
10.3969/J.ISSN.1000-5137.2022.04.008
2021-07-27
上海市自然科学基金(20ZR1441400)
王丽凯(1997—), 女, 硕士研究生, 主要从事纳米生物材料方面的研究. E-mail: darkerwlk@163.com
吴惠霞(1972—), 女, 教授, 主要从事纳米生物材料方面的研究. E-mail: wuhuixia@shnu.edu.cn
王丽凯, 田娅, 吴惠霞. 一氧化氮治疗肿瘤的研究进展 [J]. 上海师范大学学报(自然科学版), 2022,51(4):443‒451.
WANG L K, TIAN Y, WU H X. Research progress of nitric oxide in the treatment of tumor [J]. Journal of Shanghai Normal University(Natural Sciences), 2022,51(4):443‒451.
O 613.6
A
1000-5137(2022)04-0443-09
(责任编辑:郁慧,冯珍珍)
