成纤维细胞活化蛋白抑制剂在肿瘤诊疗中的研究进展
2022-09-15叶雨萌周学素田启威薛峰峰杨仕平
叶雨萌, 周学素, 田启威,, 薛峰峰, 杨仕平,*
成纤维细胞活化蛋白抑制剂在肿瘤诊疗中的研究进展
叶雨萌1, 周学素1, 田启威1,2, 薛峰峰2, 杨仕平1,*
(1.上海师范大学 化学与材料科学学院,上海 200234; 2.上海健康医学院 上海市分子影像学重点实验室,上海 201318)
成纤维细胞活化蛋白(FAP)在90%以上的上皮性癌间质中高表达,可以作为肿瘤成像和治疗的靶点.而一些已开发的成纤维细胞活化蛋白抑制剂(FAPI),由于对肿瘤的高亲和力和高肿瘤积聚,对肿瘤的诊断和治疗具有重大意义.文章综述了近年来FAPI在肿瘤诊疗方面的研究进展,重点阐述了新型FAPI在核医学上的诊疗应用,并且从构效关系上讨论了FAPI的靶向弹头结构,增强FAPI选择性及延长肿瘤保留时间的策略,进一步推动了FAPI向临床诊疗试剂转化.
成纤维细胞活化蛋白抑制剂(FAPI); 核医学影像; 放射性治疗; 构效关系
0 引 言
癌相关成纤维细胞(CAFs)是一种异质性的成纤维细胞样细胞群,在肿瘤生长、迁移、转移、重构细胞外基质、治疗抵抗和免疫抑制中发挥关键作用,同时也是肿瘤微环境结构中最丰富的一类细胞[1-2].与癌细胞相比,CAFs的基因更稳定,更不易发生治疗耐药性[3-4],是癌症诊断和治疗的理想靶细胞.成纤维细胞活化蛋白(FAP)是一种II型膜结合的丝氨酸蛋白酶[5],在CAFs中过表达,而在健康成人组织中很少表达[6].有数据统计,FAP在90%以上的上皮性癌的间质中过表达[4].而且,在直肠癌、胰腺癌、卵巢癌等恶性肿瘤中,FAP的高表达与肿瘤局部浸润增加、淋巴结转移风险增加和患者生存期下降有关[7].从FAP与肿瘤组织的相关性、调节肿瘤行为的有效性可见,FAP是一个肿瘤靶向诊疗的理想靶点.因此,根据FAP在CAFs中的高表达及自身的蛋白酶特性,研究者们已经开发了一系列成纤维细胞活化蛋白抑制剂(FAPI).FAPI能够选择性地富集在肿瘤组织中,是一种有效的肿瘤靶向试剂,并且结合各种放射性同位素,展现出应用于癌症诊疗的巨大潜能.
本文作者总结了近几年FAPI在肿瘤诊疗中的研究进展,重点介绍了新型FAPI在核医学领域肿瘤成像和治疗的应用,并从构效关系上讨论了增强FAPI选择性与延长保留时间的策略.
1 FAPI的类型
如图1所示,根据FAPI靶向弹头的伪肽结构,FAPI主要可分为下面几种类型:硼酸吡咯类、氯甲基酮类[8]和氰吡咯类.FAPI靶向弹头起抑制作用的机理是:FAPI中可分裂的肽键被不可分裂的亲电基团取代,引起FAP催化三联体中的丝氨酸羟基进行亲核攻击[9].硼酸吡咯类抑制剂由于对与FAP相关的多种脯氨酸肽酶有亲和力,对FAP的特异性受到了限制,并且还存在化学稳定性较低的缺点[10-11].而氰吡咯类抑制剂因为具有低纳摩尔FAP亲和性和高选择性等优异性质,已成为FAPI的主流构型.2014年,一种最有效的FAPI(简称:UAMC 1110)被开发出来,如图1(d)所示,它是一种典型的氰吡咯类抑制剂.目前,氰吡咯类抑制剂中具有代表性的是FAPI-02和FAPI-04,它们在临床实验中展现出高靶向性及高应用价值.另外,已有临床研究证明,相较于传统示踪剂氟代脱氧葡萄糖(FDG),FAPI-04在对各类肿瘤患者原发及转移灶的诊断上效果更优,尤其在肝转移瘤、腹膜癌、脑肿瘤的诊断上[12].FAPI-02和FAPI-04结构相似,两者的唯一区别在于FAPI-04的氰吡咯基团经二氟修饰,这增强了FAPI-04的疏水性,提高了抑制效力、配体效率和成纤维细胞活化蛋白与脯氨酰寡肽酶的比值(FAP/PREP)水平,提高了对FAP的选择性[13].

图1 (a),(b),(c)乙酰基-甘氨酸-脯氨酸(Ac-Gly-Pro)结构衍生的3种不同弹头FAPI[14]和(d)FAPI的先导结构UAMC 1110
2 增强FAPI选择性与延长保留时间的策略
许多已设计出来的FAPI对底物并非最佳特异性,易从体循环中被快速清除,在肿瘤中停留时间短,这限制了FAPI靶向诊断的精准性,而且不利于其在生物体内的长期跟踪.同时,较长的药物循环时间和肿瘤滞留时间是FAPI应用于放射性治疗的先决条件,所以这还阻碍了FAPI在肿瘤放疗上的应用.因此,增强FAPI对肿瘤的选择性与延长在肿瘤的保留时间就显得尤为重要.在此,总结了近年来几种常用的增强FAPI选择性与延长保留时间的策略.
2.1 构建二聚体衍生物
构建二聚体衍生物实质是在一个分子上同时连接2个相同的靶向药效基团,在相同的纳摩尔数上增加了药效团的数量,提高了FAPI的选择性,并且该策略易于在合成中实现,是一种增强FAPI肿瘤积聚和延长保留时间的有效策略.如EUY等[15]合成了2种方酰胺(SA)偶联的同型二聚体FAP抑制剂DOTA.(SA.FAPI)2和DOTAGA.(SA.FAPI)2,与传统的单体衍生物抑制剂相比,明显改善了肿瘤积聚和保留时间.
2.2 连接强效配位基团
与构建二聚体衍生物相似,在抑制剂结构上连接强配位基团也能增加药效基团的数量,从而提高FAPI的选择性.如图2所示,RUAN等[16]在抑制剂上连接强配位基团异氰酸,合成并用放射性锝标记了该含异氰化物的FAP抑制剂[99mTc][Tc-(CN-PEG4-FAPI)6]+.该络合物具有6个配位位点,在单个分子上携带了更多的药效基团,具有更高的肿瘤摄取及更好的肿瘤靶向性,是一种很有前景的肿瘤显像剂.

图2 [99mTc][Tc-(CN-PEG4-FAPI)6]+在U87MG肿瘤小鼠中的单光子发射计算机断层扫描(SPECT)成像
2.3 合理选择连接基团
设计合成一个有效的FAPI,不仅需要考虑分子靶向识别位点的数量,还需要考虑靶向位点作用的空间位阻.在螯合剂和药效基团之间选择更柔性的连接基团可以使药物更好地渗透到结合位点,增强FAPI的选择性.如SLANIA等[11]合成了2种新型FAPI:QCP01和[111In]QCP02,采用了灵活的线性酰胺烷基链替代原本支架结构上半刚性的哌嗪基团,结合时更好地渗透到结合位点,显示出肿瘤的高摄取率.
2.4 增加体内保留基团
在FAPI上增加体内保留基团,增强与生物组织的结合能力,从而获得较长的药物循环时间和延长FAPI的保留时间.如图3所示,LIN等[17]设计了以环螯合物四西坦(DOTA)为68Ga标记位点的FAP特异性体内正电子发射断层扫描(PET)示踪剂[68Ga]Ga-Alb-FAPtp-01,并在其上增加了与内源性白蛋白结合的基团4-对氯苯丁酸,以此延长药物的循环时间,增加在肿瘤病变的滞留时间,改善整体药代动力.并且这种与白蛋白的结合能力,使得PAPI能够通过内在血管或内部流体压力被稳定扩散并运输到肿瘤内.

图3 [68Ga]Ga-Alb-FAPtp-01的结构及PET成像
3 新型FAPI在肿瘤诊疗中的应用
3.1 FAPI在肿瘤诊断中的应用
在肿瘤诊断上,FAPI通过螯合不同的放射性核素,如68Ga,99mTc和18F等,进行核医学成像.目前基于FAPI的核医学成像主要包括PET影像和SPECT影像.在PET影像上,FAPI除了在诊断原发及转移灶肿瘤上有优良的效果,在癌症的分级上也具有优势,如ROHRICH等[18]用68Ga标记的FAPI-02和FAPI-04对18例胶质瘤患者进行PET成像诊断,实现了世界卫生组织(WHO)认定的分级为II级和III/IV级的异柠檬酸脱氢酶(IDH)突变星形细胞瘤的无创区分.
虽然当前68Ga标记的FAPI在成像中得到了广泛关注,但由于68Ga的半衰期较短(半衰期(1/2)为68 min),一次只能合成少量的放射性药物,并且不利于长距离的输送,这限制了68Ga-FAPI在实际医疗的应用.然而,放射性核素18F可以大量生产,并且它的发射器普遍可用,可以满足大量患者的需求.WANG等[19]开发了一种18F标记的铝与1,4,7-三氮杂环壬烷-N,N,N-三乙酸(NOTA)螯合的Al18F-NOTA-FAPI成像探针,可以在人工操作下制备,实现高放射性的批量生产.另外,如图4所示,HU等[20]通过临床研究证明一种18F标记的新型成纤维细胞活化蛋白抑制剂[18F]FAPI-42在各种癌症患者中表现出较高的病变检出率,可以成为68Ga-FAPI-04的替代品.
在SPECT影像方面,由于SPECT具有低成本和广泛使用的特点,99 mTc标记的FAPI在实际患者的影像诊断中具有较大的应用潜能.LINDNER等[21]对一系列FAPI进行了99 mTc标记和临床研究,发现FAPI-34是一个优良的SPECT显像剂,可以通过快速肿瘤摄取和身体其他部位的快速清除获得高的对比度.TRUJILLO-BENITEZ等[22]还首次用99 mTc标记了硼酸吡咯类FAPI,结果显示:该示踪剂在人血清中的放射稳定性高,对FAP具有特异性识别,实现在肿瘤的高摄取和在肾脏中的快速清除.
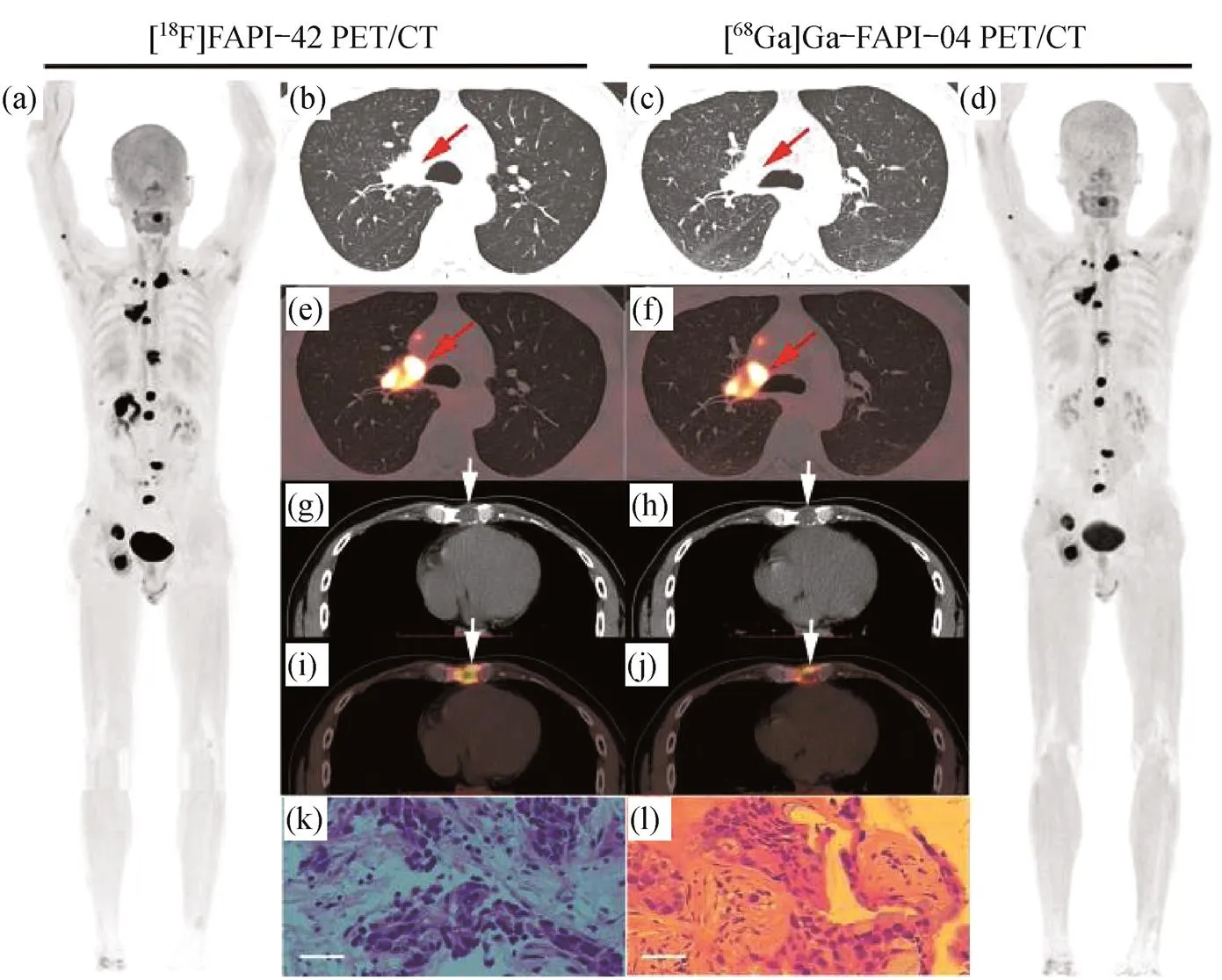
图4 [18F]FAPI-42和[68Ga]Ga-FAPI-04的正电子发射断层扫描/计算机断层扫描(PET/CT)图像.
(a),(d): 最大密度投影(MIP)图像;(b),(c),(e),(f): 肺轴向CT和融合PET/CT;(g),(h),(i),(j): 纵隔轴向CT和融合PET/CT;(k),(l): 右肺及胸骨病变病理图像(红色箭头表示原发性肺癌;白色箭头表示骨转移;标尺:200 μm)
3.2 FAPI在肿瘤治疗中的应用
目前,基于FAPI特异性靶向肿瘤的作用,许多对癌症具有靶向治疗效果的药物被开发出来.FAPI在肿瘤治疗上的应用大致可分为两类:一类是在FAPI上进行放射性核素标记用于放疗;另一类是通过化学合成在FAPI上偶联化疗药物进行化疗.
在放疗上,WATABE等[23]使用半衰期较长的64Cu(1/2为12.7 h)和225Ac(1/2为10 d)标记FAPI,研究α-疗法治疗肿瘤的效果,结果表明:放射性铜和锕标记的FAPI-04(64Cu-FAPI-04和225Ac-FAPI-04)可用于治疗高表达FAP的胰腺癌.另一方面,如图5所示,为了研究短半衰期高能量同位素,如铼(188Re)、砹(21At)和铋(213Bi)等用于肿瘤放射治疗的效果,MA等[24]用与21At 化学性质相近的131I标记了FAPI-04,为后续21At放疗试剂的开发铺平道路.治疗结果表明:该种放射药物在胶质瘤近距离放疗中具有巨大的潜力.
FAPI化疗药物偶联物在靶向化疗上有很好的疗效,如ROY等[25]将高毒性的微管抑制剂与高亲和力FAP小分子配体偶联,选择性地将药物传递给含FAP的实体肿瘤,结果显示肿瘤被完全消灭.同时也证明了靶向肿瘤间质有显著促进肿瘤组织根除的潜能.
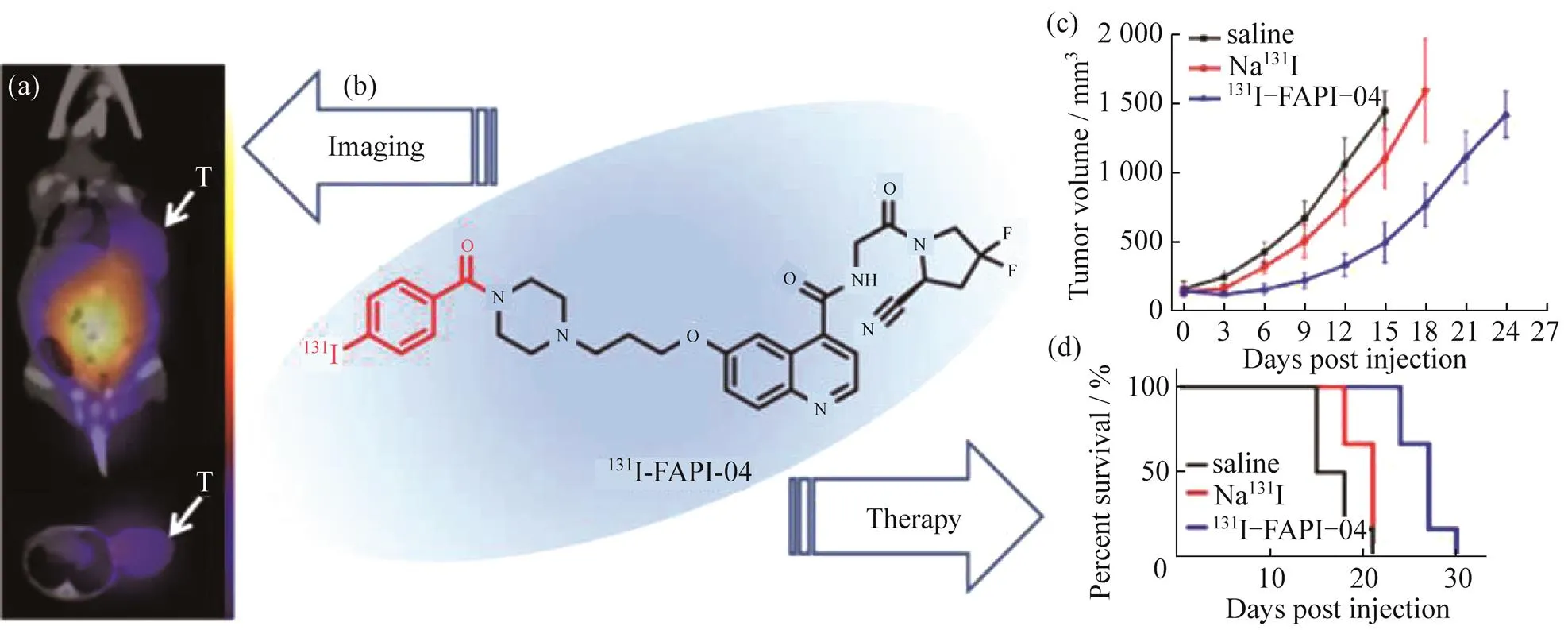
图5 131I-FAPI-04的成像和治疗效果评价.
(a)131I-FAPI-04在小鼠体内SPECT/CT成像;(b)131I-FAPI-04的结构;(c) 治疗期间小鼠肿瘤体积变化;(d) 治疗期间小鼠生存图
4 结论与展望
本文概述了FAPI的类型、增强 FAPI选择性与延长保留时间的策略,以及新型FAPI在肿瘤诊疗中的应用,突出FAPI在核医学应用上的巨大潜力.目前,在PAPI靶向诊断上,SPRECKELMEYER等[26]已首次在合成模块上实现了68Ga-FAPI-46的全自动合成,为FAPI示踪剂在临床环境的多剂量应用奠定基础.在PAPI靶向治疗方面,临床前实验证明FAP的α疗法和β疗法是潜在的治疗癌症的方法[27],但目前仍处于初步阶段,未来仍需要着重于开发与临床放疗相适应的FAPI,使抑制剂生物半衰期与核素物理半衰期相匹配,寻求最优的治疗方案.最后,新型FAPI诊疗试剂的开发与临床研究还不够丰富,还需要从FAPI的构效关系上着手,以设计更多、更精准、更有效的FAPI,促进FAPI向临床诊疗试剂的转化.
[1] LI M, YOUNIS M H, ZHANG Y, et al. Clinical summary of fibroblast activation protein inhibitor-based radiopharmaceuticals: cancer and beyond [J]. European Journal of Nuclear Medicine and Molecular Imaging, 2022,49:2844-2868.
[2] DENDL K, KOERBER S A, KRATOCHWIL C, et al. FAP and FAPI-PET/CT in malignant and non-malignant diseases:a perfect symbiosis? [J]. Cancers, 2021,13(19):4946.
[3] LOKTEV A, LINDNER T, MIER W, et al. A tumor-imaging method targeting cancer-associated fibroblasts [J]. The Journal of Nuclear Medicine, 2018,59(9):1423-1429.
[4] ALTMANN A, HABERKORN U, SIVEKE J. The latest developments in imaging of fibroblast activation protein [J]. Journal of Nuclear Medicine, 2021,62(2):160-167.
[5] ZI F, HE J, HE D, et al. Fibroblast activation protein alpha in tumor microenvironment: recent progression and implications (review) [J]. Molecular Medicine Reports, 2015,11(5):3203-3211.
[6] IMLIMTHAN S, MOON E S, RATHKE H, et al. New frontiers in cancer imaging and therapy based on radiolabeled fibroblast activation protein inhibitors: a rational review and current progress [J]. Pharmaceuticals, 2021,14(10):1023.
[7] NURMIK M, ULLMANN P, RODRIGUEZ F, et al. In search of definitions: cancer-associated fibroblasts and their markers [J]. International Journal of Cancer, 2020,146(4):895-905.
[8] EDOSADA C Y, QUAN C, TRAN T, et al. Peptide substrate profiling defines fibroblast activation protein as an endopeptidase of strict Gly2-Pro1-cleaving specificity [J]. FEBS Letters, 2006,580(6):1581-1586.
[9] SIMKOVA A, ORMSBY T, SIDEJ N, et al. Structure-activity relationship and biochemical evaluation of novel fibroblast activation protein and prolyl endopeptidase inhibitors with alpha-ketoamide warheads [J]. European Journal of Medicinal Chemistry, 2021,224:113717.
[10] MOON E S, ELVAS F, VLIEGEN G, et al. Targeting fibroblast activation protein(FAP): next generation PET radiotracers using squaramide coupled bifunctional DOTA and DATA5 mchelators [J]. EJNMMI Radiopharmacy and Chemistry, 2020,5:19.
[11] SLANIA S L, DAS D, LISOK A, et al. Imaging of fibroblast activation protein in cancer xenografts using novel (4-quinolinoyl)-glycyl-2-cyanopyrrolidine-based small molecules [J]. Journal of Medicinal Chemistry, 2021,64(7):4059-4070.
[12] CHEN H, PANG Y, WU J, et al. Comparison of [68Ga]Ga-DOTA-FAPI-04 and [18F] FDG PET/CT for the diagnosis of primary and metastatic lesions in patients with various types of cancer [J]. European Journal of Nuclear Medicine and Molecular Imaging, 2020,47(8):1820-1832.
[13] KESSEL K, SEIFERT R, WECKESSER M, et al. Prostate-specific membrane antigen and fibroblast activation protein distribution in prostate cancer: preliminary data on immunohistochemistry and PET imaging [J]. Annals of Nuclear Medicine, 2022,36:293-301.
[14] SIMKOVA A, BUSEK P, SEDO A, et al. Molecular recognition of fibroblast activation protein for diagnostic and therapeutic applications [J]. Biochimica et Biophysica Acta-Proteins and Proteomics, 2020,1868(7):140409.
[15] EUY S M, SANJANA B, MADHAV P Y, et al. Fibroblast activation protein (FAP) targeting homodimeric FAP inhibitor radiotheranostics: a step to improve tumor uptake and retention time [J]. American Journal of Nuclear Medicine and Molecular Imaging, 2021,11(6):476-491.
[16] RUAN Q, FENG J, JIANG Y, et al. Preparation and bioevaluation of99mTc-labeled FAP inhibitors as tumor radiotracers to target the fibroblast activation protein [J]. Molecular Pharmaceutics, 2022,19(1):160-171.
[17] LIN J J, CHUANG C P, LIN J Y, et al. Rational design, pharmacomodulation, and synthesis of [68Ga]Ga-Alb-FAPtp-01, a selective tumor-associated fibroblast activation protein tracer for PET imaging of glioma [J]. ACS Sensors, 2021,6(9):3424-3435.
[18] ROHRICH M, LOKTEV A, WEFERS A K, et al. IDH-wildtype glioblastomas and grade Ⅲ/Ⅳ IDH-mutant gliomas show elevated tracer uptake in fibroblast activation protein-specific PET/CT [J]. European Journal of Nuclear Medicine and Molecular Imaging, 2019,46(12):2569-2580.
[19] WANG S, ZHOU X, XU X, et al. Clinical translational evaluation of Al18F-NOTA-FAPI for fibroblast activation protein-targeted tumour imaging [J]. European Journal of Nuclear Medicine and Molecular Imaging, 2021,48(13):4259-4271.
[20] HU K, WANG L, WU H, et al. [18F]FAPI-42 PET imaging in cancer patients: optimal acquisition time, biodistribution, and comparison with [68Ga]Ga-FAPI-04 [J]. European Journal of Nuclear Medicine and Molecular Imaging, 2021,49:2833-2843.
[21] LINDNER T, ALTMANN A, KRAMER S, et al. Design and development of99mTc-labeled FAPI tracers for SPECT imaging and188Re therapy [J]. The Journal of Nuclear Medicine, 2020,61(10):1507-1513.
[22] TRUJILLO-BENITEZ D, LUNA-GUTIERREZ M, FERRO-FLORES G, et al. Design, synthesis and preclinical assessment of99mTc-iFAP for in vivo fibroblast activation protein (FAP) imaging [J]. Molecules,2022,27(264).DOI:doi.org/10.3390/molecules27010264.
[23] WATABE T, LIU Y, KANEDA-NAKASHIMA K, et al. Theranostics targeting fibroblast activation protein in the tumor stroma:64Cu-and225Ac-labeled FAPI-04 in pancreatic cancer xenograft mouse models [J]. The Journal of Nuclear Medicine, 2020,61(4):563-569.
[24] MA H, LI F, SHEN G, et al. Synthesis and preliminary evaluation of131I-labeled FAPI tracers for cancer theranostics [J]. Molecular Pharmaceutics, 2021,18(11):4179-4187.
[25] ROY J, HETTIARACHCHI S U, KAAKE M, et al. Design and validation of fibroblast activation protein alpha targeted imaging and therapeutic agents [J]. Theranostics, 2020,10(13):5778-5789.
[26] SPRECKELMEYER S, BALZER M, POETZSCH S, et al. Fully-automated production of [68Ga]Ga-FAPI-46 for clinical application [J]. EJNMMI Radiopharmacy and Chemistry, 2020,5:31.
[27] LIU Y, WATABE T, KANEDA-NAKASHIMA K, et al. Fibroblast activation protein targeted therapy using [177Lu]FAPI-46 compared with [225Ac]FAPI-46 in a pancreatic cancer model [J]. European Journal of Nuclear Medicine and Molecular Imaging, 2022,49(3):871-880.
Progress in fibroblast activation protein inhibitors for cancer diagnosis and treatment
YEYumeng1, ZHOUXuesu1, TIANQiwei1,2, XUEFengfeng2, YANGShiping1*
(1. College of Chemistry and Materials Science, Shanghai Normal University, Shanghai 200234, China; 2. Shanghai Key Laboratory of Molecular Imaging, Shanghai University of Medicine and Health Sciences, Shanghai 201318, China)
Fibroblast activation protein(FAP) is highly expressed in more than 90% of epithelial carcinoma stroma and can be used as a target for tumor imaging and therapy. Some developed FAP inhibitors(FAPI) are of great significance in the diagnosis and treatment of tumors due to their high affinity for tumors and high tumor accumulation. Herein,the research progress of FAPI in tumor diagnosis and treatment in recent years was reviewed,with an emphasis on the clinical application of novel FAPI in nuclear medicine. In addition,FAPI targeting warhead structure and the strategies of enhancing FAPI selectivity and prolonging tumor retention time were discussed from the perspective of structure-activity relationship,which further promoted the transformation of FAPI into clinical diagnosis and treatment reagents.
fibroblast activating protein inhibitors(FAPI); nuclear medical imaging; radiation therapy; structure-activity relationship
10.3969/J.ISSN.1000-5137.2022.04.007
2022-03-21
国家自然科学基金重大研究计划培育项目(91959105)
叶雨萌(1996—), 女, 硕士研究生, 主要从事有机材料用于癌症诊疗方面的研究. E-mail: 983341447@qq.com
杨仕平(1969—), 男, 教授, 主要从事磁共振成像造影剂及其应用方面的研究. E-mail: shipingy@shnu. edu.cn
叶雨萌, 周学素, 田启威, 等. 成纤维细胞活化蛋白抑制剂在肿瘤诊疗中的研究进展 [J]. 上海师范大学学报(自然科学版), 2022,51(4):436‒442.
YE Y M, ZHOU X S, TIAN Q W, et al. Progress in fibroblast activation protein inhibitors for cancer diagnosis and treatment [J]. Journal of Shanghai Normal University(Natural Sciences), 2022,51(4):436‒442.
R 817.9
A
1000-5137(2022)04-0436-07
(责任编辑:郁慧)
