超声内镜联合风险评估系统评分对肝硬化患者合并食管胃底静脉曲张破裂出血的诊断价值*
2022-09-15李红胡林莉黄树丽
李红, 胡林莉, 黄树丽
信阳市中心医院 1消化内科, 2内镜室(河南信阳 464000)
由门静脉高压导致的食管静脉曲张破裂出血是肝硬化患者最常见的并发症之一,患者常出血量大、病情危急,在短时间内即可出现失血性休克,具有高患病率和死亡率的特点。有研究表明,约有80%~90%的肝硬化患者伴有食管胃底静脉曲张,而曲张静脉破裂出血的发生率可高达33.3%,其中有超过一半患者可死亡于第一次出血,是肝硬化患者死亡的最常见病因之一[1]。因此,早期对肝硬化伴食管胃底静脉曲张患者出血风险进行评估,采取有效的干预措施,对于有效改善肝硬化患者预后,降低死亡率具有重要的临床意义。多数指南均推荐,在肝硬化伴食管胃底静脉曲张患者入院时,应早期对其出血风险进行评估[2]。目前有效的评分系统非常有限,既往有学者采用Glasgow Blatchford和Child- Turcotte- Pugh评分系统预测上消化出血风险的有效性进行了研究[3-4],然而以上评分系统均不包含曲张静脉病变程度的超声内镜检查资料,对于肝硬化食管胃底静脉曲张患者出血的风险的诊断价值可能有限,而单纯依靠超声内镜检查又忽视了患者整体生理病理状态对出血的影响。本研究拟通过联合超声内镜检查和Glasgow Blatchford及Child- Turcotte- Pugh评分系统,采用logistic回归分析和ROC曲线评估上述指标对肝硬化合并食管静脉曲张破裂出血诊断价值,现报告如下。
1 资料与方法
1.1 一般资料 选取我院于2014年1月至2018年12月收治的168例肝硬化合并食管胃底静脉曲张患者作为研究对象,定期对患者进行随访,所有病例随访12个月,根据随访期间内是否发生食管胃底静脉曲张破裂出血分为出血组和未出血组。
纳入标准:(1)患者肝硬化及食管胃底静脉曲张临床诊断符合由中华医学会制定的《肝硬化门静脉高压食管胃静脉曲张出血的防治指南》[5]中的相关标准;(2)所有患者均经超声内镜检查,并有Glasgow Blatchford及Child- Turcotte- Pugh评分资料。
排除标准:(1)患者伴有原发性肝癌或其他部位的恶性肿瘤;(2)患者不能耐受超声内镜检查,或拒绝接受声内镜检查;(3)由其他原因导致的胃食管静脉破裂出血患者;(4)患者入院时已经存在活动性出血。
本研究经我院医学伦理委员会批准同意(2018伦审第02号)。所有患者签订知情同意书。
1.2 观察指标 患者入院后详细记录以下信息:(1)患者一般临床资料,包括性别、年龄、体质指数、肝硬化致病原因及肝功能分级等;(2)通过超声内镜观察胃食管静脉曲张情况,包括食管曲张静脉总横断面表面积、肠系膜上静脉直径及门静脉直径等;(3)胃食管静脉曲张破裂出血风险评估系统,包括Glasgow Blatchford和Child- Turcotte- Pugh评分。
1.3 超声内镜检查方法 采用由日本富士株式会社生产的SP-702型超声内镜诊断系统对所有患者行超声内镜检查,超声探头型号为P2625(25 Mhz)和奥林巴斯扇形超声,探头CS-7131602。患者检查前常规检测生命体征情况,在无明显禁忌下,嘱患者左侧卧位,予以异丙酚静脉麻醉,待麻醉满意后开始进镜检查。将探头经口腔送入食管和胃底部,观察胃底和食管静脉曲张情况,测量曲张静脉血管的最大处半径并计算曲张面积,计算面积总和得出食管胃底曲张静脉总横断面表面积,同时更换奥林巴斯扇超CS-7131602型号超声内镜测量肠系膜上静脉和门静脉血管最大处直径,并用超声内镜键盘上的操作系统测量仪器测量直径。检查过程密切监护患者生命体征,根据实际情况决定术中是否追加麻醉药物,若发生出血则按照急诊出血处理。患者检查结束并观察30 min无明显不适合后离开。
1.4 Glasgow Blatchford和Child- Turcotte- Pugh评分方法 所有患者入院时行 Glasgow Blatchford和Child- Turcotte- Pugh评分。其中,Glasgow Blatchford评分系统包含收缩压、血尿素氮、血红蛋白、脉搏、黑便、晕厥、肝脏疾病及心力衰竭等8项指标;Child- Turcotte- Pugh评分系统包含肝性脑病、腹腔积液、总胆红素、白蛋白及凝血酶原时间延长等5项指标。根据不同严重程度,对上述评分系统的各项指标分数相加,即得出两项评分系统总分,具体评分方法详见表1。

表1 Glasgow Blatchford和Child- Turcotte- Pugh评分方法[6-7]

2 结果
2.1 两组患者一般临床资料比较 168例患者中,男99例,女69例,平均年龄(55.52±9.86)岁,其中病毒性肝炎肝硬化患者152例,酒精性肝硬化患者16例。根据Child-pugh分级,Child A级患者33例,Child B级患者98例,Child C级患者37例。经随访发现,168例患者中出现食管静脉曲张破裂出血者(出血组)92例,未出血者(未出血组)76例。两组患者一般临床资料比较差异无统计学意义(P>0.05)。见表2。

表2 两组患者一般临床资料比较 例(%)
2.2 两组患者超声内镜静脉测量情况比较 出血组患者食管胃底曲张静脉总横断面表面积、肠系膜上静脉直径及门静脉直径均明显高于未出血组患者,差异有统计学意义(P<0.05)。见表3、图1~3。
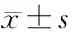
表3 两组患者静脉测量情况比较

注:箭头所指胃底黏膜下、胃底周围轻度静脉曲张(左)和食管黏膜下轻度静脉曲张(右)

注:箭头所指胃底黏膜下、胃底周围中度静脉曲张 (左)和食管周围、食管旁中度静脉曲张(右)

注:箭头所指胃底黏膜下、胃底周围、胃底旁重度静脉曲张 (左)和食管黏膜下、食管周围、食管旁重度静脉曲张(右)
2.3 两组患者Glasgow Blatchford及Child- Turcotte- Pugh评分比较 出血组患者Glasgow Blatchford和Child- Turcotte- Pugh评分均明显高于未出血组患者,差异有统计学意义(P<0.05)。见表4。

表4 两组患者Glasgow Blatchford及Child- Turcotte- Pugh评分比较 分
2.4 超声内镜静脉测量联合Glasgow Blatchford及Child- Turcotte- Pugh评分的logistic回归分析 对两组患者超声内镜静脉测量情况和两种评分进一步行二元logistic回归分析,结果发现,食管曲张静脉总横断面表面积、肠系膜上静脉直径、门静脉直径及Glasgow Glasgow Blatchford和Child- Turcotte- Pugh评分增加是肝硬化合并食管静脉曲张破裂出血的独立危险因素,有统计学意义(P<0.05)。见表5。

表5 Logistic回归分析结果
2.5 超声内镜静脉测量联合Glasgow Blatchford及Child- Turcotte- Pugh评分对出血的诊断价值分析 以食管胃底曲张静脉总横断面表面积、肠系膜上静脉直径、门静脉直径及Glasgow Blatchford和Child- Turcotte- Pugh评分作为检验变量,将出血组和未出血组作为参考标准,作ROC曲线分析。结果发现,上述指标的AUC分别为0.804、0.756、0.726、0.638和0.816,而联合预测概率AUC为0.947,相较于单个指标显著提升,结果具有统计学意义(P<0.01)。见表6和图4。

表6 血管内皮细胞指标的AUC

图4 食管曲张静脉总横断面表面积、肠系膜上静脉直径、门静脉直径、Glasgow Blatchford及Child- Turcotte- Pugh评分预测肝硬化伴食管胃底静脉曲张破裂出血的曲线下面积
3 讨论
食管胃底静脉曲张破裂出血是肝硬化患者肝功能终末期最常见的并发症之一,具有出血量大、病情急、高发病率和死亡率的特点[8]。研究证实[9-11],肝硬化患者食管胃底静脉曲张的主要病理机制为终末期肝病患者在长期炎症因子刺激下,肝细胞发生变性和坏死,继而出现纤维组织增生及肝纤维化,导致肝小叶内血液流通的主要通道肝窦闭塞及其周边纤维结缔组织增生,使其血液流出受阻,门静脉血液回流障碍,门静脉压力升高,从而引起食管胃底静脉丛曲张。近几年,随着医学影像学的不断发展,超声内镜作为一项新型技术不仅可以对食管内的静脉进行观察,还可以对食管壁外的静脉曲张情况进行评估,这对于判断该类患者出血的风险具有较高的价值,逐渐在临床中得到广泛应用。然而,导致曲张静脉破裂出血的因素除与患者门静脉压力升高外,还与机体多种病理生理因素如血压、凝血功能及合并基础疾病等密切相关[12-13]。张小军等[14]对肝硬化患者食管胃底静脉曲张破裂出血的危险因素进行分析发现,除静脉曲张外,患者电解质紊乱、腹腔积液、肝功能及白蛋白水平等亦是出血的独立危险因素,在肝硬化患者食管胃底静脉出血的病理过程中发挥重要作用。本研究采用超声内镜检查,通过测量肠系膜上静脉直径、门静脉直径及食管胃底曲张静脉总横断面表面积并联合Glasgow Blatchford和Child- Turcotte- Pugh评分系统对患者的整体生理病理状态进行评估,分析了导致肝硬化患者食管胃底静脉破裂出血的风险因素,并对其的诊断价值进行分析。结果发现,食管胃底曲张静脉总横断面表面积、肠系膜上静脉直径、门静脉直径增加及Glasgow Glasgow Blatchford和Child- Turcotte- Pugh评分增高是肝硬化患者食管胃底静脉曲张破裂出血的独立危险因素,但上述单个指标对出血风险的预测能力有限,而联合预测能力明显提升。
常规胃镜检查可对食管胃底直径较大的曲张静脉进行直接观察,然而对于比较细小的静脉常常容易遗漏,且极易与胃黏膜的正常隆起相混淆,造成误诊或漏诊[15]。本研究中我们采用高频率小探头高分辨超声内镜,不仅可以对食管壁内的静脉曲张进行观察测量,而且可以观察黏膜下和食管壁外的静脉,且与其他病变区域具有较高的分辨能力。肠系膜上静脉和门静脉直径是反映门静脉压力的重要指标,当门静脉系统压力过高时可导致食管和胃底血流回流至门脉主干,随着门静脉直径不断增大极易导致食管下段和胃底静脉曲张破裂出血[16]。本研究发现,相对于未出血患者,出血患者肠系膜上静脉和门静脉直径明显增加。我们进一步采用超声内镜对食管曲张静脉数量及其总横断面积进行了测量,结果发现出血患者曲张静脉总横断面积明显高于未出血患者,以上差异均有统计学意义(P<0.05)。这与国内外学者的研究结论较为类似, Miller等[17]采用微小探头对肝硬化患者食管胃底曲张静脉的总横断面积与出血风险相关性的分析发现,当总横断面积增加1 cm2时,出血风险将增加76倍。
近年来,由于Glasgow Blatchford和Child- Turcotte- Pugh评分较容易获取,一直是受到临床医生关注的用于评估上消化道出血风险的评估系统。Iino等[18]分别采用Glasgow Blatchford、Child- Turcotte- Pugh及MELD评分系统考察其上消化道出血判断的优势,结果发现Glasgow Blatchford评分明显由于其他两者。这与本研究结果有所差异,在本研究中我们发现Glasgow Blatchford评分对于预测肝硬化患者食管胃底静脉曲张破裂出血患者的AUC低于Child- Turcotte- Pugh评分系统,这可能主要与研究间样本量和研究对象差异所引起。
Glasgow Blatchford主要根据血压、脉搏、血尿素氮、血红蛋白、黑便、晕厥及合并疾病如心力衰竭和肝脏疾病等方面评估患者出血的危险程度。而Child- Turcotte- Pugh则主要根据肝性脑病分级、腹腔积液、总胆红素、血白蛋白及凝血功能等方面进行判断。两种评分系统的侧重点有所不同。因此,单独使用某一种评分系统的可能存在一定局限性。既往研究发现[19-20],单独采用Glasgow Blatchford和Child- Turcotte- Pugh评分对肝硬化患者食管胃底静脉出血预测的AUC仅为0.56和0.736,这与本研究的0.638和0.816较为一致。
综上所述,食管胃底曲张静脉总横断面表面积、肠系膜上静脉直径、门静脉直径增加及Glasgow Glasgow Blatchford和Child- Turcotte- Pugh评分与肝硬化食管胃底静脉曲张破裂出血具有密切的关系,可以作为评估该类患者上消化道出血的重要风险因素,联合上述五项指标可明显提示对肝硬化患者食管胃底静脉曲张破裂出血的预测效能,对于改善患者预后具有重要的临床意义。
利益相关声明:所有作者均声明不存在利益冲突。
作者贡献说明:李红酝酿和设计实验,实施研究,采集数据,分析数据,起草文章,统计分析;胡林莉采集数据,行政、技术或材料支持;黄树丽采集数据,支持性贡献。
