水稻叶和籽粒镉积累机制及QTL定位研究
2022-09-14黄婧朱亮薛蓬勃付强
黄婧 朱亮,2 薛蓬勃,2 付强
(1. 广西大学亚热带农业生物资源保护与利用国家重点实验室,南宁 530004;2. 广西大学生命科学与技术学院,南宁 530004)
镉(cadmium,Cd)是生物毒性最强的重金属之一,低剂量(0.1-1 mg/kg)即抑制动植物的生长繁殖[1]。随着工业化的发展,我国受镉、砷、铅等重金属污染的耕地面积近2 000万hm2,约占耕地总面积的20%,每年生产镉含量超标的农产品达14.6亿kg,且有逐渐加重的趋势[2]。水稻(Oryza sativaL.)是世界上约一半人口的主食,稻米是很多国家饮食中摄取镉的最主要来源[3]。镉在人体内积累不易排出,且半衰期长,对肾脏、肝脏和骨骼等造成危害,甚至引起癌症[4]。因此,选育籽粒低镉积累的水稻品种,最大限度减少镉摄入量,对于保障粮食安全和人类健康具有重要意义[5]。
镉在植物体内的分布是一个由根质膜转运蛋白介导的根吸收、木质部装载和卸载,以及韧皮部装载和卸载所共同控制的连续的动力学过程[6]。水稻Cd积累相关性状属数量性状,遗传机制复杂,同时受环境因素影响。不同基因型的水稻地上部分和籽粒中Cd的含量存在很大的差异,这为研究水稻低Cd积累的生理和遗传机制提供了非常有用的种质资源[7]。近年来,已有研究利用不同的低Cd/高Cd水稻品种组合构建的F2、RIL、CSSLs等群体鉴定出不少控制Cd积累的QTL,在水稻12条染色体上均有分布[8-19]。除了OsHMA3[12]、OsCAL1[15]等基因外,上述研究中鉴定的QTL均未克隆到主效基因,关于控制Cd从根到茎转运继而进入籽粒的遗传机制仍不明确,亟待研究。
本研究通过离子组学技术,系统分析中国栽培稻核心种质资源209个品种籽粒的离子谱,鉴定了一批Fe、Zn等籽粒部位高富集以及Cd低积累的水稻品种,为优良品种的筛选和杂交育种提供了种质资源。另一方面,开展水稻Cd积累生理试验和QTL定位分析,为阐明水稻Cd积累遗传机制、运用分子标记辅助选育籽粒Cd含量低而Fe、Zn等营养元素均衡富集的水稻品种奠定基础。
1 材料与方法
1.1 材料
中国栽培稻(Oryza sativaL.)核心种质资源209份,由上海市农业生物基因中心提供。籼稻花楸03和粳稻SKC为亲本构建DH群体,包含137个株系。
1.2 方法
1.2.1 水稻种质资源籽粒的离子谱测定 中国栽培稻核心种质资源的209份,每份随机挑选5粒籽粒至50 mL FalconTM管中,80℃烘箱中,24-48 h。加入5 mL硝酸(MOS级),在 SPB 50-48型石墨消解仪(Perkin Elmer)上进行消解(120℃,30 min)。冷却至室温后,用Milli-Q水定容至50 mL,选取上清10 mL,并用电感耦合等离子质谱仪ICP-MS(ELAN DRC-e,Perkin-Elmer)测量其中14种必需元素和Cd、Pb等有毒重金属元素的含量,计算测量群体的平均值和标准差,最后计算出Z值[Z值=(样本元素浓度-平均值)/标准差],用以表示样品中某元素含量偏离群体平均值的程度。
1.2.2 水稻的培养条件 生理学试验中,SKC和花楸03的种子浸泡于Milli-Q水中,28℃,避光48 h。去除液体,用湿的布巾包裹种子,密封,28℃避光24 h,萌发的种子转入水稻培养液。人工气候箱设置为相对湿度70%,光照周期为13 h光照(温度为28℃)/11 h黑暗(温度为25℃),光照强度80-200 mol/(m2·s)。大田及水槽种植试验区位于广西省南宁市郊的镉污染农田,于当年4月在秧田播种,5月移栽,各株系分别挑选20株长势一致的秧苗移栽,每株系插4行,每行5株。在秧苗生长期间进行常规田间管理,及时除草除虫,注意避免雨天水位上涨淹没秧苗。
1.2.3 生理学试验
1.2.3.1 Cd的耐受性分析 对照组和试验组水稻种子萌发后,分别种植于添加了0、0.2、1和5 μmol/L CdCl2的水稻培养液中,并置于人工气候箱培养12 d后,分别选取地上和地下部分材料测量鲜重并进行统计分析。
1.2.3.2 不同试验中的Cd处理条件 水稻种子萌发后直接在添加0、0.2、1或5 μmol/L CdCl2的培养液中培养2周,然后取地上部材料,测量水稻叶中Cd的积累。分别以0、0.2、1、5、10或25 μmol/L CdCl2处理两叶一心期苗7 d后,分别对地上部和地下部取材,进行Cd浓度梯度试验。两叶一心期苗经10 μmol/L CdCl2分别处理0、1、2、3、4或5 d后,分别对地上部和地下部取材,进行Cd时间梯度处理试验。两叶一心期苗在正常培养条件(28℃,A)和低温条件(4℃,B)下分别用0、0.2、1、2和5 μmol/L CdCl2处理20 min后,选取根进行根吸收动力学试验。
1.2.3.3 水稻组织中Cd含量的测定 按照1.2.3.1和1.2.3.2处理后取材,将水稻地上部和根材料分别用Milli-Q水、CaCl2及Milli-Q水清洗,置于80℃烘箱中,24-48 h。烘干的植物材料,称取10-20 mg至50 mL FalconTM管中。加入5 mL硝酸(MOS级),在石墨消解仪上进行消解(120℃,30 min)。冷却至室温后,用Milli-Q水定容至50 mL,选取上清10 mL,并用ICP-MS测定各组织材料中的Cd含量。
1.2.4 土壤中元素含量的测定 在大田及污染、对照水槽土壤中元素含量的测定试验中,采用等间距采样法,共设10个采样点,采集深度为5 cm左右的耕层土壤,自然风干并将土块碾碎后封存。将各点采集的试样混合后,反复按四分法弃取,每个样品设3个重复。每份准确称取0.1 g土壤,采用王水回流法酸解样品,用Milli-Q水定容至50 mL后,选取上清10 mL,并用ICP-MS进行测定。
1.2.5 水稻Cd积累的QTL定位 以籼稻花楸03和粳稻SKC为亲本构建包含137个单株的DH群体。对叶中Cd积累进行QTL定位时,将DH群体植株种植于水稻营养液中,并置于人工气候箱培养。两叶一心期苗以10 μmol/L CdCl2处理7 d后取样。每个株系取5个单株的地上部分混收为一份材料,设置4个重复,并用ICP-MS测定Cd含量。对籽粒中Cd积累进行QTL定位时,将DH群体植株种植于Cd污染的水槽土壤中,每个株系种植20个单株。收种后脱粒取谷粒测量Cd含量,每个株系取5个单株,每个单株随机选取10粒谷粒混收为一份材料,设置4个重复,并用ICP-MS测定Cd含量。
利用MAPMARKER/EXP3.0程序[20]进行连锁分析,构建高密度SRR(simple sequence repeat)分子标记连锁图谱,SSR分子标记引物序列信息来源于Gramene网站(www.gramene.org)。结合分子标记连锁图和Cd含量测定结果,利用MAPMAKER/QTL程序[21]进行QTL分析。
2 结果
2.1 水稻核心种质资源籽粒的离子谱
系统分析中国栽培稻核心种质资源209个品种籽粒(见附表)的金属离子谱,鉴定出20余个Cd、Fe、Zn、Mn等含量差异显著的水稻品种(图1)。从中挑选出Cd含量差异显著而Fe、Zn、Mn等含量差异不显著的籼稻品种花楸03(HQ03)和粳稻品种SKC进行后续研究。另一方面,如图2所示,DPS软件统计学分析表明,水稻籽粒中Cd2+与Fe2+、Zn2+、Mn2+无拮抗关系(P>0.05),而Fe2+、Zn2+和Mn2+之间存在极显著的协同关系(P<0.01)。
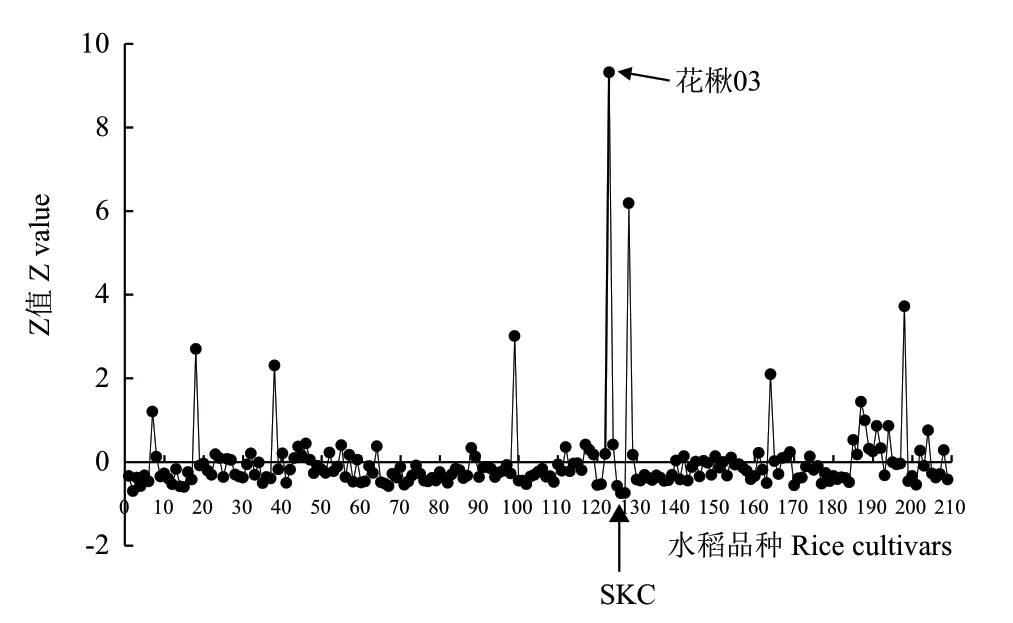
图1 核心种质资源水稻籽粒中Cd的积累Fig. 1 Profiling of Cd accumulation in grains of rice core germplasm
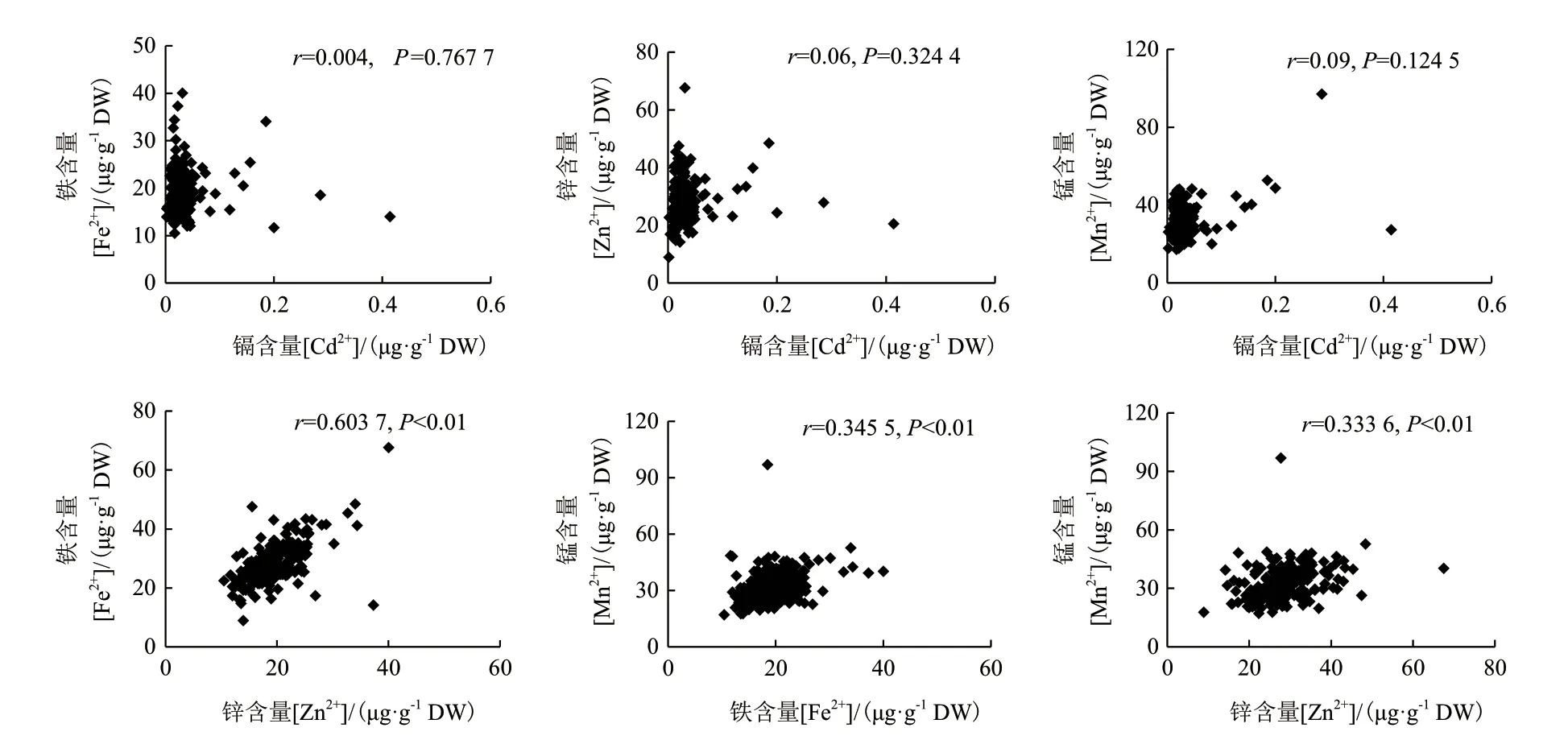
图2 水稻籽粒中Cd2+、Fe2+、Zn2+和Mn2+元素的相关关系Fig. 2 Correlation among Cd2+, Fe2+, Zn2+ and Mn2+ elements in rice grains
2.2 花楸03与SKC籽粒中的Cd含量的测定
为在同样生境下比较花楸03与SKC籽粒中的Cd含量,将这两个品种分别在受污染大田、Cd污染水槽和对照水槽土壤中种植。如表1所示,土壤中Cd含量高低依次为:污染水槽>大田土壤>对照水槽,Fe、Zn、Cu和As等元素含量在污染水槽和大田中差异不显著。

表1 大田、镉污染水槽和对照水槽土壤中Cd等元素的含量Table 1 Contents of Cd and other metals in the soil of contaminated paddy field,contaminated sink and control sink(μg·g-1 DW)
籽粒中Cd含量高低依次为:污染水槽>大田土壤>对照水槽,与土壤中Cd含量高低的趋势一致(图3-A)。除了对照水槽中两品种的Cd含量均在检测限附近外,其余情况下花楸03籽粒中的Cd含量均显著高于SKC,与图1结果一致(图3-A,P<0.01)。而污染水槽中的花楸03与SKC精米中的Cd含量较低且差异不显著(图3-B,P>0.05)。
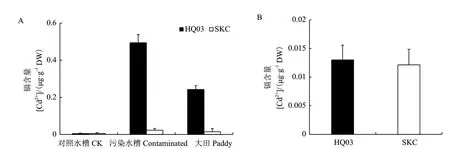
图3 花楸03与SKC的籽粒和精米中的Cd含量Fig.3 Cd accumulation in the grains and milled rice of HQ03 and SKC
2.3 花楸03与SKC叶中Cd积累差异显著,而对Cd的耐性和吸收无显著差别
鉴于花楸03与SKC籽粒中Cd积累差异显著,首先检测这两个品种地上部和地下部Cd积累是否也存在差异。种子萌发后直接在添加CdCl2的培养液中生长,叶片中的Cd含量随着CdCl2处理浓度的升高而升高,且花楸03叶中的Cd含量始终显著高于SKC(图4-A,P<0.01)。两者叶中Fe、Zn、Mn等金属元素和K、Mg、Ca等大量元素的含量无显著差异(图4-B、C)。
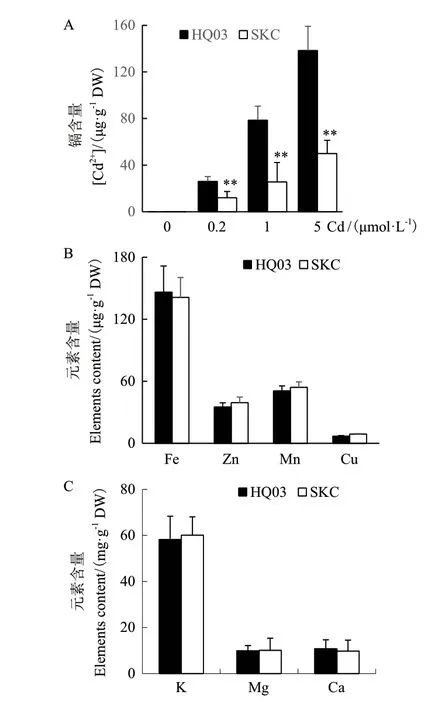
图4 花楸03与SKC叶片中的元素积累Fig.4 Elements accumulation in the leaves of HQ03 and SKC
对两叶一心期苗分别进行CdCl2浓度梯度和时间梯度的处理,发现叶片中的Cd含量具有浓度梯度和时间梯度的依赖性(图5)。除Cd含量均较低情况外,花楸03叶中的Cd含量始终显著高于SKC(图5-A、B),而根中Cd含量则无显著差异(图5-C、D)。
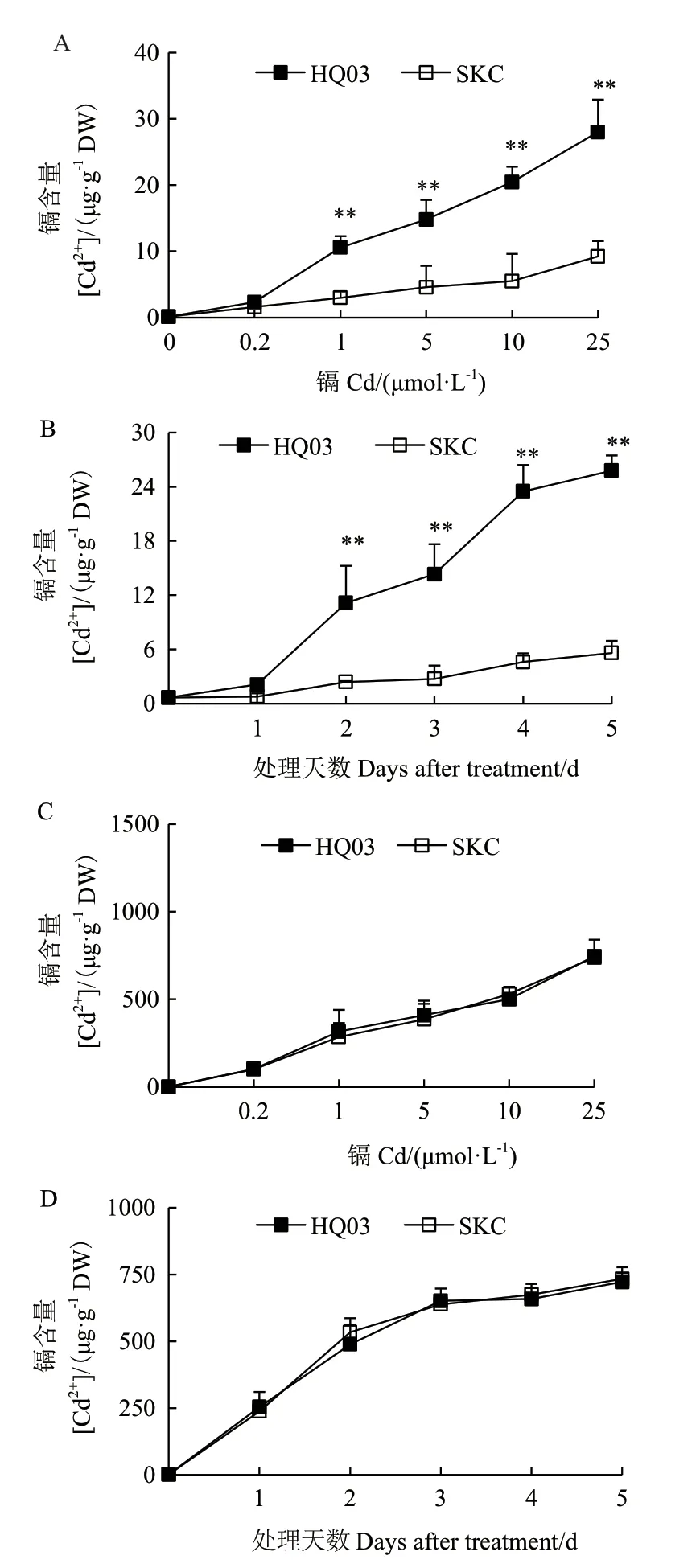
图5 不同浓度和不同时间CdCl2处理后花楸03和SKC幼苗叶片与根中Cd的积累Fig.5 Cd accumulation in the leaves and roots of HQ03 and SKC from rice seedlings exposed to CdCl2 for indicated concentrations and days
由于两品种叶中Cd积累差异显著,接下来检测它们对Cd的耐受性。种子萌发后直接在添加CdCl2的培养液中生长,对照及不同浓度Cd处理下,花楸03和SKC地上部(图6-A)和地下部(图6-B)的鲜重均无显著差异,说明这两个品种对Cd的耐受性无显著差别。
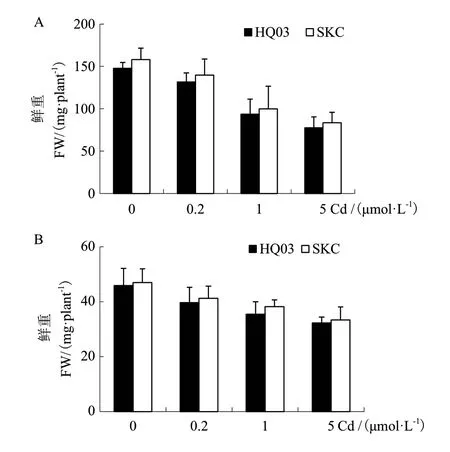
图6 花楸03与SKC对Cd的耐受性分析Fig. 6 Tolerance assay of HQ03 and SKC to Cd
为明确花楸03与SKC叶中Cd积累差异是由根吸收还是从根向茎的转运差异所导致,对两品种进行了根吸收的动力学研究。如图7所示,无论是在正常培养条件(图7-A)还是低温条件下(图7-B),两品种根吸收Cd的动力学曲线均基本重合,说明花楸03和SKC对Cd的吸收能力无显著差异。

图7 花楸03和SKC的根吸收试验Fig.7 Root uptake assay of HQ03 and SKC
2.4 DH群体的QTL定位
以籼稻花楸03和粳稻SKC为亲本构建了包含137个单株的DH群体,各株系叶和籽粒中的Cd积累量数据呈连续正态分布,表现出数量性状的遗传特点,符合QTL区间的作图要求。共检测到8个控制Cd在水稻叶和籽粒中积累的QTL,分别位于第2、3、4、7、8、10和11染色体上(表2、表3和图8)。
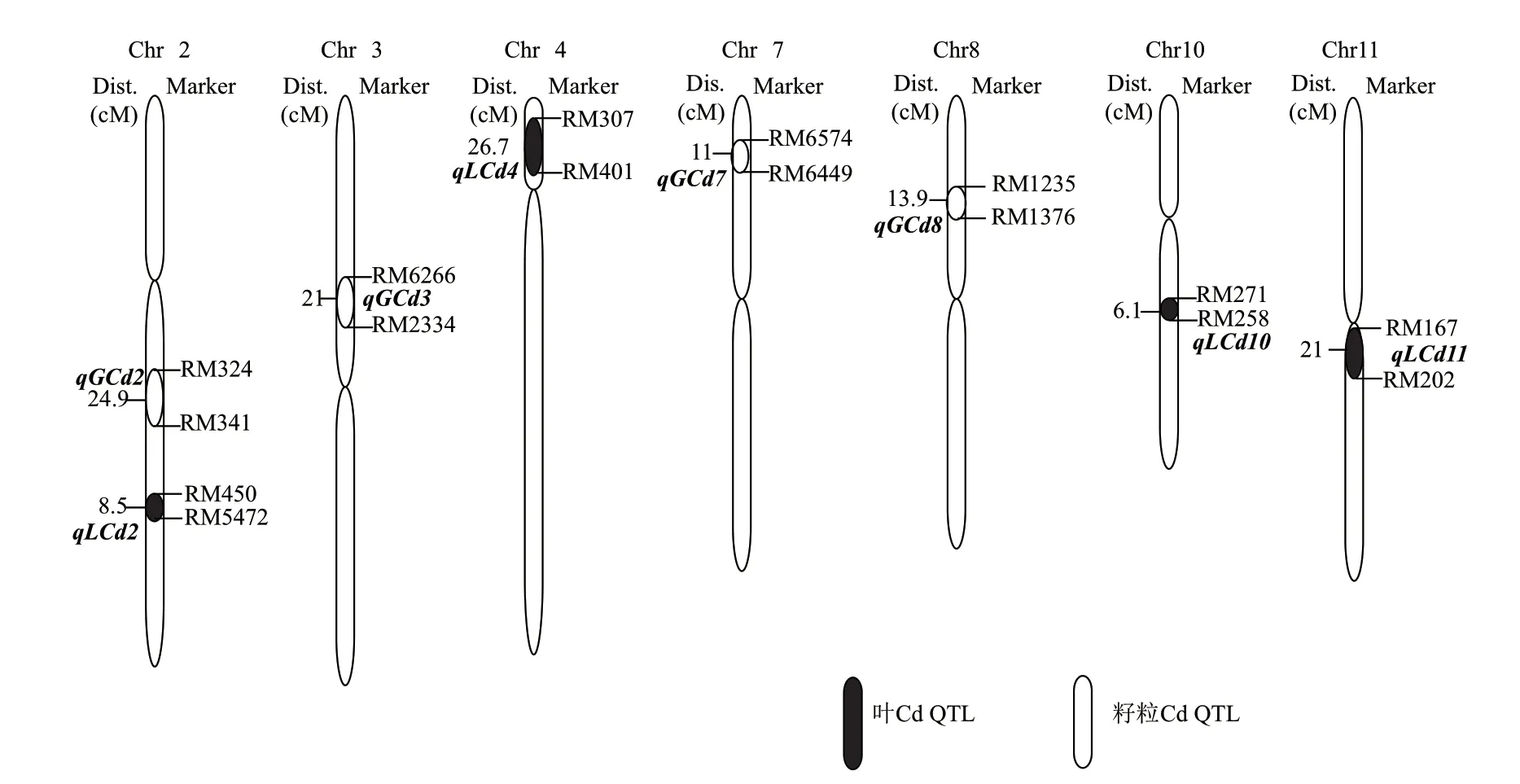
图8 水稻叶和籽粒Cd积累的QTL定位示意图Fig.8 QTLs mapping of Cd accumulation in the rice leaves and grains

表2 水稻叶Cd积累的QTL定位Table 2 Quantitative trait loci(QTLs)mapping for Cd accumulation in rice leaves
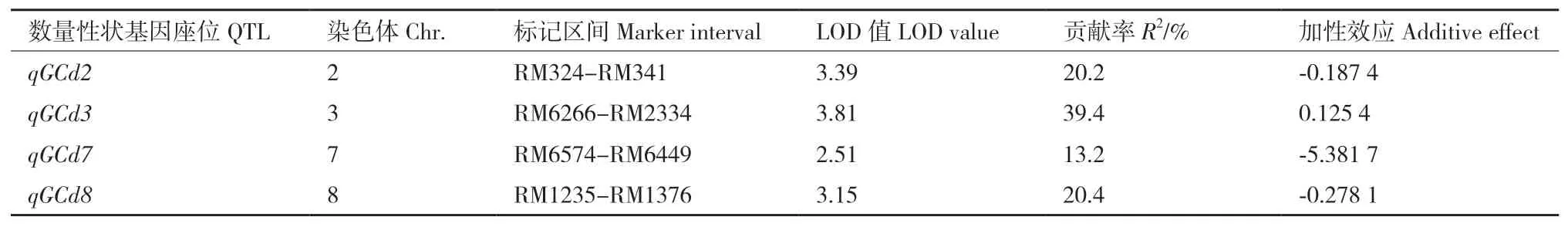
表3 水稻籽粒Cd积累的QTL定位Table 3 Quantitative trait loci(QTLs)mapping for Cd accumulation in rice grains
3 讨论
水稻是我国最重要的粮食作物,土壤重金属镉的污染不仅导致水稻生长发育受阻,产量下降,还会在水稻体内大量累积并通过食物链传递,危害国民健康[1,3-5]。因此,研究水稻镉耐受和积累的机制,降低水稻籽粒中Cd含量从而最大限度的减小Cd的摄入量,对于保障粮食安全和人类健康具有重要意义。
不同基因型水稻地上部分和籽粒中Cd的积累存在很大的差异,为研究水稻低Cd积累的生理和遗传机制提供了非常有用的种质资源[9]。利用不同低Cd/高Cd积累水稻组合构建的群体鉴定出不少控制Cd积累的QTL。如Xue等[8]报道了水稻中6个与Cd耐性相关和3个与Cd浓度相关的QTL。Ueno等[9]在第11染色体上鉴定到控制水稻地上部分Cd含量的主效QTL。Ishikawa等[10]将控制水稻籽粒Cd积累的QTL定位到第2和7染色体上,并将其中主效QTLqGCd7定位到第7染色体的短臂上。Hu等[16]利用DH群体定位到18个糙米和14个精米QTL,分别定位于2、3、4、5、7、9和11染色体上。Liu等[17]在第2、3、6、7、8和10染色体上鉴定到7个控制籽粒Cd浓度的QTL。Ueno等[11]利用Nipponbare/Anjana Dhan构建的群体,Miyadate等[12]利用Cho-Ko-Koku/Akita 63构建的群体,先后克隆出根液泡膜上Cd的转运蛋白基因OsHMA3;Luo等[15]利用CJ06/TN1构建的群体,鉴定出控制Cd在叶中积累的防御素类似蛋白CAL1。除此之外,其他研究中鉴定出的QTL均未克隆到主效基因,关于控制Cd从根到茎继而向籽粒中转运的遗传机制仍不明确。
本研究首先利用ICP-MS离子组学高通量分析手段测定了中国栽培稻核心种质资源209个品种籽粒的离子谱,从中鉴定出Fe、Zn等高积累以及Cd低积累的品种20余个,为优良品种的筛选和杂交育种提供了较为详实的参考资料。统计学分析籽粒中各元素的相关关系,发现Fe2+、Zn2+和Mn2+之间存在协同关系,这些元素同属二价重金属,在化学结构上具有很大的相似性,很可能在一定程度上共享植物体内的吸收转运机制。本研究中未观察到Fe2+、Zn2+、Mn2+与Cd2+等重金属元素存在拮抗关系,原因可能在于籽粒中Cd2+、Pb2+等重金属含量较低,且其产地重金属污染状况可能并不一致。
QTL定位的亲本选择对于基因挖掘至关重要,亲本差异越显著越有利于发现更多更稳定的QTL。因此,本研究挑选了Cd含量差异显著的籼稻品种花楸03和粳稻品种SKC作为亲本构建DH群体,并对它们进行了一系列的生理学实验分析。尽管花楸03和SKC对Cd的耐性无显著差异,花楸03叶和籽粒中的Cd含量显著高于SKC。此外,这两个品种精米中的Cd含量均很低且差异不显著,说明Cd在籽粒中可能积累于胚、糊粉层或者颖壳。花楸03和SKC根中的Cd含量以及根吸收动力学研究均表明,它们对Cd的吸收能力不显著。该结果与文献中报道的结果一致,普遍认为木质部介导的根-茎长途转运是决定水稻地上部分和籽粒Cd积累的主要生理过程[22]。而这两个品种籽粒和地上部分中Fe、Zn、Mn等微量元素及K、Mg等大量元素的含量均无显著差异,说明这两个品种Cd积累差异可能与Fe2+、Zn2+等二价阳离子的转运系统无关。因此,利用这两个亲本开展QTL定位对于选育籽粒Cd低积累的优良品种具有重要价值,该过程中基因的鉴定有助于了解控制Cd向地上部分以及籽粒中转运的过程。
DH群体定位共检测到8个控制Cd积累的QTL,分别位于第2、3、4、7、8、10和11染色体上,能解释10.6%-39.4%的表型变异。QTL分析表明,无论是叶还是籽粒中,Cd与Fe、Zn均未参与共定位(数据待发表),与叶和籽粒中Fe等金属元素积累结果相一致。说明这两个品种的Cd积累差异可能与Fe2+、Zn2+等二价阳离子的转运系统无关,暗示控制Cd转运的QTL可能是特异性的。研究发现控制Cd向地上部分和籽粒转运的QTL存在较大差异,推测水稻中这两个过程可能具有不同的调控机制。第2染色体上同时检测到控制Cd向叶和籽粒转运的QTL,在染色体上位置与OsCAL1[15]接近;第7染色体上检测到的QTL与OsHMA3[12]和OsNRAMP5[23]接近;第10染色体上检测到的QTL与Xue等[8]接近。此外,其余4个QTL未见已报道的Cd积累相关基因落在相关区域。其中,第3染色体上检测到的控制Cd向籽粒转运的QTL(qGCd3)定位至RM6266-RM2334的21 cM区间,LOD值(3.81)和贡献率(39.4%)均较高。试验误差、环境影响以及定位群体的背景差异,会造成同一QTL的贡献率及LOD值在不同定位群体中会有所变化。LOD值的变化相对较小,是QTL定位中较为可靠的参数,一般说来LOD值在2以上该位点就有QTL的存在。本研究结果说明此位点QTL存在的可能性很高。但这两个标记之间约21 cM距离,包含近400个基因,需要进一步进行高精确度连锁分析。目前已构建以花楸03为供体亲本,SKC为轮回亲本的片段替换系,拟通过高精确度连锁分析,找到控制镉向水稻籽粒转运的主效基因,解析水稻镉积累的分子机理。
4 结论
从花楸03和SKC构建的DH群体中共检测到8个控制Cd在叶和籽粒中积累的QTL。水稻中控制Cd向地上部分和籽粒转运的调控机制不同,其中木质部介导的根-茎长途转运是决定水稻地上部分和籽粒Cd积累的主要生理过程。第3染色体上检测到的QTLqGCd3处可能存在一个控制镉向籽粒转运的重要基因。
文章所有附表数据请到本刊官网下载(http://biotech.aiijournal.com/CN/1002-5464/home.shtml)。
