ABCB1介导HDAC非选择性抑制剂panobinostat耐药的机制研究
2022-09-14窦永海高晓丽
窦永海,高晓丽
(1.天津市永久医院,天津 300450;2.天津市第五中心医院,天津 300450)
panobinostat(panobinostat,PBST)是一种强效口服泛组蛋白去乙酰化酶(HDAC)抑制剂,该抑制剂于2015年被FDA批准用于治疗复发或难治性多发性骨髓瘤患者[1]。大量临床试验研究正在评价panobinostat对多种实体瘤中的抗癌效果,然而不可避免的耐药是其进一步临床开发和应用的巨大障碍。ABCB1与肿瘤细胞耐药高度相关[2],表达于肿瘤细胞膜的ABCB1可将抗肿瘤药物泵出胞外,降低胞浆内抗肿瘤药物有效浓度,介导治疗抵抗[3]。然而,尚无研究充分揭示ABCB1在panobinostat耐药中的作用和分子机制。因此,本研究拟通过细胞水平、体外酶活性水平以及计算机辅助设计评价ABCB1介导panobinostat耐药的作用及分子机理,进一步明确和充实PBST发生耐药的机制。
1 资料与方法
1.1 细胞及试剂KB-3-1、KB-C2、SW620/Ad300、SW620、HEK293/pcDNA3.1以及HEK293/ABCB1均由美国St.John′s University的Zhe-Sheng Chen教授赠与。帕比司他(panobinostat,PBST,批号S1030)、依鲁替尼(ibrutinib,批号S2680)、尼罗替尼(nilotinib,批号S5205)、拉帕替尼(lapatinib,批号S2111)、厄洛替尼(elortinib,批号S1023)、紫杉醇(批号S1150)、阿霉素(批号S1208)以及顺铂(批号S1166)购置于Selleck公司。牛血清白蛋白(BSA,批号37525)、特级胎牛血清(FBS,批号10099)、二甲基亚砜(批号D5879)、DMEM基础培养基(批号2323405)、青/链霉素(批号30-001-CI)以及胰蛋白酶(批号25-051-CI)购置于美国Corning公司。PVDF膜(批号ISEQ00010)以及绿色荧光标记的Goat-anti-mouse IgG抗体(批号A-11029)购自美国Thermo Fisher Scientific公司。ABCB1单克隆抗体(批号SAB2108866)、DAPI(批号D9542)、MTT(批号M2128)、BCA蛋白定量试剂盒(批号71285-M)以及verapamil(批号1711202)购置于美国Sigma公司。氚标紫杉醇(批号33152970)购置于美国Moravek公司。
1.2 仪器HERAA cell 150i细胞恒温CO2培养箱以及C1112B超净工作台购置于美国Sigma公司。I Mark全自动酶标仪以及Powerpac hc SDS-PAGE蛋白质电泳-转膜系统购买于美国Bio-Rad公司。5418R低温冷冻离心机购置于美国Eppendorf公司。DMI 3000B倒置荧光显微镜购置于瑞士Leica公司。Tri Carb 2100TR液体闪烁分析仪购置于美国Packard公司。
1.3 细胞培养 本研究利用的全部细胞均在含有10%FBS的DMEM培养基中,并于含有5%浓度的CO2培养箱以37℃的潮湿温度培养。KB-C2、SW620/Ad300为药物诱导的耐药细胞,在使用前需要加入相应的抗肿瘤药物维持其耐药性。具体方法为,在KB-C2细胞中以2 μg/ml的colchicine培养72 h,在SW620/Ad300细胞中以300 ng/ml的doxorubicin培养72 h,并更换无药物的完全培养基,培养并正常传代两周后使用。HEK293/ABCB1为稳定转染全长ABCB1编码区的带有G418抗性细胞,使用前采用2 mg/ml的G418筛选稳定细胞72 h后,更换无药物的完全培养基,培养并正常传代两周后使用。
1.4 基于MTT法的细胞增殖检测及逆转实验 显微镜下观察处于对数生长期状态良好的细胞,PBS进行清洗,然后加入0.25%胰酶进行消化(37℃培养箱),消化时间根据细胞特点有些许差别,消化完成后制备单细胞悬液,并利用血球计数板计数,规定细胞密度为3×104个/ml,根据细胞实际浓度吸取特定体积的细胞悬液,并加入一定体积的培基,吸管吹打混合均匀,吸取200 μl液体加入到96孔板中,并设置空白对照,即不含细胞悬液的培基,并将边缘孔用PBS填充,细胞铺板完成后轻轻拍打培养板使细胞悬液均匀分布在孔中,于倒置光学显微镜下观察细胞铺板密度和细胞状态,将培养板置于37℃、5%CO2培养箱中过夜稳定培养使细胞贴壁。细胞贴壁后,加入按浓度梯度配置好的PBST,以DMSO处理组为对照组,培养72 h。给药培养72 h后,给药组和对照组每个孔加20 μl MTT溶液,培养4 h。经过4 h孵育,从培养箱中取出培养板,用负压泵吸去上清液,移液枪吸取100 μl DMSO加入到孔中,并放置于摇床上震荡混合,使结晶紫甲瓒充分溶解,溶液呈透明色即可于酶标仪490 nm处检测OD值。采用Graphpad 7.00软件计算药物对细胞的半抑制浓度。针对逆转实验,按照上述体系,将特定浓度的逆转药物加入96孔板中,于培养箱中孵育2 h,并按照上述步骤进行后续处理。
1.5 Western blot法评价ABCB1蛋白表达水平 取对数生长期的KB-C2细胞,消化并计数,并以2×104个/孔的浓度接种于6孔板,转移到培养箱中过夜稳定培养。细胞贴壁后,每孔加入2 μl的panobinostat,使其KB-C2细胞药物终浓度为100 nmol/L,加药处理不同时间(24、48以及72 h)。处理完成后,取出细胞培养板,将细胞从培养皿底部刮下来,吸管吸取含有细胞的培养液加入到1.5 ml EP管中,放置于低温离心机中进行离心,并采用冰PBS洗涤细胞,清洗1~2次。将提前配好的细胞裂解液(RAPA∶CocktailA∶CocktailB=100∶1∶1)加入到细胞沉淀中裂解细胞,收集裂解组分于离心管中,以12 000 r/min转速离心15 min,取上清液为总蛋白提取液。采用BCA法进行蛋白定量,按一定比例混匀蛋白原液和超纯水,使上样蛋白量为20 μg,并加入5×SDS上样缓冲液。在95℃水浴中孵育样品10 min使其变性。根据比例配制凝胶,待胶凝后向孔中加入制备好的蛋白样品和预染marker,进行电泳。电泳完成后,进行转膜,设置转膜条件:电流200 mA,电转2.5 h。结束后,将PVDF膜放在提前用1×TBST缓冲溶液配置好的5%的脱脂牛奶中,于室温置于低速摇床1 h。牛奶封闭结束。按照抗体说明书配置适当浓度的一抗(抗ABCB1,1∶1000;抗GAPDH,1∶1 000)。将膜放入杂交带中,加入一抗稀释液,封口机封口。放在4℃摇床上,慢摇孵育过夜。一抗孵育结束后,一抗进行回收,使用TBST缓冲液清洗PVDF膜2~3次,每次5 min。孵育二抗1 h(HRP兔抗,1∶2 000),使用TBST缓冲液清洗PVDF膜2~3次,每次5 min。配置ECL显影液(A液∶B液=1∶1),将配置好的发光显影液(ECL)均匀加到目的蛋白条带上进行显影拍照。
1.6 免疫荧光法评价ABCB1质膜定位 取处于对数生长周期的细胞,消化并计数,并以2×104个/孔的浓度接种于6孔板,转移到培养箱中过夜稳定培养。细胞贴壁后,每孔加入2 μl的panobinostat,使细胞药物终浓度为100 nmol/L,加药处理不同时间(24、48以及72 h)。实验同时设置阴性对照组(亲本细胞)和模型组(经DMSO处理的耐药细胞)。作用完成后,采用4%多聚甲醛作为固定液,吸取一定体积加入到孔中,固定时间为30 min。固定结束之后,弃去多聚甲醛溶液,用冰PBS洗涤两次。然后采用0.25%的Triton X-100溶液进行透化,透化时间为5 min,再用PBS清洗液清洗2次。加入5%BSA,在37℃孵箱中进行封闭,时间为1 h。封闭结束之后,加入一定体积按照抗体说明书使用5%BSA配置的一抗稀释液(抗P-gp,1∶500),于37℃培养箱中孵育1 h并用PBS进行清洗。然后孵育二抗(绿色荧光标记的Goat-anti-mouse IgG,1∶500)。利用抗荧光猝灭封片剂覆盖板中细胞,并置于倒置荧光显微镜下观察成像。
1.7 以氚标紫杉醇为探针评价药物蓄积水平 取处于对数生长周期的细胞,消化,计数,并接种于6孔板中(2×104个/孔),转移到培养箱中过夜稳定培养。细胞贴壁后,每孔加入2 μl的panobinostat,使细胞药物终浓度分别为3 μmol/L和6 μmol/L,加药处理不同时间(24、48以及72 h)。实验同时设置加ABCB1特异性逆转剂(verapamil)阳性对照组,加药处理2 h。2 h后,向孔中加入氚标紫杉醇,使其终浓度为10 μmol/L,继续处理2 h,然后使用PBS清洗氚标抗肿瘤药物。同时进行细胞消化操作,收集细胞转移到液体闪烁计数瓶中,根据液体闪烁计数仪的数值确定药物的蓄积能力。
1.8 钒敏感的ATPase活性实验ATP酶检测缓冲系统中分别加入经过预制的ABCB1膜囊泡[4](总量为10 μg),其中PC组加入0.3 mmol/L的钒酸酯,调整反应温度为37℃,作用时间为4 min。加入Mg-ATP(5 mmol/L)促使反应的开始,调整panobinostat的浓度,范围在0~40 μmol/L。调整反应温度为37℃,作用时间为25 min,加入5% SDS终止反应液使反应停止。于酶标仪600 nm处测量最大吸收OD值绘制相关酶活曲线,ATP酶反应活性为游离的磷酸。
1.9 计算机辅助分子对接评价PBST与ABCB1的潜在结合位点 利用ChemBioDraw Ultra 14.0和AutodockTools软件评价PBST与P-gp底物结合空腔的结合。首先导入PBST的分子结构,使用Chem-Bio3D Ultra 14.0模块转换结构,使其最终为三维结构,并利用MMFF94将力场优化。P-gp的三维结构(PDB ID:6ETI)从RCSB Protein Data Bank(www.rcsb.org)下载得到。P-gp和PBST均使用Autodock-Tools 1.5.6转化为PDBQT格式。分子对接部分,采用Autodock vina 1.1.2软件进行。根据P-gp原配体的位置,确定P-gp活性位点的坐标为:X-148.155,Y-150.903,Z-150.147。调整参数exhaustiveness的值为20。对接结束后,根据评分结果选取打分值最高的构象,并利用Free Meastro 11.9对结果进行分析。
1.10 统计学方法 采用SPSS 22.0软件进行统计学处理。计量资料结果以平均值±标准差(mean±SD)表示,采用单因素方差分析进行多组间比较,采用LSD-t法进行多重比较,采用用χ2检验进行组间比较。P<0.05代表具有统计学意义。
2 结果
2.1 Panobinostat对肿瘤MDR细胞的增殖抑制活性显著下调 本研究首先利用MTT法评价panobinostat对过表达ABCB1的肿瘤MDR细胞增殖活性的影响。如图1A-1C所示,在过表达ABCB1的肿瘤MDR细胞KB-C2、SW620/Ad300、HEK293/ABCB1细胞中,panobinostat的IC50值 分 别 为0.604、0.293 7以 及0.280 6 μmol/L,高于其在亲本细胞KB-3-1、SW620/Ad300以及HEK293/pcDNA3.1细胞中的IC50值。
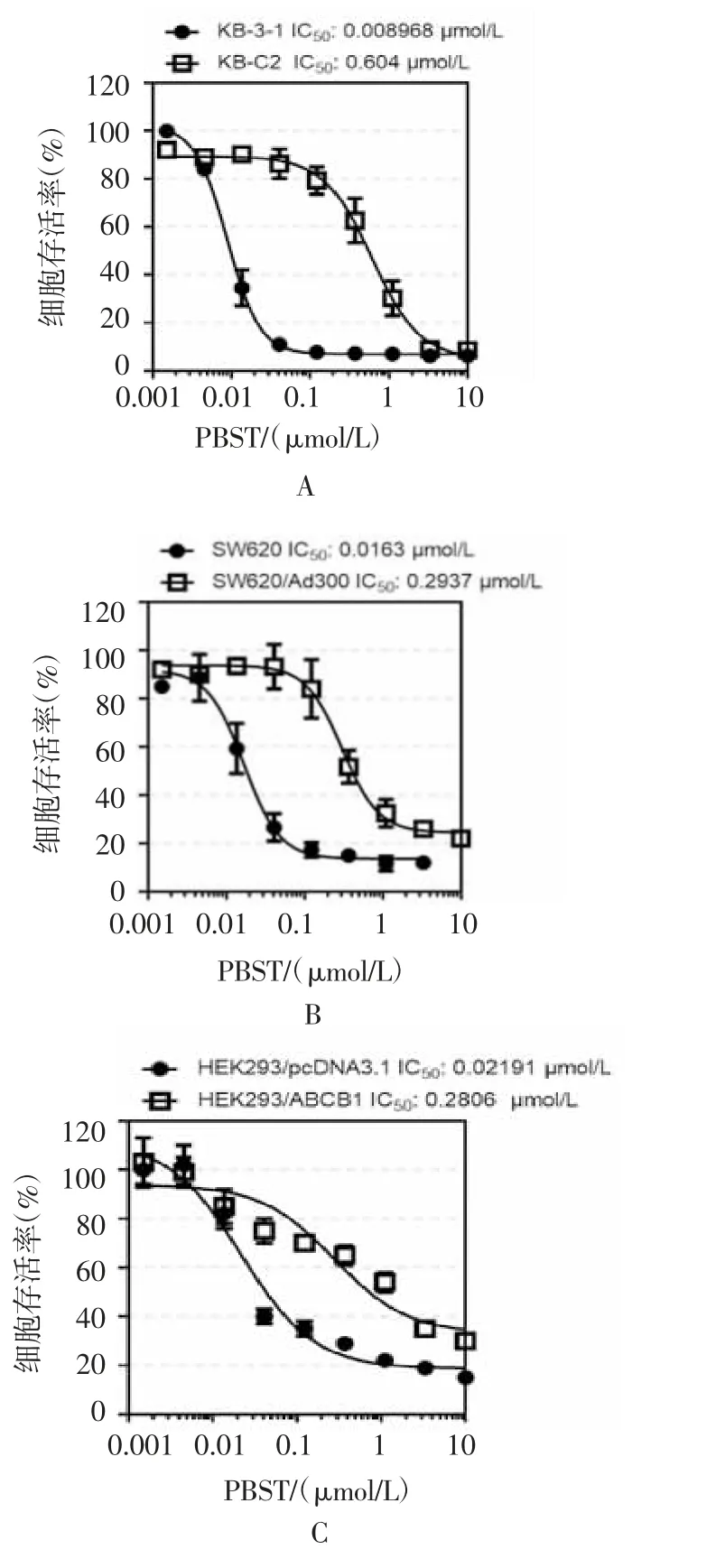
图1 Panobinostat在肿瘤MDR细胞和亲本细胞中的增殖抑制活性曲线
2.2 ABCB1逆转药物上调panobinostat对肿瘤MDR细胞的增殖抑制活性 在MDR细胞KB-C2以及SW620/Ad300细胞中,以panobinostat联合应用已报道的耐药逆转小分子verapamil(10 μmol/L)、ibrutinib(5 μmol/L)、nilotinib(5 μmol/L)、lapatinib(5 μmol/L)以及erlotinib(5 μmol/L)后,panobinostat对KB-C2以及SW620/Ad300细胞的IC50值较对照组(DMSO组)均显著下调,差异具有统计学意义(KB-C2:n=3,F=148.8,P<0.05;SW620/Ad300:n=3,F=221.8,P<0.05)。然而,在亲本细胞KB-3-1和SW620细胞中,上述耐药逆转小分子并不显著影响panobinostat的IC50值(KB-3-1:n=3,F=1.70,P=0.209;SW620:n=3,F=0.949,P=0.484)(图2A-2B)。

图2 ABCB1逆转剂逆转panobinostat耐药
2.3 Panobinostat上调ABCB1蛋白表达水平,不改变ABCB1质膜定位 如图3所示,在肿瘤MDR细胞KB-C2中给予低浓度panobinostat处理,ABCB1的蛋白表达水平以时间依赖性上调。但是图4的免疫荧光结果提示,panobinostat并不显著改变ABCB1在肿瘤MDR细胞中的质膜定位水平。
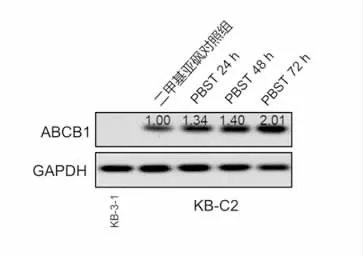
图3 PBST对肿瘤MDR细胞中ABCB1蛋白表达水平的影响
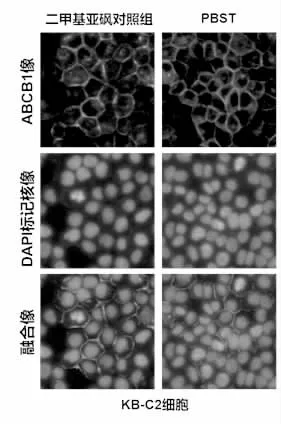
图4 PBST对肿瘤MDR细胞中ABCB1质膜定位的影响
2.4 Panobinostat上调化疗药物在肿瘤MDR细胞中的蓄积 在肿瘤MDR细胞KB-C2中,预处理2 h的panobinostat可剂量依赖性地显著上调氚标紫杉醇的药物蓄积水平,并且与阳性药物verapamil作用效果相当(n=3,F=21.51,P<0.05);但在亲本细胞KB-3-1中,图示浓度的panobinostat并不显著改变氚标紫杉醇的药物蓄积水平,且阳性对照组verapamil也未能改变氚标紫杉醇的蓄积水平(n=3,F=0.465,P=0.714)(图5A-5B)。
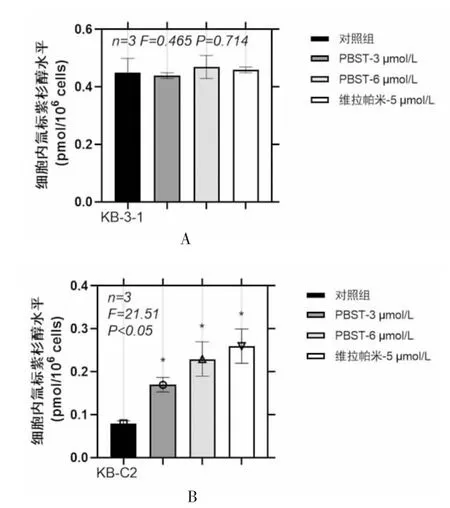
图5 PBST对肿瘤MDR和亲本细胞中氚标紫杉醇蓄积水平的影响
2.5 Panobinostat上调ABCB1的ATP酶活性,并与ABCB1底物结合口袋的氨基酸残基发生相互作用在钒敏感的ATP酶活性实验中,panobinostat可显著上调ABCB1的ATP酶活性,并呈现一定的剂量依赖性特征(图6A-6B);分子对接结果显示,panobinostat与ABCB1的亲和力为-9.1 kcal/mol,并且与TYR306形成一个氢键相互作用、与PHE982、PHE302形成Pi-Pi相互作用、与PHE335形成Pi-cation相互作用(图7)。
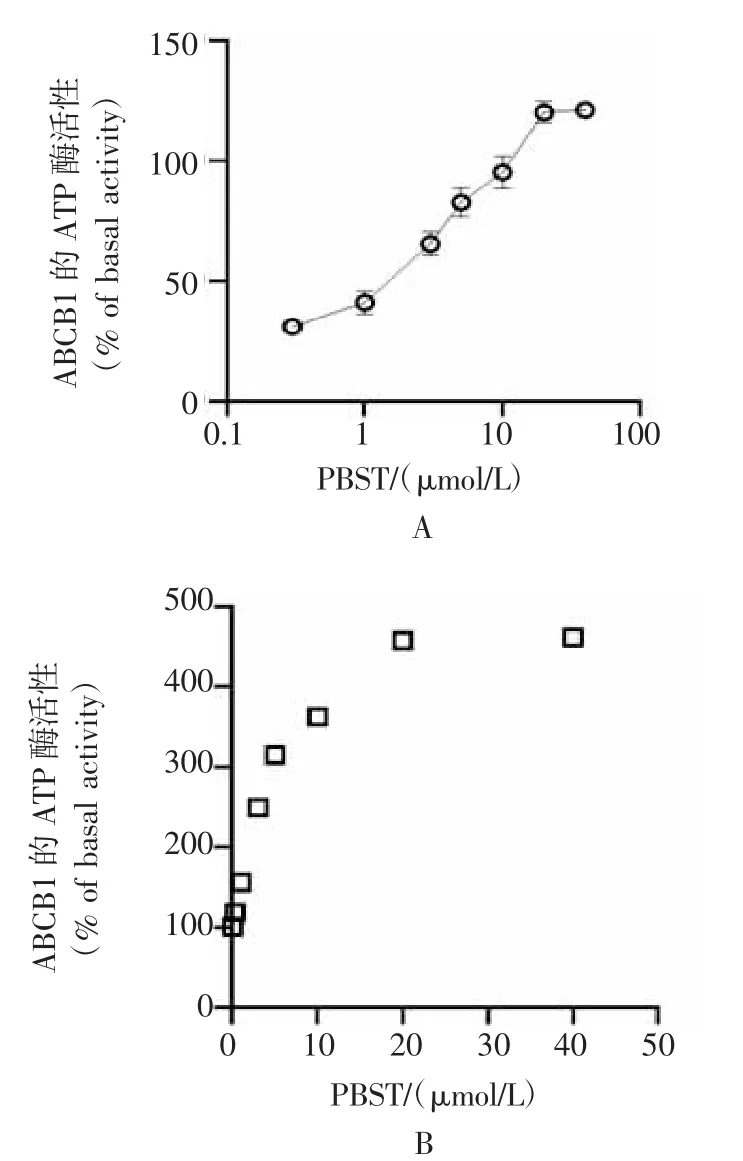
图6 PBST上调ABCB1的ATP酶活性

图7 分子对接模拟panobinostat与ABCB1的潜在结合位点
3 讨论
肿瘤多药耐药是耐药肿瘤细胞对多种其他未暴露的具有不同结构和靶点的抗肿瘤药物产生耐药性的现象。恶性肿瘤的多药耐药是临床中多种抗肿瘤药物治疗失败的的主要原因之一。已发现ATP结合盒家族的成员参与了这一过程。根据基因组序列和TMD(跨膜结构域)结构,ABC转运蛋白超家族可分为七大类型,由于其可以导致化疗药物外排增加引起了广泛关注。近年来,人们做出了许多努力来调节这些ABC转运体,从而增加细胞内药物浓度并逆转多药耐药[5-6]。ABC转运蛋白在正常组织和肿瘤细胞中都表达,其在肿瘤细胞内原发性表达导致原发性耐药[7];另外,ABC被特定结构抗肿瘤药物诱导表达后可以导致获得性耐药[8]。ABCB1是第一个被鉴定的人类ABC转运体,是一种负责调节药物通透性的蛋白。ABCB1蛋白的过度表达预示着对抗肿瘤药物治疗的反应性降低,造成治疗结果预期较差,甚至影响患者生存[9]。ABCB1可以外排化疗药物,如阿霉素、紫杉醇等,并降低细胞内药物水平,这是化疗耐药的主要原因之一[10]。随着越来越多的癌症治疗靶点被研究,靶向治疗在癌症治疗中广泛兴起并应用于临床,使患者受益。部分靶向药物仍由于ABC转运蛋白的作用而出现耐药,最终导致治疗失败[11]。因此,致力于研究调控ABC转运蛋白克服肿瘤多药耐药,为抗癌靶向药物的临床药效学评价和联合用药策略提供有力支撑。
Panobinostat是一种口服组蛋白去乙酰化酶(HDAC)泛抑制剂,并且是HDAC抑制剂中最强小的小分子。该药物于2015年被FDA批准用于治疗复发或难治性多发性骨髓瘤患者[12]。同时,panobinostat也进入了多种血液和实体肿瘤的临床评价,其中部分进入了Ⅰ期或Ⅱ期临床试验,如与西罗莫司联合治疗前列腺癌、三阴性乳腺癌、霍奇金淋巴瘤和皮肤T细胞淋巴瘤、骨髓增生异常综合征[13]。相关研究报道了panobinostat的耐药发生的原因。研究表明,panobinostat应用于治疗急性髓系白血病(acute myeloid leukemia,AML)出现耐药可能是由于HO-1的水平受低表达GFI-1基因的影响[14]。同时,CXCR-4介导的panobinostat的耐药可通过mTOR抑制剂everolimus抑制P21被逆转,间接提示mTOR信号转导途径的激活和CXCR4在panobinostat耐药中的关键作用[15]。然而对于ABC转运蛋白与panobinostat耐药的关系,仍没有相关的研究阐明机制。本研究针对上述科学问题,以经典的肿瘤多药耐药细胞为模型,深入探究ABCB1介导的panobinostat耐药的机制。
将Panobinostat同时作用于亲本细胞和过表达ABCB1的人类口腔上皮细胞癌KB-C2细胞中发现,对亲本细胞作用明显强于过表达ABCB1的人类口腔上皮细胞癌KB-C2细胞。另外,研究panobinostat对人类结肠癌细胞SW620/Ad300耐药细胞的增殖抑制作用,实验发现,panobinostat抑制细胞增殖的能力被显著削弱。因此,推断panobinostat耐药性的发生可能是由于ABCB1转运蛋白的过表达。进一步研究panobinostat在转染ABCB1全长基因的人类胚胎肾细胞HEK293(HEK293/ABCB1)和亲本细胞中的增殖抑制活性有明显差异,发现panobinostat在亲本细胞中抑制增殖的能力更强,这一实验结果验证了笔者的假设:即panobinostat的耐药是ABCB1的过表达介导的。
近十年来,越来越多的小分子抑制剂被研究证明具有逆转ABCB1转运蛋白介导的肿瘤MDR的活性,如verapamil[16]以及部分靶向药物,如ibrutinib、nilotinib、lapatinib和erlotinib[17-19]。在本研究中,上述小分子联合panobinostat均可显著增加panobinostat在肿瘤MDR细胞中的增殖抑制活性,证明ABCB1介导panobinostat耐药。
尽管上述结果提示ABCB1是介导panobinostat耐药的关键蛋白,但其导致耐药的机制仍不清楚,有待于进一步研究。因此,本研究进一步评价panobinostat对ABCB1转运蛋白表达水平的影响。Western blot结果提示,panobinostat可显著增加KBC2细胞中ABCB1的表达水平,且这种作用呈现时间依赖性。这说明,ABCB1介导panobinostat的治疗抵抗很大可能是通过上调ABC转运蛋白的表达水平。但是,panobinostat介导ABC转运蛋白表达水平的上调的具体机制是未知的,这可能涉及一些关键信号通路蛋白的参与。研究表明,部分抗肿瘤药物可通过激活ABCB1的启动子和增强子元件介导其过度表达[20],panobinostat是否也通过这一机制调控ABCB1的表达上调?进一步的研究会解决这些问题。此外,ABCB1在转录后通过翻译后修饰定位于细胞膜,从而发挥其耐药泵的作用。因此,上调ABCB1在肿瘤细胞膜的丰度是panobinostat耐药的另一潜在因素。但是通过免疫荧光实验,并未发现panobinostat可显著改变ABCB1在肿瘤MDR细胞中的定位。
ABCB1介导的肿瘤MDR有多种特征,其中最显著的特征之一是导致抗肿瘤药物蓄积水平发生改变[5]。ABC转运蛋白可以将抗肿瘤药物外排,导致其在肿瘤细胞中蓄积水平降低,进而导致药物无法发挥特定的疗效而导致化疗失败。
紫杉醇是ABCB1的作用底物,可通过ABCB1的外排作用泵出细胞。因此,本部分研究以氚标紫杉醇为探针,探究panobinostat作用于ABCB1过表达肿瘤MDR细胞中对蓄积水平的影响,进而间接评价ABCB1对panobinostat的蓄积水平的影响。结果显示,不同浓度的panobinostat可显著上调氚标紫杉醇在肿瘤MDR细胞KB-C2中的蓄积水平,表明panobinostat可在底物结合空腔内特异性结合ABCB1底物,导致紫杉醇的结合位点被占据,从而增加氚标记紫杉醇在细胞内的积累水平。这部分结果揭示了ABCB1介导panobinostat耐药的具体机制及过程。
上述结果表明,panobinostat很有可能是ABCB1的特异性底物。由于ABC转运体的核苷结合域具有ATP酶活性,可以通过水解ATP高能磷酸键获得能量,达到转运底物的目的。因此笔者推测Panobinostat可能对ABCB1的ATP酶活性有一定的影响。在本文钒敏感的ATP酶活性探究中,panobinostat可显著激活体外ABCB1的ATP酶活性,这与研究报道的大部分ABC转运蛋白底物的特征一致。计算机辅助分子对接结果表明,panobinostat可与ABCB1底物结合口袋的部分氨基酸残基以共价结合方式发生相互作用。综上,提示panobinostat是ABCB1的特异性底物。
Panobinostat作为FDA批准的最强效HDAC抑制剂,在多发性骨髓瘤中应用较为成熟,但临床研究表明,其在其他肿瘤中的应用的敏感性和有效性却受到了限制,耐药性是阻碍panobinostat进一步临床开发的重要障碍。在本研究中,笔者首次发现并阐明ABCB1介导panobinostat在肿瘤细胞中耐药的作用及分子机制,这将为panobinostat在临床的进一步应用提供有力的线索。诚然,由于肿瘤异质性等多方面因素的影响,造成了肿瘤耐药发生的机制十分复杂。ABCB1的过表达是否会影响应用panobinostat患者的预后,亟待通过进一步的临床试验验证。此外,本研究中发现panobinostat可上调ABCB1的表达水平,其潜在机制仍需进一步的分子生物学途径探究。
