单形性亲上皮肠道T 细胞淋巴瘤单中心回顾性分析
2022-09-14张广聪陈伶俐刘韬韬沈锡中
张广聪,殷 杰*,陈伶俐,刘韬韬,董 玲,沈锡中,3
1.复旦大学附属中山医院消化科,上海 200032
2.复旦大学附属中山医院病理科,上海 200032
3.上海市肝病研究所,上海 200032
结外淋巴瘤最常见于消化道,占总病例数的30%~40%[1]。单形性亲上皮肠道T 细胞淋巴 瘤(monomorphic epitheliotropic intestinal T-cell lymphoma,MEITL),又称2 型肠病相关性T 细胞淋巴瘤,是一种少见具有高度侵袭性的外周T 细胞淋巴瘤,主要发生于亚洲[2]。MEITL 与乳糜泻无相关性[2]。多个亚洲队列研究[3-5]报道,该病好发于男性,诊断中位年龄约为50 岁。
MEITL 患者起病时通常无特异性症状,诊断非常困难。因胃肠道累及范围及程度存在差异,MEITL 临床表现不同,常见症状包括腹痛、腹泻、恶性呕吐等,也有部分患者合并有发热、体质量减轻等症状[5-6]。约一半的MEITL 患者因肠梗阻和肠穿孔所致的腹膜炎、感染性休克及多器官功能衰竭行急诊手术[7]。该病患者若不治疗可在几个月内死于小肠多发穿孔或出血[8]。由于该病预后较差,早期须与炎症性肠病及其他侵袭性低的T 细胞增殖疾病相鉴别,以及时治疗[9]。本研究回顾性分析了 MEITL 的临床病理特征及预后,为MEITL 早诊早治提供临床经验。
1 资料与方法
1.1 一般资料 选择 2014 年 1 月至 2021 年 3 月在我院诊断的所有MEITL 患者。入选标准:(1)病理诊断明确;(2)有详细完整的医疗记录、病理报告及随访资料。本研究通过复旦大学附属中山医院伦理委员会审批(B2017-033R),所有患者均知情并签署知情同意书。
1.2 临床病理诊断依据 诊断分期依据CT 检查、18F-PET/CT 及骨髓检查评估,分期标准参照Lugano 胃肠道淋巴瘤分期系统[10]。采用免疫组织化学、原位杂交及T 细胞受体基因克隆重排检测等方法分析肿瘤组织的病理情况;MEITL 的组织病理诊断经两位经验丰富的病理学专家审核。
1.3 预后分析 通过患者门诊、住院病历或电话随访其生存情况,包括无进展生存期及总生存期。总生存期指从疾病确诊至死亡或观察截止时间;无进展生存期指疾病确诊到疾病进展的时间。
2 结 果
2.1 临床特征 共入选7 例MEITL 患者,均为男性,中位诊断年龄为55(33~77)岁。患者分别收治于不同科室,包括普外科、消化科及感染科。所有患者均无乳糜泻病史。7 例首发症状出现到确诊时间间隔为 2 d~20 个月。MEITL 原发灶在空肠4 例、回肠2 例、胃和十二指肠1 例,5 例存在消化道多部位受累。胃肠道以外的结外侵犯包括肝脏1 例、脾脏1 例、肺2 例。3 例患者行骨髓穿刺检查,示1 例淋巴瘤骨髓累及。5 例患者合并有发热和体质量减轻的B 症状,6 例患者合并小肠穿孔(表1)。4 例患者行PET/CT 检查评估肿瘤分期;3 例患者行内镜检查,包括胃肠镜及双气囊小肠镜,仅1 例患者通过胃镜活检确诊。

表 1 MEITL 患者的临床特征
2.2 组织病理特征 所有患者肿瘤组织中CD3 和CD8、T 细胞胞内抗原1(TIA1)高表达,CD56在6 例患者的肿瘤组织强表达。原位杂交结果表明,EB 病毒编码RNA(EBER)在所有肿瘤组织中均为阴性。1 例患者行T 细胞受体基因克隆重排检查,结果呈阳性。Ki-67 在肿瘤组织中高表达(30%~90%),可能与疾病活动程度相关;1 例ⅡE 期患者肿瘤组织中Ki-67 表达约30%,从首发症状出现到确诊间隔20 个月。图1 示淋巴瘤细胞侵犯小肠黏膜及肌层的H-E 染色及部分免疫组化染色结果。
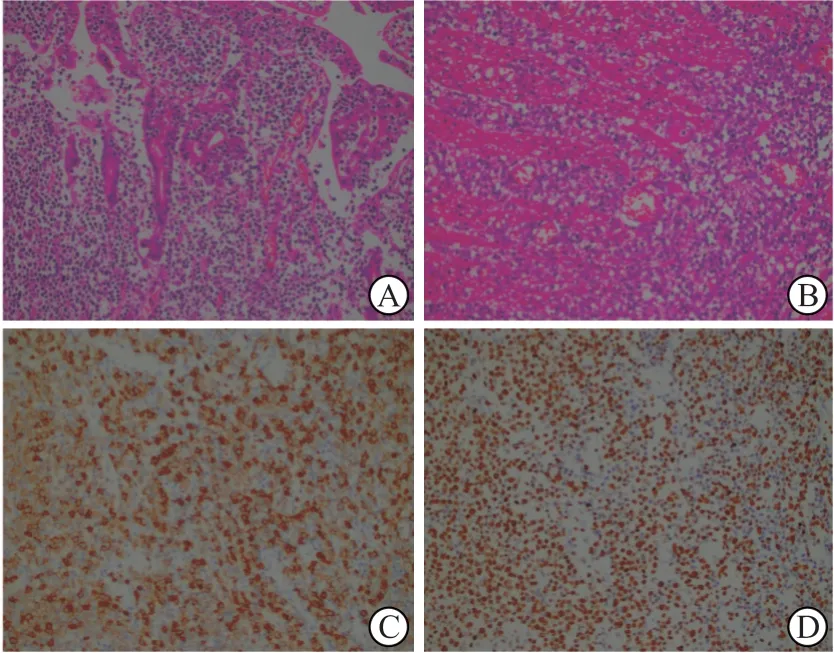
图1 小肠黏膜内广泛浸润及肌层侵犯的淋巴瘤细胞
2.3 治疗及预后 6 例患者接受外科手术治疗。 4例因小肠穿孔及消化道出血施行急诊手术,其中2例分别因再次消化道穿孔、小肠出血接受二次手术。小肠出血再次手术的患者于二次手术后4 d 死亡,死亡原因为大量腹腔出血及继发心肌梗死。
5 例患者接受化疗,2 例患者因肠瘘及出血未接受化疗。一线化疗方案包括CHOP(环磷酰胺+多柔比星+长春新碱+泼尼松),CHOP 联合依托泊苷或西达本胺,GEMOX(吉西他滨+奥沙利铂)。一线化疗后,1 例患者完全缓解,2 例患者部分缓解,2 例患者疾病进展。2 例疾病进展的患者后续接受GEMOX 联合西达本胺方案化疗;1 例完全缓解患者后续接受自体骨髓干细胞移植。
截至2021 年11 月9 日,2 例患者病情稳定(分期ⅡE,未行急诊手术,化疗应答),5 例患者死亡(4 例接受急诊手术,4 例分期Ⅳ期)。3 例患者肿瘤无进展期为1.0~7.4 个月,所有患者总生存期为4 d~12个月。患者治疗及预后总体情况见表2。
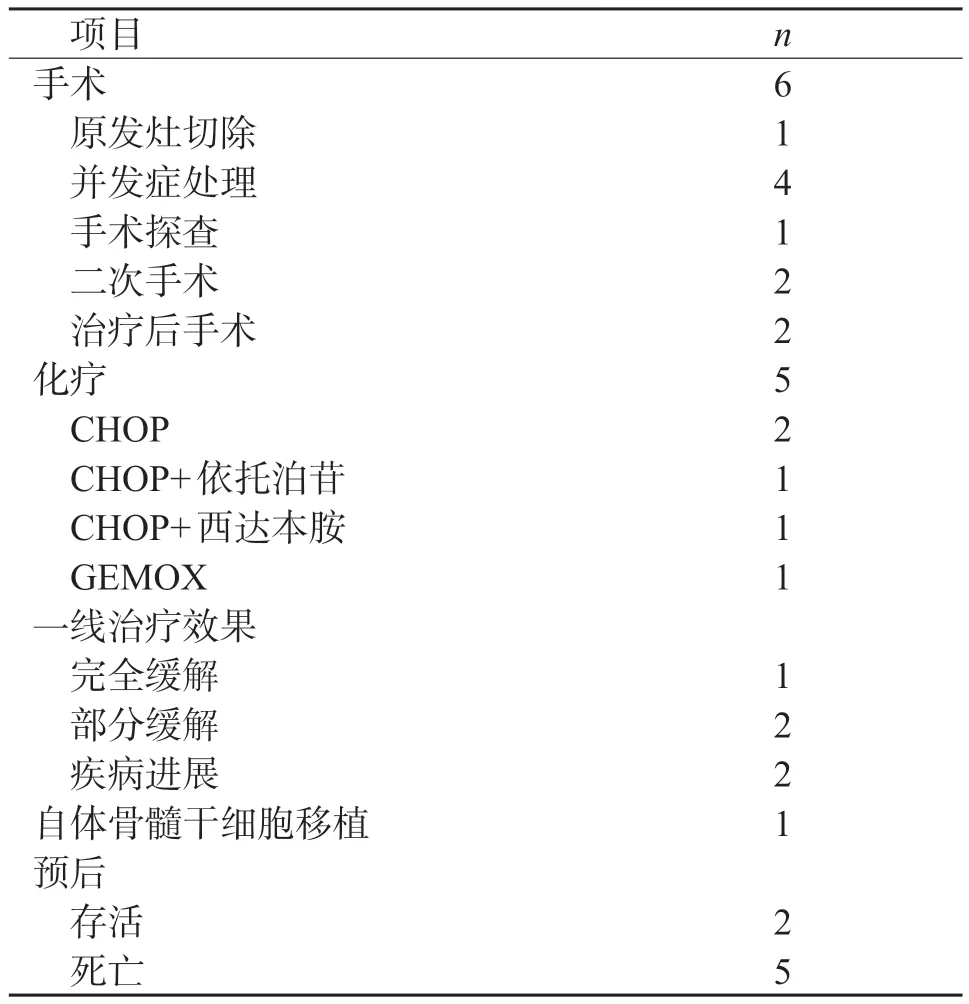
表 2 MEITL 患者治疗及预后
3 讨 论
MEITL 是一种罕见的起源于胃肠道的非霍奇金淋巴瘤,也是亚洲肠病相关性T 细胞淋巴瘤的主要亚型[3]。与1 型肠病相关性T 细胞淋巴瘤不同,研究并未发现MEITL 与乳糜泻的相关性[3]。幽门螺旋杆菌感染及溃疡性结肠炎所致的c-Met、MAPK及c-Myc 通路异常可能参与 MEITL 的发生[6],但MEITL 发病机制有待进一步研究。
多个亚洲患者队列分析[3,5,11]表明,MEITL 最常累及小肠,少数病例可累及胃和结肠。MEITL患者总体预后不佳,研究报道的中位总生存期为7~14.8 个月[5,8]。年轻、体力评分佳、Lugano 分期早、化疗完全应答及接受自体干细胞移植为生存相对良好的预测因子[5]。本研究中4 例患者诊断分期晚,总体预后差,截至随访日期5 例死亡,患者总生存期未超过12 个月。诊断分期晚和严重并发症可能是本研究中患者预后不佳的主要因素。
多数MEITL 患者直至进展期才会出现疾病特异性症状,导致诊断延迟,预后不佳。研究[5-6]显示多数病例在诊断时已属于晚期,并出现危及生命的并发症,不得不接受外科手术处理。本研究中4例患者并发小肠穿孔、出血及脓毒血症诱发的急腹症行急诊手术;另2 例患者小肠穿孔后分别形成炎症组织包裹及肠瘘,择期手术处理。因此,加强对MEITL 的认知,对出现消化道非特异性症状的患者尽早行影像学和内镜检查,可能有助于减少严重并发症的发生。
MEITL 特征性组织学表现为形态一致的中等大小T 淋巴细胞浸润[12]。内镜活检及外科切除是目前获取病变组织的主要方法。多数队列分析[5,8]证实了外科手术对MEITL 诊断的重要性。考虑到MEITL 内镜下表现的非特异性,活检对内镜下病理损害不明显的MEITL 意义重大[13]。日本学者的回顾性病例分析[14]表明,内镜随机活检对评估MEITL 浸润程度、判断特殊内镜表现及非肿瘤病变前驱期有重要帮助。内镜活检有限样本量影响其阳性检出率[15]。本研究中3 例患者行内镜检查,只有1 例胃镜活检确诊,另6 例患者通过外科手术确诊。因此多部位的病变活检及足够样本量对内镜诊断MEITL 至关重要。
T 细胞核内巨核细胞关联酪氨酸激酶、CD8 及CD56 广泛表达也是MEITL 区别于1 型肠病相关T细胞淋巴瘤的主要分子特征[12]。临床病理特征分析[16]表明,MEITL 的γδT 细胞受体表达常见,这有助于将其与其他淋巴瘤鉴别。本研究患者肿瘤内CD3、CD8、CD56 及 TIA1 强表达,而 EBER 均不表达,1 例患者T 细胞重排阳性,与既往研究[4,11]相一致。另1 例患者初始诊断为克罗恩病,肠镜随访病理提示消化道惰性T 细胞增殖紊乱性疾病,3 个月后患者因消化道穿孔行急诊手术,术后病理确诊为MEITL。因此,应寻找新的诊断分子以早期诊断MEITL。近期研究[17]表明,NKp46 可作为MEITL 诊断及治疗新靶点,有助于区分消化道T细胞淋巴增殖性疾病,但仍需大量研究验证NKp46在MEITL 早期诊治中的有效性。
MEITL 目前无标准治疗手段,主要采用外科手术、化疗及自体干细胞移植。多项回顾性分析[5-6,18-19]表明,与未行自体干细胞移植患者相比,接受自体干细胞移植患者的5 年总生存率及无疾病进展生存率显著提高。成功的诱导治疗是自体干细胞移植的先决条件,但受制于适宜的化疗方案及良好身体状态。目前应用最多的CHOP 方案对MEITL 诱导缓解效果不佳[5],因此亟需寻找更有效的诱导方案。有学者[3]发现,以L-门冬酰胺酶为基础的化疗完全缓解率要高于CHOP 方案;另有研究[20]报道,聚乙二醇门冬酰胺酶有助于诱导MEITL 缓解。西达本胺是我国自主研发的选择性组蛋白去乙酰化抑制剂,主要应用于难治性及复发性外周T 细胞淋巴瘤[21]。西达本胺为基础的联合治疗可稍许提高MEITL 患者生存获益[22]。本研究中,3 例MEITL 患者采用西达本胺联合方案,其中1 例至随访截止时病情稳定。西达本胺及聚乙二醇门冬酰胺酶在MEITL 中的应用效果尚待设计合理的多中心随机前瞻性研究证实。
综上所述,本研究表明,尽管内镜对MEITL诊断有重要价值,但当内镜诊断存疑时,及时外科介入有助于尽早诊断。此外,MEITL 患者预后不良可能与诊断分期晚、严重并发症相关,而择期手术、化疗应答好及接受自体干细胞移植能改善患者预后。近期SETD2、miRNAs-cMYC 循环、JAK-STAT 及G 蛋白偶联受体通路调控等分子病理机制的研究可能有利于开发MEITL 的诊治新靶点[23-25]。但是本研究为单中心回顾性病例分析,病例数量有限,缺乏有效的预后分析因素,且MEITL 为罕见疾病,因此需要国内外多中心合作开展前瞻性研究以评估MEITL 有效治疗方案及分析预后相关影响因素。
利益冲突:所有作者声明不存在利益冲突。
