非瓣膜性心房颤动患者左心耳结构与血栓形成的相关性
2022-09-14霍家敏李学文
霍家敏,李学文
(山西医科大学第三医院·山西白求恩医院·山西医学科学院·同济山西医院心血管内科,太原 030032)
非瓣膜性心房颤动(non-valvular atrial fibrillation, NVAF)是临床上最常见的快速型心律失常[1],是心源性脑卒中的独立危险因素,临床上约90%发生缺血性卒中的心房颤动患者的血栓来源于左心耳(left atrial appendage, LAA)[2]。与非心房颤动相关卒中相比,心房颤动相关卒中症状更严重,致残率及死亡率均更高,且更易复发[3]。Di Biase等[4]将LAA分为鸡翅型、风向袋型、仙人掌型和菜花型,其中菜花型LAA形态结构最复杂,最易形成血栓。实际上LAA形态多样,这四种形态学分类并不能涵盖LAA全部形态;同时心房颤动患者LAA结构发生重塑,因此不可简单的归于某一类型。本研究采用双源CT对LAA结构进行测量,旨在探讨NVAF患者LAA结构与血栓形成之间的相关性。
1 对象与方法
1.1 研究对象
选择2012年1月至2021年1月于山西医科大学第三医院拟行射频消融术的NVAF患者283例。纳入标准:行心电图诊断为心房颤动;均行经胸超声心动图( transthoracic echocardiography,TTE)、经食管超声心动图(transesophageal echocardiography,TEE)及双源CT检查;配合度高,可耐受造影剂。排除标准:中重度的瓣膜狭窄或关闭不全;先天性心脏病、心肌病及心脏肿瘤;患有影响检查结果的食管疾病;合并严重器官功能不全;接受心脏外科手术、射频消融术或心脏内置入术;孕妇及哺乳期妇女;临床资料不完整、图像质量欠佳。本研究符合并获得医院伦理委员会批准。
1.2 方法
1.2.1 研究方法 通过住院病历系统收集入选患者性别、年龄、体质量指数(body mass index, BMI)、吸烟史、饮酒史、心房颤动病程(精确至月)、心房颤动类型、是否合并睡眠呼吸暂停综合征(sleep apnea hypopnea syndrome, SAHS)、高血压、2型糖尿病、冠状动脉粥样硬化性心脏病(coronary heart disease, CHD)、脑卒中/短暂性缺血性发作(transient ischemic attack, TIA)/血栓栓塞病史(history of thromboembolism, TE)、血管疾病及充血性心力衰竭(chronic congestive heart failure,CHF)/左心室功能障碍。对所有纳入患者进行CHA2DS2-VASc评分并记录。本研究依据TEE结果将LAA内有血栓的患者归为血栓组(40例),无血栓患者归为非血栓组(243例)。分析2组患者病历资料及影像检查结果差异。
1.2.2 心房颤动分类 心房颤动分类参照2016年欧洲心脏病学会(European Society of Cardiology, ESC)发布的心房颤动管理指南[5],将持续时间≤7 d,可自行终止的心房颤动定义为阵发性心房颤动;持续时间>7 d,不能自行终止或持续时间≤7 d,需要药物或电复律才能终止的心房颤动定义为持续性心房颤动。
1.2.3 CHA2DS2-VASc评分系统 CHA2DS2-VASc评分系统[5],即C为CHF/左心室功能障碍,H为高血压,A为年龄>65岁,D为糖尿病,Sc为女性,V为血管疾病(包括血管疾病是指心肌梗死、复合型主动脉斑块及外周动脉疾病),以上危险因素均为1分;A2为年龄≥75岁,S2为既往脑卒中/TIA/TE,以上危险因素评分均为2分。且最高评分为9分。
1.2.4 左心耳结构指标的获取及测量方法 本研究采用双源CT无心电门控模式双期扫描,增强扫描第1期为右心房室对比充盈,第2期为左心房室对比充盈,进行心脏房室结构成像,扫描完成后,扫描工作站设定自动重建最佳收缩期图像数据并传至后处理工作站(SYNGO.VIA)进行图像重组后测量,过程中由2名临床经验丰富的放射科医师进行指导并对测量结果进行核查。
LAA结构测量方法:(1)LAA-L为从LAA口的中点到主叶尖沿着中心轴测量的直线的总和;(2)LAA-H为LAA口平面至最高点之间垂直距离;(3)LAA-V为用体积测量工具手工绘画单个短轴节段的心内边界,LAA长轴视图由多个短轴节段叠加得到;(4)LAA第一弯曲度为LAA根部与尖部第一转折处角度;(5)LAA叶数为从主叶出发,长宽高均>1 cm。
1.3 生化指标
记录入选患者入院后第1次检测的血肌酐(serum creatinine, SCr)、尿素氮(blood urea nitrogen, BUN)、尿酸(uric acid, UA)、脑钠肽(brain natriuretic peptide, BNP)、血浆纤维蛋白原(fibrinogen, Fbg)、D-二聚体(D-dimer, D-D)、甘油三酯(triglycerides, TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)、同型半胱氨酸(homocysteine, Hcy)以及平均血小板体积(mean platelet volume, MPV)。
1.4 影像学指标
据TTE结果,记录患者左室射血分数(left ventricular ejection fraction, LVEF)和左房前后径(left atrial diameter, LAD)。所有入选患者均行双源CT检查,并对扫描后的图像进行三维重建,记录LAA的长径(left atrial appendage length, LAA-L)、LAA的容积(left atrial appendage volume, LAA-V)、LAA的高度(left atrial appendage height, LAA-H)、第一弯曲度及叶数。
1.5 统计学处理
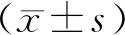
2 结 果
2.1 2组患者临床资料比较
与非血栓组相比,血栓组患者BMI值较大,心房颤动病程较长,CHA2DS2-VASc评分较高,持续性心房颤动比例较大,差异均有统计学意义(均P<0.05);2组患者性别、年龄、吸烟史、饮酒史、合并SAHS及CHD比例差异均无统计学意义(均P>0.05;表1)。
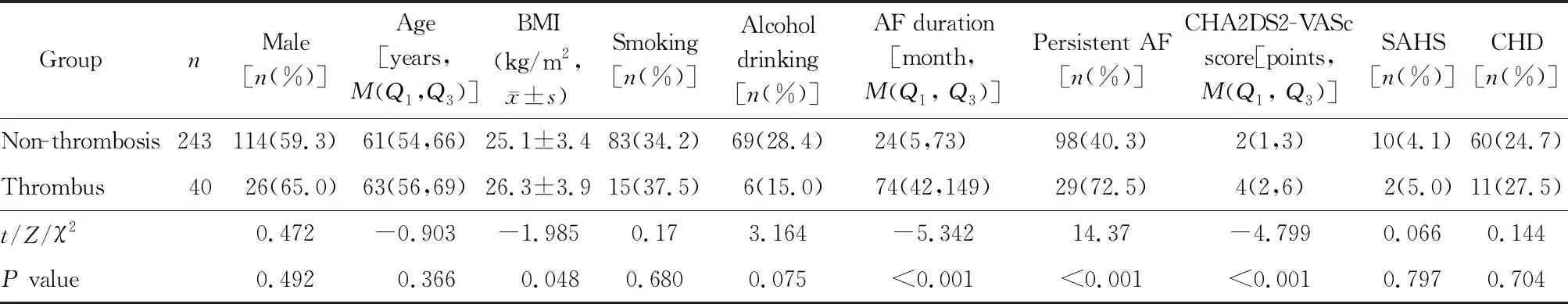
表1 2组患者临床资料比较
2.2 2组患者生化指标比较
与非血栓组相比,血栓组患者UA及BNP较高,差异均有统计学意义(均P<0.05);2组患者SCr、BUN、Fbg、D-D、TG、LDL-C、Hcy及MPV比较,差异均无统计学意义(均P>0.05; 表2)。

表2 2组患者生化指标比较
2.3 2组患者影像学指标比较
与非血栓组相比,血栓组患者LAD、LAA-L、LAA-V、LAA第一弯曲度及叶数较多,LVEF较小,差异均有统计学意义(均P<0.05);2组患者LAA-H比较,差异无统计学意义(P>0.05;表3)。
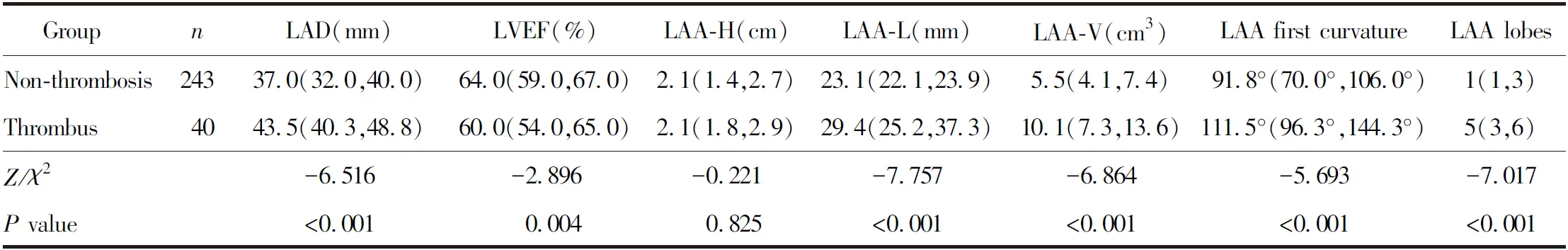
表3 2组患者影像学指标比较
2.4 单因素和多因素logistic回归分析
2组患者BMI、心房颤动病程、CHA2DS2-VASc评分、持续性心房颤动比例、UA、BNP、LVEF、LAD、LAA-L、LAA-V、LAA第一弯曲度和LAA叶数差异有统计学意义。将上述因素作为自变量纳入二元logistic回归分析。单因素分析结果显示,心房颤动病程、持续性心房颤动比例、CHA2DS2-VASc评分、UA、BNP、LVEF、LAD、LAA-L、LAA-V、LAA第一弯曲度以及LAA叶数与NVAF患者血栓形成风险增加相关(P<0.05)。多因素分析结果示,CHA2DS2-VASc评分、LAD、LAA-L、LAA-V、LAA第一弯曲度及LAA叶数是NVAF患者血栓形成的独立危险因素(表4)。
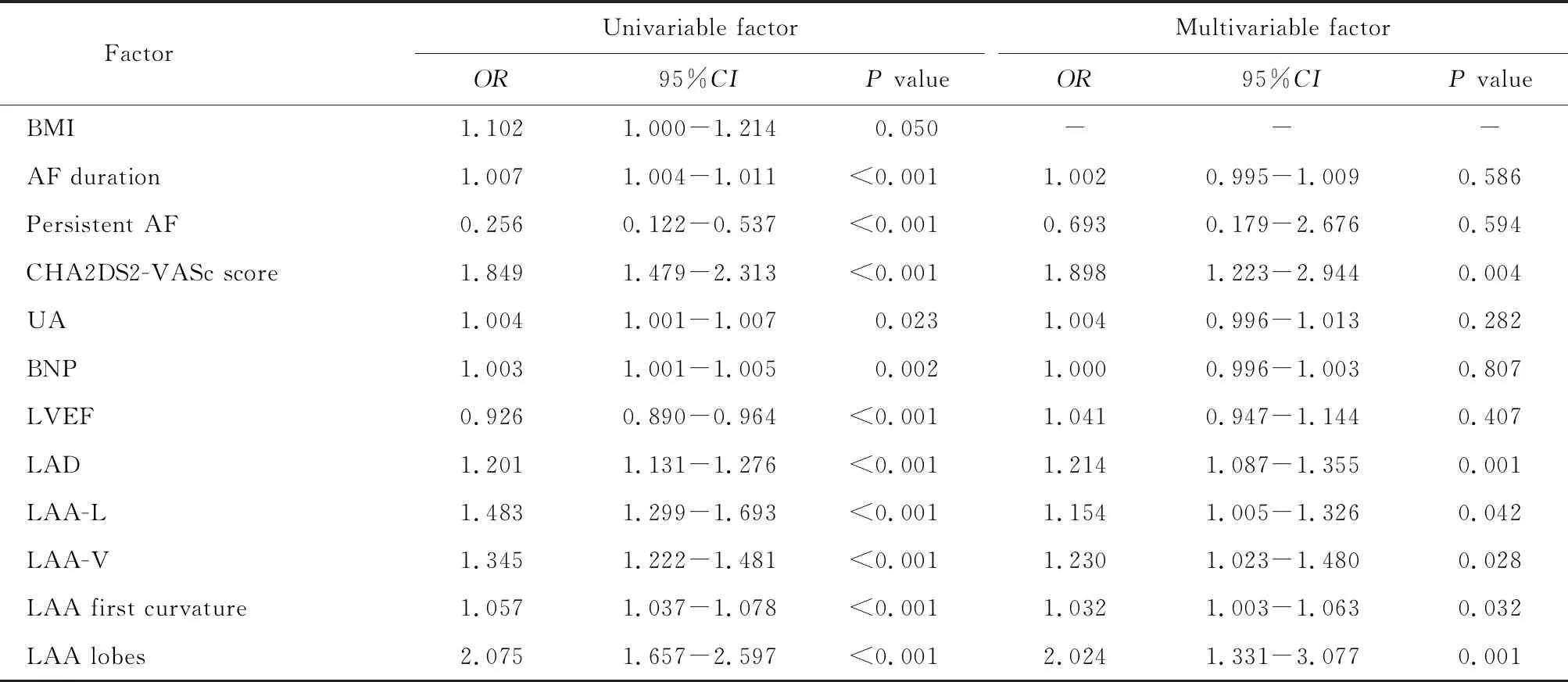
表4 左心耳血栓形成单因素和多因素logistic回归分析
2.5 ROC曲线分析
对CHA2DS2-VASc评分、LAD、LAA-V、LAA-L、LAA第一弯曲度及LAA叶数进行ROC曲线分析,结果显示:CHA2DS2-VASc评分最佳截断点为4分,LAD最佳截断点为39.5 mm,LAA-V最佳截断点为7.155 cm3,LAA-L最佳截断点为25.01 mm,LAA第一弯曲度最佳截断点为121.5 °,LAA叶数最佳截断点为3叶(表5,图1)。
本研究对LAA结构进行评分,即LAA-V7.155 cm3,LAA-L≥25.01 mm、LAA第一弯曲度≥121.5°、LAA叶数≥3各为1分,并对LAA结构评分进行ROC曲线分析,结显果示:LAA结构评分截断点为≥2分(AUC=0.946,P<0.001;表5,图1)。
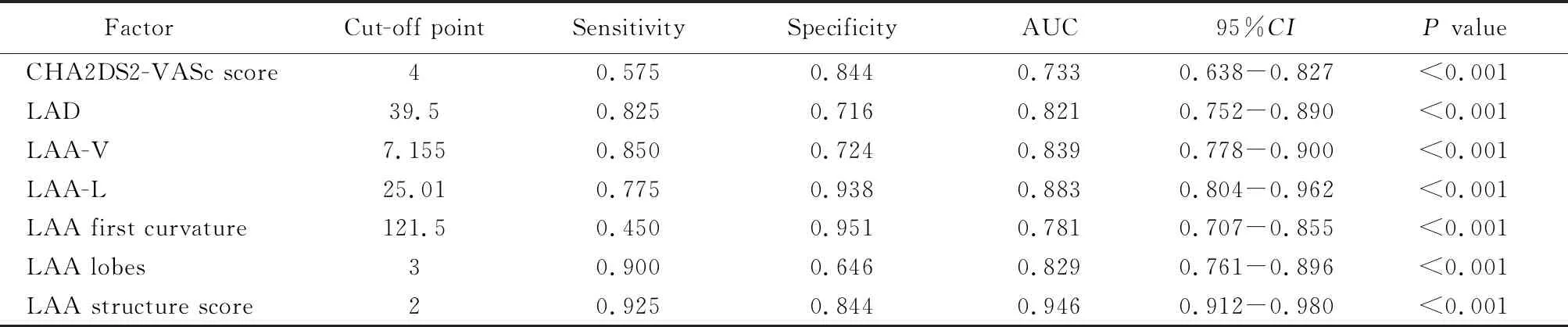
表5 左心耳血栓形成独立危险因素的ROC曲线分析
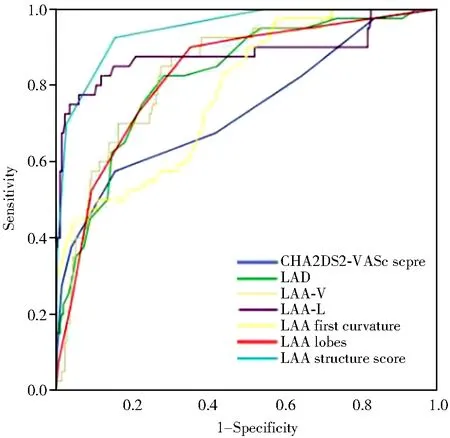
图1 预测心房颤动患者血栓形成风险的ROC曲线
3 讨 论
LAA为稍扁平的管状盲端结构,通常有一个或多个弯曲,颈部狭窄,末端有分叶,壁内富含梳状肌,表面凹凸不平[6]。LAA特殊的解剖结构使其成为心房颤动患者血栓形成最常见的部位[2]。窦性心律时,LAA内血流呈规律四相波,可以防止血液停滞和血栓的形成。当心房颤动发生时LAA各壁运动速度降低,四相波不明显,代之以振幅不一的锯齿波,血液不能完全排空,导致LAA不断增大,进而增加血栓形成风险[7,8]。本研究结果发现血栓组患者LAA-L、LAA-V明显大于非血栓组(P<0.001),且多因素logistic回归分析发现二者均为心房颤动患者血栓形成的独立危险因素(P<0.05),这可能是由于心房颤动本身导致的LAA重构,也可能与先天性因素有关。
本研究发现当LAA叶数≥3叶时,血栓形成风险明显增加,是独立危险因素(P<0.05)。Yamamoto等[9]研究发现与单叶LAA相比,多叶LAA内血液流速更低,更易形成血栓,与本研究结果相一致。
有研究表明LAA第一弯曲度越大,血流速度越慢,卒中风险越高[10]。本研究发现LAA第一弯曲度≥121.5°时可显著增加血栓形成风险,与之前研究结果不同的是,此次研究得出的角度偏大,可能与纳入对象均为拟行射频消融术的NVAF患者、发病时间较长、LAA发生重构有关。同时,本研究发现2例鸡翅型LAA第一弯曲处角度较大,其中1例LAA内可见血栓。因此与传统形态学描述相比,LAA弯曲的角度可能是一个更重要的预测血栓形成风险的因素。
本研究发现LAD≥39.5 mm可增加血栓形成风险。左心房重构既是心房颤动形成的原因,也是心房颤动的后果。LAD增大和心肌纤维化为心房颤动发生提供条件[11]。反之,心房颤动可激活钙依赖性蛋白酶和磷酸酶使细胞内钙离子增多,破坏左心房收缩纤维,影响线粒体功能,导致心房肌细胞肥大,左心房机械功能下降,进一步诱发心房颤动,导致心房颤动反复发作,难以终止[12,13]。心房颤动发生时,左心房和左心耳内规律血流消失代之以锯齿样改变可损伤血管内皮,引起血小板聚集,易于形成血栓[14-16]。
有研究认为阵发性心房颤动患者与持续性或长期持续性心房颤动患者发生脑卒中的风险几乎相同[5]。也有研究认为,相比于阵发性心房颤动,持续性心房颤动病程更长,负荷更重,LAA结构、血流动力学改变更明显,因此血栓形成风险更高[10]。本研究单因素分析示持续性心房颤动与血栓形成相关,而多因素分析矫正了混杂因素后,在P<0.05的检验水平上无法表明持续性心房颤动为血栓形成的独立危险因素。但持续性心房颤动与血栓形成之间的关系不可忽视,需要大样本及多中心研究进一步证实。
综上,LAA结构是NVAF患者血栓形成的独立危险因素,对临床评估NVAF患者血栓形成风险具有较好的预测作用。本研究缺点在于纳入对象均为住院患者,且为单中心研究,纳入病例数较少,导致研究结果可能存在偏差,仍需更大样本量进行进一步的研究。
