甘薯4种RNA病毒多重RT-PCR检测方法的建立
2022-09-14冯丽婷张剑峰迟胜起
冯丽婷,张剑峰,迟胜起
(青岛农业大学 植物医学学院,山东 青岛 266109)
甘薯,别名地瓜、红薯等,一种旋花科的缠绕草质藤本植物,主要以块根及茎蔓繁殖,易遭受甘薯病毒的侵害[1]。全世界已报道的甘薯病毒有30余种,其中我国报道的甘薯病毒约有20多种[2],且复合侵染严重,如甘薯病毒病害(Sweet potato virus diseases,SPVD)是由甘薯羽状斑驳病毒(Sweetpotatofeatherymottlevirus,SPFMV)和甘薯褪绿矮化病毒(Sweetpotatochloroticstuntvirus,SPCSV)协生共同侵染甘薯引起的病毒病害,可引起叶片扭曲、畸形、叶片褪绿以及植株严重矮化等症状,对甘薯产量影响极大,一般可使甘薯减产50%~90%,甚至绝收,是甘薯生产上的毁灭性病害[3-6]。甘薯属于无性繁殖作物,病毒可通过块根及秧苗等进行传播、积累,目前对于病毒病的防治并没有有效的防治药剂,生产上主要依靠茎尖脱毒,通过培育无毒薯苗,减少病毒病的发生,提高甘薯的产量[7]。脱毒苗的繁育,离不开便捷快速的病毒检测方法,建立高效、快捷的甘薯病毒检测方法刻不容缓[8]。
本试验以甘薯生产上发生严重的4种甘薯RNA病毒(SPFMV、SPCSV、SweetpotatovirusG(SPVG)、SweetpotatovirusC(SPVC))为研究对象,开展了上述4种甘薯RNA病毒的多重RT-PCR的检测方法研究,建立了4种甘薯RNA病毒的多重RT-PCR检测技术,旨在为甘薯脱毒苗培育和甘薯病毒的田间检测奠定基础。
1 材料和方法
1.1 试验材料
带有SPFMV、SPCSV、SPVG、SPVC的甘薯组培苗和无毒的甘薯组培苗均为青岛农业大学植物医学院植物病毒学实验室保存。
1.2 主要试剂与仪器
试剂:RNA提取试剂购自艾科瑞生物科技有限公司;cDNA合成试剂盒购自山东思科捷生物技术有限公司;PCR相关试剂购自宝生物工程(大连)有限公司。
仪器:全自动样品快速研磨仪JXFSTPRP-24(上海净信科技)、PCR扩增仪(BioRad T-100)、凝胶成像系统(UVP)。
1.3 特异性引物设计
根据GenBank中收录的SPFMV、SPCSV、SPVG、SPVC 4种甘薯病毒外壳蛋白(Coat protein ,CP)序列,应用DNAMAN 8.0进行序列比对分析,应用Premier 5.0 软件分别设计了上述4种甘薯病毒的特异性引物(表1),相关引物由上海生工生物股份有限公司合成。

表1 所用甘薯病毒的特异性引物Tab.1 Specific primers of sweet potato virus used
1.4 样品总RNA的提取
利用TRIzol法对甘薯病毒样品进行植物总RNA提取。
1.5 单对引物的RT-PCR检测
参照cDNA合成试剂盒说明书合成cDNA,以cDNA为模板,分别利用SPFMV、SPCSV、SPVG、SPVC的特异性引物,PCR扩增反应体系25 μL:10×PCR Buffer 2.5 μL,rTaq 0.25 μL,dNTPs 2.5 μL,F/R引物各0.5 μL,模板2.5 μL,ddH2O 16.25 μL。PCR反应条件为:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃再延伸10 min;12 ℃保存。PCR反应结束后,1%琼脂糖凝胶电泳,凝胶成像系统检测并拍照。
1.6 多重RT-PCR检测体系优化与建立
在同一个反应体系中加入4对上述甘薯RNA病毒引物同时进行RT-PCR,对多重反应体系中的退火温度(54,55,56,57,58,59 ℃)、模板量(1.0,1.5,2.0,2.5,3.0,3.5 μL)、dNTPs量(2.0,2.5,3.0 μL)、引物浓度(2,5,10 μmol/L)、引物量(1∶1∶1∶1∶1、1∶1∶1∶2∶2、2∶2∶2∶1∶1)、循环次数(30×、35×、40×)、延伸时间(20,30,60 s)等因素进行优化试验。
1.7 灵敏度检测
将cDNA按照10倍浓度梯度稀释(100,10-1,10-2,10-3,10-4,10-5,10-6),以稀释后的cDNA分别为模板进行单对引物RT-PCR扩增和多重RT-PCR扩增,电泳、紫外检测并进行分析。
2 结果与分析
2.1 单对引物的RT-PCR检测
分别对4种病毒的特异性引物进行单对引物的RT-PCR验证,由图1可见,目的条带与设计片段大小相符,通过进一步的测序分析,均为所检测的目的片段,说明4个引物对的特异性较好。

M.DL2000 DNA Marker;1.SPFMV; 2.SPCSV;3.SPVG;4.SPVC; 5.阴性对照。 M.DL2000 DNA Marker;1.SPFMV;2.SPCSV;3.SPVG; 4.SPVC; 5.Negative control.
2.2 多重RT-PCR反应体系的优化
以混合cDNA样品为模板,分别对4种引物组合两两组合(图2),三三组合(图3)和四重组合(图4),由图2—4可见,任何2种引物对所扩增的目的条带都与所设计片段大小相符,且任意非配对引物均不能产生额外杂带,说明任意2种引物对之间都不能产生非特异性片段。

M.DL2000 DNA Marker;1.SPFMV/SPCSV;2.SPFMV/SPVG; 3.SPFMV/SPVC;4.SPCSV/SPVG;5.SPVG/SPVC;6.SPCSV/SPVC。
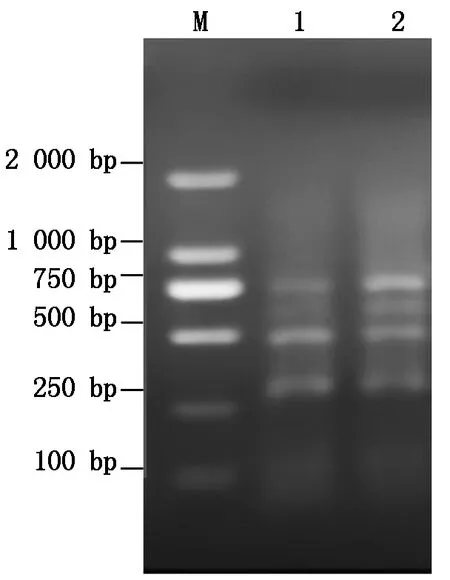
M.DL2000 DNA Marker;1—2.SPFMV/SPCSV/ SPVG/SPVC。图5同。 M.DL2000 DNA Marker; 1—2.SPFMV/SPCSV/ SPVG/SPVC.The same as Fig.5.
通过对这4对引物的dNTPs量(2.0,2.5,3.0 μL)、退火温度(54~59 ℃)、模板量(1.0,1.5,2.0,2.5,3.0,3.5 μL)、循环次数(30×、35×、40×)、延伸时间(20,30,60 s)等试验,确定了优化组合(图5),其最佳的反应组合及反应条件见表2—4。
将加好的样品管42 ℃孵育5 min后,立即加入10 μL Mix进行30 min 50 ℃孵育,85 ℃失活5 min,12 ℃保存合成20 μL cDNA。

图5 优化的四重RT-PCRFig.5 Reaction system of multiplex RT-PCR optimized

表2 cDNA合成的最佳反应体系(10 μL)Tab.2 The best reaction system for cDNA synthesis (10 μL)

表3 最佳的PCR反应组合Tab.3 The best combination of PCR reactions

表4 四重PCR的最佳反应条件Tab.4 Optimal reaction conditions for multiplex PCR
2.3 灵敏度检测
将cDNA模板按照10倍梯度依次稀释,再分别作为测试模板,在相同反应体系及反应条件下进行多重RT-PCR,结果表明,多重RT-PCR的cDNA稀释10倍后仍能检测到(图6)。

M.DL2000 DNA Marker; 1—7.100~10-6.
2.4 特异性检测
应用分别含有马铃薯Y病毒(PotatovirusY,PVY)的样品1、含有甘薯杆状病毒(SweetpotatobadnavirusB,SPBV-B)的样品2和甘薯RNA病毒与甘薯DNA病毒复合侵染的样品3(含有RNA病毒:SPFMV、SPCSV、SPVG、SPVC、甘薯潜隐病毒(Sweetpotatolatentvirus,SPLV)、DNA病毒(SPBV-B),对该多重RT-PCR体系进行特异性检测,由图7,8可见,该多重RT-PCR系统没有扩增出其他非特异性条带,说明其具有较强的特异性。

M.DL2000 DNA Marker;1.样品1阳性对照;2.样品1的多重 RT-PCR检测体系;3. 样品2阳性对照;4.样品2的多重检测体系。 M.DL2000 DNA Marker;1.Positive control of sample 1; 2.Multiple detection of sample 1;3.Positive control of sample 2;4.Multiple detection of sample 2.

M.DL2000 DNA Marker;1. SPFMV-F/SPFMV-R;2.SPCSV-F/SPCSV-R;3.SPVG-F/SPVG-R;4.SPVC-F/SPVC-R;5.SPBV-F/SPBV-R;6.SPLV-F/SPLV-R;7.多重RT-PCR检测体系。
2.5 挑战测试
应用本实验室前期检测含有混合病毒的甘薯样品对该多重RT-PCR系统进行挑战测试,其中样品1带有甘薯羽状斑驳病毒(SPFMV)、甘薯G病毒(SPVG);样品2为甘薯羽状斑驳病毒(SPFMV)、甘薯C病毒(SPVC)复合侵染;样品3为甘薯羽状斑驳病毒(SPFMV)、甘薯褪绿矮化病毒(SPCSV)、甘薯G病毒(SPVG)、甘薯C病毒(SPVC)复合侵染;样品4同时被甘薯羽状斑驳病毒(SPFMV)、甘薯G病毒(SPVG)、甘薯C病毒(SPVC)侵染。由图9,10可见,该多重RT-PCR系统与单对引物检测的结果一致,说明该系统用于这4种甘薯RNA病毒的检测是可行的。本研究建立了可用于甘薯RNA病毒(SPFMV、SPCSV、SPVG、SPVC)的多重RT-PCR检测体系。

M.DL2000 DNA Marker;1—4.分别为样品1的SPFMV、SPCSV、SPVG、SPVC单对引物检测;5.样品1的多重RT-PCR检测;6—9.分别为样品2的SPFMV、SPCSV、SPVG、SPVC单对引物检测; 10.样品2的多重RT-PCR检测。

M.DL2000 DNA Marker;1—4.分别为样品3的SPFMV、SPCSV、SPVG、SPVC单对引物检测;5.样品3的多重RT-PCR检测 ; 6—9.分别为样品4的SPFMV、SPVG、SPCSV、SPVC单对引物检测; 10.样品4的多重RT-PCR检测。
3 结论与讨论
甘薯是我国重要的粮食、饲料和工业原料作物,具有重要的粮食、经济地位。近年来,各种甘薯病毒病频繁暴发,使甘薯的产量和品质下降,目前,甘薯病毒病的防治只有依靠脱毒苗的单一方法[8],建立灵敏高效的病毒检测技术在脱毒甘薯苗培育和检测中起着至关重要的作用[9]。常用的病毒检测方法有目测法、指示植物法、电镜观察法、血清学检测法及分子生物学等方法,其中以PCR/RT-PCR的分子生物学方法进行病毒检测已成为目前甘薯病毒检测最常用和最主要的方法[10-14]。传统的单一RT-PCR方法每次只能检测一种病毒或一类病毒,对于复合侵染的甘薯病毒病,需要进行多次检测,多重RT-PCR检测技术可对多种病毒同时进行检测,具有同样具有特异性强、灵敏性高的特点,且能在较短时间内同时完成多种病毒的检测[15-17],大大提高了工作效率,其中引物设计是多重RT-PCR检测技术中最重要的一环[18],引物既要具有特异性,又要避免引物之间相互影响[19],研究认为在多重RT-PCR反应体系中,增加引物对的浓度可以得到理想的扩增效果[13],提高长片段引物的浓度、增加延伸时间也有利于多重RT-PCR扩增[20-24]。
基于此,本研究针对甘薯生产上为害严重的甘薯RNA病毒:引起甘薯病毒病(SPVD)的2种病毒甘薯羽状斑驳病毒(SPFMV)和甘薯褪绿矮化病毒(SPCSV),以及经常能够复合侵染的甘薯病毒G(SPVG)和甘薯病毒C(SPVC),成功建立了可以同时检测4种甘薯病毒的多重RT-PCR检测技术,并对影响多重PCR体系的因素进行了优化,获得了快速、准确、高效的多重RT-PCR检测技术,为脱毒甘薯种苗及田间甘薯RNA病毒的快速检测奠定了基础。
