岷江百合多聚半乳糖醛酸酶抑制蛋白基因及其启动子的克隆与分析
2022-09-14王瀚林李有玉王自娥陈晓华刘迪秋
邓 婕,王瀚林,李有玉,王自娥,陈晓华,刘迪秋
(昆明理工大学 生命科学与技术学院,云南 昆明 650500)
植物生存在特定的空间中,在生长的过程中常会面临低温、干旱、真菌、病毒等多种生物及非生物胁迫。病原真菌严重影响着植物的生长发育,它们会分泌果胶酶、纤维素酶、半纤维素酶等多种酶类,降解植物的细胞壁,以达到侵入植物体内的目的[1]。多聚半乳糖醛酸酶(Polygalacturonase,PGs)可切割多聚半乳糖醛酸(果胶的主要成分)中的D-半乳糖醛酸残基之间的α-(1-4)键,是病原真菌为消化植物细胞壁而分泌的重要酶类之一[2]。植物体内常合成多聚半乳糖醛酸酶抑制蛋白(Polygalacturonase-inhibiting proteins,PGIPs)识别结合PGs形成寡聚半乳糖醛酸,从而抑制PGs解聚果胶的活性[3]。PGIPs属于富含亮氨酸重复(Leucine-rich repeat,LRR)蛋白超家族,具有多个LRR结构域,在肽链的N端有引导PGIPs进行胞外分泌的疏水性信号肽以及N-糖基化位点[4]。贯叶连翘(Hypericumperforatum)PGIP具有4个LRR结构域,分别位于第100—125位,49—169位,149—173位和200—218位氨基酸[5]。甜菜(Betavulgaris)PGIP1具有11个LRR结构域,在N端有由25个氨基酸序列组成的信号肽,具有4个潜在的N-糖基化位点[6]。
PGIPs是植物重要的抗真菌蛋白,其在植物抵抗真菌侵害的过程中发挥着重要作用。水稻(Oryzasativa)接种细菌性条斑病菌(Xanthomonasoryzae)后,OsPGIP4的表达量显著上升,且过表达OsPGIP4的转基因水稻对细菌性条斑病菌的抗性显著增强。相反地,对OsPGIP4进行RNAi后的转基因水稻对细菌性条斑病菌的抗性减弱[7]。三七(Panaxnotoginseng)PGIP原核重组蛋白对根腐病菌茄腐镰刀菌(Fusariumsolani)、轮枝镰孢菌(F.verticillioides)等病原真菌的菌丝生长均具有抑制作用,且过表达PnPGIP转基因烟草对茄腐镰刀菌的抗性增强[8]。此外,PGIPs的表达可受多种植物激素、生物及非生物胁迫的诱导,如病原真菌、干旱、伤害胁迫、茉莉酸甲酯(Methyl jasmonate,MeJA)、水杨酸(Salicylic acid,SA)等。玉米(Zeamays)PGIP3的表达量在受到伤害胁迫、SA、MeJA诱导后明显上升[9]。烟草疫霉(Phytophthoranicotianae)、盐、伤害、SA、MeJA可显著诱导剑麻(Agavesisalana)PGIP1和PGIP2的表达[10]。立枯丝核菌(Rhizoctoniasolani)侵染水稻后诱导PGIP1/2/3/4的表达,这4个PGIP基因的表达水平分别在侵染48,6,48,96 h后到达最大值[11]。
百合(Lilium)是鲜切花市场的高端花卉,是具有较高经济价值的观赏植物。然而,百合属植物容易感染由尖孢镰刀菌(F.oxysporum)等镰刀属真菌引起的枯萎病。枯萎病严重影响着百合的产量和质量[12]。岷江百合(LiliumregaleWilson)是百合属植物中抗枯萎病性较强的野生种[13],研究岷江百合的抗病分子机理,对于改良百合属植物的抗病性具有重要意义。
本研究从岷江百合感染尖孢镰刀菌后的转录组测序数据中挖掘了一个可响应尖孢镰刀菌诱导的PGIP,并将其命名为LrPGIP[14],对LrPGIP的基因序列及其启动子序列(PLrPGIP)进行了克隆与分析,利用qRT-PCR对LrPGIP进行表达特性分析,构建PLrPGIP-GUS(β-葡萄糖苷酸酶)植物表达载体并转入烟草(Nicotianatabacum)中以分析启动子活性。
1 材料和方法
1.1 植物及真菌材料
岷江百合采自四川省汶川县,并栽种于昆明理工大学生命科学与技术学院的温室中。将野生型(Wild type,WT)烟草种子消毒后种于1/2 MS培养基,获得无菌苗用于遗传转化。尖孢镰刀菌由生物资源开发课题组从感病西伯利亚百合中分离、鉴定并保存。尖孢镰刀菌在使用前接种于土豆培养基(Potato dextrose agar,PDA)中,置于28 ℃培养箱培养7 d以活化菌种。
1.2 LrPGIP基因的克隆及生物信息学分析
根据前期研究中岷江百合转录组数据得到的LrPGIPUnigene序列,设计基因特异性引物扩增LrPGIPcDNA序列(表 1)。使用TRIGene总RNA提取试剂(GenStar,中国)提取尖孢镰刀菌接种后的岷江百合根部总RNA,并通过GoTaq qPCR Master Mix(Promega,美国)逆转录试剂盒合成cDNA。以cDNA为模板,通过PCR扩增LrPGIP的cDNA序列,PCR产物与pGEM-T载体(TaKaRa,日本)连接后,将重组载体pGEM-T-LrPGIP转入大肠杆菌DH5α感受态细胞中。通过菌液PCR筛选阳性克隆,并送北京擎科生物科技有限公司进行测序。
将测序结果与LrPGIPUnigene序列进行比对。使用NCBI ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)、NCBI CD-research(https://www.ncbi.nlm.nih.gov/)分别寻找开放阅读框及保守结构域。用NetNGlyc 1.0 Server(http://www.cbs.dtu.dk/cgi-bin/)网页查询蛋白质序列中潜在的N-糖基化位点。采用SignalP 5.1(http://www.cbs.dtu.dk/services/SignalP/)、Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)预测蛋白质的信号肽及亚细胞定位。在NCBI BlastP(https://blast.ncbi.nlm.nih.gov/)中查找与LrPGIP序列相似性较高的植物PGIP蛋白质序列,利用ClustalX 1.83进行多重序列比对,并采用MEGA 8.0构建系统进化树(最大似然法)。
1.3 qRT-PCR
研究LrPGIP在岷江百合各器官中的表达特性,分别从岷江百合的根、茎、叶、花和鳞片中提取总RNA,并逆转录为cDNA第1链。LrPGIP的qRT-PCR的特异性引物见表 1,以cDNA为模板进行qRT-PCR。选用岷江百合三磷酸甘油醛脱氢酶基因(Glyceraldehyde-3-phosphate dehydrogenase gene,GAPDH,基因登录号:JZ391059)作为内参基因。此外,还分析了尖孢镰刀菌侵染及信号分子乙烯利(Ethephon,ETH)、过氧化氢(Hydrogen peroxide,H2O2)、SA、MeJA处理对LrPGIP转录水平的影响。用无菌剪刀在岷江百合根部产生伤口后,将根部浸泡到尖孢镰刀菌孢子悬浮液(1.0×106spores/mL)、ETH(1 mmol/L)、H2O2(1 mmol/L)、SA(5 mmol/L)、MeJA(0.1 mmol/L)及无菌水(对照)中接种或处理30 min。然后用无菌水洗净根部,并将植株种植于装有无菌细沙的塑料盆中。分别在接种或处理后12,24,48,72 h收集根部,并提取总RNA逆转录成cDNA。qRT-PCR参考Zhao等[15]的方法进行,并用2-ΔΔCt的方法计算相对表达水平。qRT-PCR试验包含3个生物学重复,利用t测验对数据进行多重比较,分析统计学差异。
1.4 LrPGIP启动子的克隆及顺式作用元件分析
使用染色体步移技术克隆LrPGIP的启动子(PLrPGIP)。根据Genome Walking kit(TaKaRa,日本)试剂盒说明书,设计2条巢氏PCR引物(表 1)。使用CTAB法提取岷江百合的基因组DNA,分别用DraⅠ、EcoR V、PvuⅡ、StuⅠ限制性内切酶对基因组DNA进行消化,随后与接头相连构建4种DNA文库。以构建的DNA文库为模板进行巢式PCR扩增,并回收第2次PCR产物。通过T-A克隆将第2次PCR产物与pGEM-T载体相连,并转入大肠杆菌DH5α感受态细胞中。采用PCR筛选pGEM-T-PLrPGIP阳性大肠杆菌DH5α单克隆,并外送北京擎科生物科技有限公司测序。运用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)及NEW PLACE(https://www.dna.affrc.go.jp/PLACE/?action=newplace)预测PLrPGIP的顺式作用元件。
1.5 LrPGIP启动子转基因烟草的获得及启动子活性分析
设计带有Hind Ⅲ和BamH Ⅰ酶切位点的PLrPGIP特异性引物(表 1),从pGEM-T-PLrPGIP重组质粒中扩增出带有Hind Ⅲ和BamH Ⅰ酶切位点的PLrPGIP片段,经过Hind Ⅲ和BamH Ⅰ酶切后与pBI121-GUS载体相连。将pBI121-PLrPGIP-GUS重组质粒转入农杆菌LBA4404感受态细胞中。通过PCR挑选出阳性农杆菌克隆,接着采用叶盘转化法[16]将pBI121-PLrPGIP-GUS转入烟草中。提取再生烟草幼苗的基因组DNA,使用扩增PLrPGIP的特异性引物,通过PCR筛选阳性转基因烟草植株。
用几种激素及生物与非生物胁迫处理转基因烟草并测定GUS活性,以分析LrPGIP启动子活性。将阳性转基因烟草的叶盘分别浸泡于尖孢镰刀菌和交链格孢(Alternariaalternata)的孢子悬浮液(1.0×106spores/mL)、NaCl(100 mmol/L)、HgCl2(10 mmol/L)、SA(100 mmol/L)、MeJA(100 mmol/L)、ETH(100 mmol/L)溶液中处理2 h,并设置超纯水处理叶盘2 h为对照组。每个试验组和对照组分别设置3个重复。GUS活性的测定方法参照Chen等[17]的方法进行。其中,GUS的酶活力单位定义为1 min内每μg总蛋白催化产生4-MU的量(pmol/(min·μg))。采用最小显著性差异法进行统计学差异分析。
2 结果与分析
2.1 岷江百合PGIP编码蛋白质序列的分析
从岷江百合中克隆的LrPGIPcDNA长度为1 186 bp,包含一个长度为1 008 bp的ORF,编码一个含有335个氨基酸残基的蛋白质。LrPGIP编码的蛋白质具有7个LRR结构域,且具有4个潜在的N-糖基化位点,分别位于第23—26个,69—72个,204—207个,295—298个氨基酸处。在LrPGIP的N端有一段约为29个氨基酸残基的信号肽,亚细胞定位预测结果显示,LrPGIP可能定位于细胞壁,是胞外分泌蛋白。
2.2 LrPGIP多重序列比对以及聚类分析
BlastP分析表明,LrPGIP与油棕(Elaeisguineensis)、椰子(Cocosnucifera)、林烟草(N.sylvestris)的PGIP蛋白同源性分别为91%,94%,86%。蛋白质结构分析及多重序列比对结果显示,LrPGIP与油棕、椰子、林烟草均具有多个保守的LRR结构域(图 1)。选择19个植物PGIPs与LrPGIP进行聚类分析,结果如图 2所示,该系统进化树可分为2个大的分支(Ⅰ、Ⅱ),分支Ⅰ又可细分为2个小的分支(Ⅰa、Ⅰb),分别由双子叶植物的11个PGIPs以及单子叶植物的5个PGIPs组成。LrPGIP位于分支Ⅰb中,与单子叶植物海枣(Phoenixdactylifera)、粗柄象腿蕉(Enseteventricosum)、油棕、椰子PGIP聚集在小分支Ⅰb中,该节点置信度为88%,可信度较高。

A.LrPGIP蛋白质结构分析;B.LrPGIP与油棕、椰子、林烟草的多重序列比对。 A.The protein structure analysis of LrPGIP;B.The multiple alignment of LrPGIP,EgPGIP,CnPGIP and NsPGIP.

图2 LrPGIP的系统进化树Fig.2 Phylogenetic tree of LrPGIP
2.3 LrPGIP响应尖孢镰刀菌侵染以及4种信号分子处理
通过qRT-PCR分析LrPGIP的表达特性,结果见图 3,LrPGIP在岷江百合根中的表达量最高,相对而言在鳞片中的表达量最低,在根中的表达量是在鳞片中的表达量的10倍(图 3-A)。接种尖孢镰刀菌48 h后LrPGIP的表达量开始上升,至接种后72 h表达水平达到最高,是对照的5.3倍(图3-B)。ETH、H2O2、SA及MeJA 4种信号分子处理岷江百合均影响了LrPGIP在根中的表达量(图3-C)。其中,在ETH处理后12 hLrPGIP的表达量下降,随后表达量上升并在72 h达到较高的水平,约是对照的3倍。另外,H2O2、SA及MeJA处理后24 hLrPGIP的表达量先下降后上升,并在48 h表达量达到最大值,
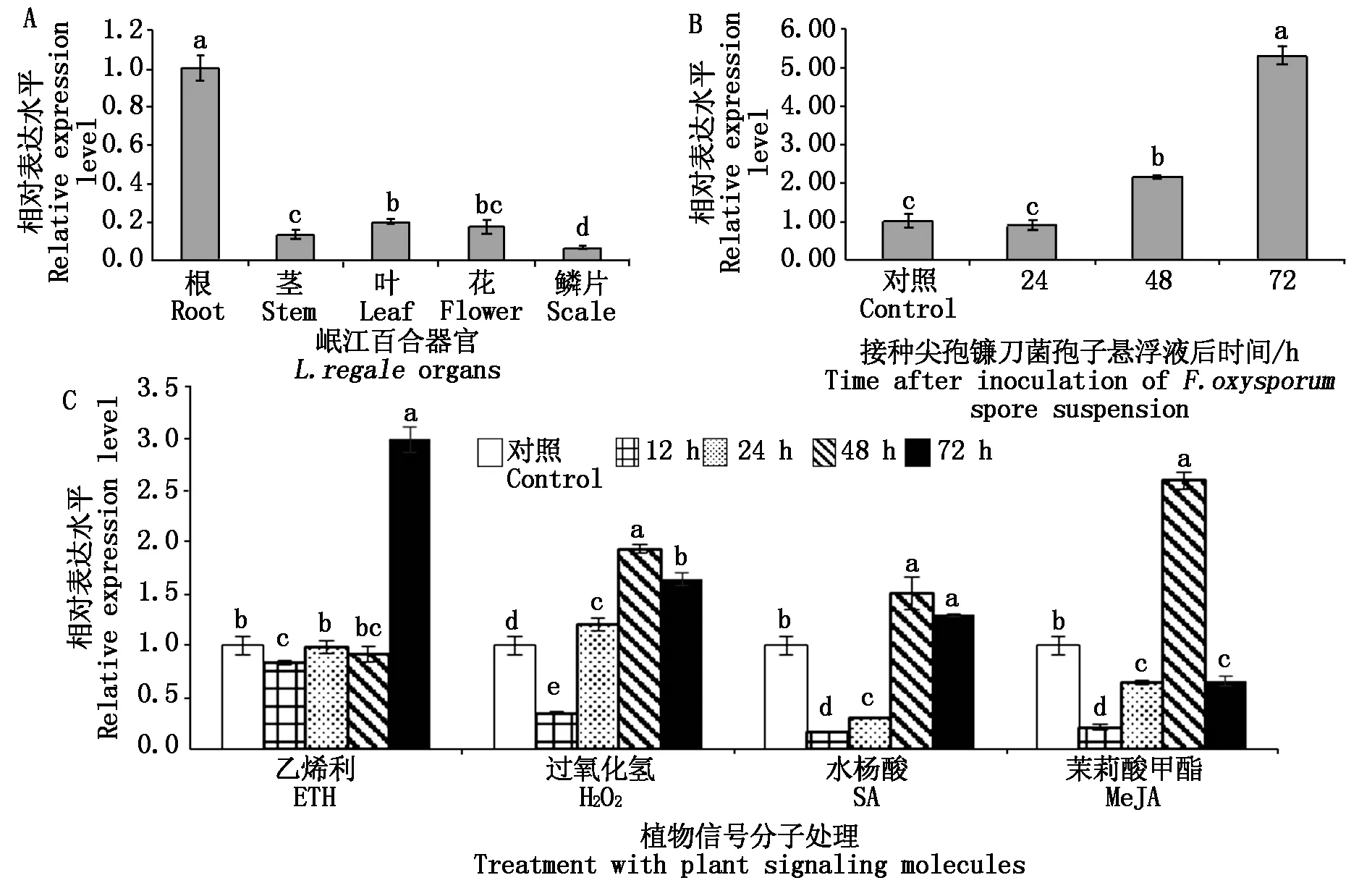
A.LrPGIP在岷江百合根、茎、叶、花、鳞片中的表达特性分析;B.LrPGIP在岷江百合接种尖孢镰刀菌后的表达特性分析;C.LrPGIP在岷江百合ETH、H2O2、SA、MeJA处理后的表达特性分析。图3-A、B中,不同的小写字母表示不同的样品之间差异显著(P<0.05),图4同。图3-C中,不同的小写字母表示在每种植物信号分子处理后不同时间段的样品之间差异显著(P<0.05)。
分别为对照的2.0,1.7,2.7倍。这些结果表明,尖孢镰刀菌侵染及4种信号分子(ETH、H2O2、SA、MeJA)处理能明显诱导LrPGIP的表达水平。
2.4 LrPGIP启动子区具有多个顺式作用元件
通过染色体步移技术,从岷江百合的基因组DNA中克隆出了706 bp的LrPGIP启动子片段(PLrPGIP)。生物信息学分析表明,PLrPGIP序列中存在多种顺式作用元件(表2),如MRE(光调控元件)、TCA-element(水杨酸响应元件)、TGACG-motif(茉莉酸甲酯响应元件)、MYC binding site(MYC结合位点、冷胁迫响应元件)等。

表2 LrPGIP启动子序列中的顺式作用元件预测结果Tab.2 Prediction results of cis-acting elements in LrPGIP promoter sequence
2.5 LrPGIP启动子活性受几种植物激素、生物及非生物胁迫诱导
为了进一步分析PLrPGIP的活性,构建了pBI121-PLrPGIP-GUS融合表达载体,并转入烟草中表达。在HgCl2胁迫处理后,3株pBI121-PLrPGIP-GUS(pPT1/2/3)转基因烟草叶盘中的GUS活性上调的幅度最大(图4-A),是对照的2.1倍。在NaCl处理后,平均GUS活性上升为对照的1.7倍。另外,在接种尖孢镰刀菌和交链格孢后,GUS活性也明显上升(图 4-B),与对照相比,平均值分别增加了0.60,0.86倍。在SA、MeJA及ETH处理后,GUS的活性亦显著上升(图4-C)。其中,在ETH处理后,与对照相比,GUS的活性上升最为显著,平均值为对照的1.67倍。在SA、MeJA处理后,GUS活性分别

pPT1、pPT2、pPT3.3株阳性转基因烟草单株。 pPT1,pPT2,pPT3.Three individuals of positive transgenic tobacco seedlings.
提高为对照的1.4,1.6倍。上述结果表明,LrPGIP启动子驱动的GUS基因响应几种植物激素、生物及非生物胁迫的处理,显然PLrPGIP的活性受上述几种激素、生物及非生物胁迫调控。
3 讨论
PGIPs在植物抵御真菌侵染的过程中具有重要的作用,其蛋白质序列最主要的特征在于有多个LRR结构域以及N端有信号肽和潜在的N-糖基化位点[4]。水稻的7个PGIPs均具有典型的PGIP特征,但系统进化树分析表明,除OsPGIP2/4/6/7相似度较高被归于同一分支外,其余OsPGIPs被聚类到不同的分支中[18]。LrPGIP的蛋白质序列也具有典型的PGIPs结构特征,且聚类分析中LrPGIP与粗柄象腿蕉、油棕、椰子聚集到同一个小的分支上,亲缘关系更近,表明这几个PGIPs在进化过程中可能来源于同一个基因。
PGIPs在植物的各个部位中均有表达,但表达量有所区别。四季豆(Phaseolusvulgaris)PvPGIP1在幼叶、根中不表达,但PvPGIP3和PvPGIP4在根中有微量的表达,而PvPGIP2在所有的组织中均有表达[19-20]。LrPGIP在岷江百合的根、茎、叶、花和鳞片中均有表达,在根中的表达量最高,在鳞片中的表达量最低。根部作为植物吸收水分及无机盐的主要器官,其生理状态直接影响植物的生长发育[21]。尖孢镰刀菌主要从肉质根部或鳞茎基部的伤口侵入百合体内,导致枯萎病的发生[22]。PGIPs的表达有利于抑制病原真菌PGs降解果胶的活性,从而抵御病原真菌的入侵[2]。LrPGIP在岷江百合根部的表达量最高,可能是岷江百合为抵抗尖孢镰刀菌侵染的抗性机制之一。
一些PGIPs的表达受多种植物激素、生物及非生物胁迫的诱导。玉米ZmPGIP3的表达量在立枯丝核菌的侵染后显著上调;在SA、MeJA处理后,ZmPGIP3的表达量也明显上升[9]。相似地,陆地棉(Gossypiumhirsutum)GhPGIP1在接种大丽轮枝菌(Verticilliumdahliae)后,表达水平明显增加,同时,MeJA、SA、H2O2处理也诱导了GhPGIP3的表达量[23]。SA和JA信号途径是植物防卫反应的重要信号途径[24]。植物在受到病原菌侵染后,SA和JA的合成上调,SA的积累会引发病程相关蛋白(Pathogenesis-related proteins,PRs)的表达,如PR-1、PR-2、PR-4等[25]。PR蛋白在体外具有直接的抑菌活性,在植物抗病原真菌侵染的过程中具有重要作用[26]。JA可通过激活转录因子的表达,调节下游抗性相关基因的表达,从而增强对病原真菌的抗性[27]。岷江百合的2个抗病防卫反应正调控因子WRKY1、WRKY2,不仅响应JA信号,二者还能激活抗病基因LrPR10-5和LrCHI2的表达[14,28]。本研究中,岷江百合LrPGIP在尖孢镰刀菌接种以及SA、MeJA处理后,表达量均发生了一定程度的上调。此外,LrPGIP启动子的活性可被SA、MeJA、尖孢镰刀菌所诱导。这些结果表明,LrPGIP通过SA和JA信号途径参与岷江百合抗尖孢镰刀菌侵染的防卫反应。
综上所述,LrPGIP作为典型的LRR蛋白,在岷江百合的根、鳞片、叶、茎和花中均有表达,且在根中的表达量最高。LrPGIP的表达受枯萎病菌尖孢镰刀菌及几种胁迫反应相关信号分子的诱导,LrPGIP启动子的活性也受尖孢镰刀菌、交链格孢、NaCl、HgCl2、SA、MeJA、ETH的调控。LrPGIP在岷江百合在抗尖孢镰刀菌侵染的防卫反应中的功能值得进一步研究,同时JA和SA信号途径对LrPGIP的调控机制也有待深入分析。
