肥胖降低乙型肝炎患者干扰素治疗敏感性的机制研究*
2022-09-13张炳杨逯素梅马万山
张炳杨,逯素梅,马万山,3△
1.山东大学,山东济南 250010;2.山东省千佛山医院检验科,山东济南 250014;3.山东第一医科大学第一附属医院检验科,山东济南 250014
乙型肝炎(以下简称乙肝)流行范围广,严重危害国人健康。在发展中国家,乙型肝炎病毒(HBV)被认为是导致肝硬化的主要原因[1]。采用干扰素(IFN)治疗乙肝方法经典,但是治疗效果个体差异大[2]。临床工作中发现,肥胖体质的乙肝患者对IFN治疗敏感性下降,深入研究其原因及机制意义重大。研究表明,肥胖体质加剧了乙肝肝硬化的进展[3-4]。肝脏常驻细胞(如库普弗细胞等)和因损伤而被招募的细胞(如单核-巨噬细胞)都会发出促炎症信号,包括(但不限于)细胞因子、趋化因子、脂质信使和活性氧,可促使肝细胞的凋亡或坏死[5-7]。同时,垂死的肝细胞释放出损伤相关的分子模式,与进化保守的模式识别受体结合后,激活先天免疫系统细胞,进一步刺激炎症反应,建立一个高度肝脏毒性的炎症和细胞死亡的前馈循环[8-9]。乙型肝炎病毒蛋白X(HBX)是HBV的一种调节蛋白,它激活Stat1,导致产生Ⅰ型IFN,表达HBX的肝细胞分泌的Ⅰ型IFN通过与同源的Ⅰ型IFN受体结合增强抗病毒信号[10-11]。慢性炎症是肥胖患者体内的状态,白细胞介素(IL)、肿瘤坏死因子(TNF)、IFN等是最常见的炎症因子[12-13]。本研究旨在探讨肥胖导致乙肝患者IFN治疗敏感性下降的机制与炎症细胞因子的关系,为乙肝患者的个体化治疗提供理论依据。
1 资料与方法
1.1一般资料 选取2017-2021年在山东省千佛山医院诊治的HBV感染且行IFN治疗的患者91例为研究对象,其中男62例,女29例。根据体质量指数(BMI)将其分为对照组(BMI≤25 kg/m2,61例)和肥胖组(BMI≥28 kg/m2,30例),跟踪IFN治疗48周,检测谷氨酸氨基转移酶(ALT)和乙肝表面抗原(HBsAg)变化。收集该院健康查体人群(无基础疾病,25人)血浆,根据BMI指数分为A组(BMI≤25 kg/m2)15人,B组(BMI≥28 kg/m2)10人,行流式细胞术检测细胞因子,筛选靶点。
乙肝患者纳入标准:(1)于该院就诊的确诊为HBV感染的成年门诊和住院患者;(2)无重大遗传性疾病家族史,未见同时患有其他感染性疾病或自身免疫性肝炎等。(3)治疗期间无饮酒、输血、怀孕、血色病等的发生。
1.2方法
1.2.1流式细胞术检测炎症细胞因子 仪器为BD FACS CantoTMⅡ型,试剂盒为青岛瑞斯凯尔生物科技有限公司生产的8种细胞因子检测试剂盒(多重微球流式免疫荧光发光法)。主要包括IL-2、IL-4、IL-6、IL-10、IL-12p70、IL-17、TNF-α、IFN-γ。具体操作及分析步骤参照试剂盒说明书进行。
1.2.2细胞培养 培养稳定转染人HBV基因组的HepG 2.2.15细胞,培养液为10%胎牛血清-DMEM,添加2 mmol/L谷氨酰胺,100 IU/mL青链霉素。接种24 h后按分组分别加入IFNα2b(500 IU/mL),IL-2、IL-6、IL-10、IL-17(10 ng/mL)单独及联合作用于细胞3 d,更新培养基及对应药物后继续作用3 d,收集细胞或上清液,用于后续实验。
1.2.3蛋白质印迹法(Western-blot)检测 借助RIPA细胞裂解液提取蛋白质,Bradford法对蛋白进行定量,以β-actin为内参照基因,检测JAK1、p-JAK1、STAT1、p-STAT1、STAT2、p-STAT2的蛋白表达水平,抗体均来自Cell Signaling Technology公司,使用浓度为1∶1 000。二抗为中杉金桥的HRP标记的羊抗兔二抗。
1.2.4实时荧光定量PCR(qPCR) 采用Trizol法提取细胞总RNA,借助Nanodrop 2000检测RNA的浓度和纯度,基于cDNA合成试剂盒(thermo scientific,货号k1622)进行反转录,进一步借助SYRB(applied biosystems,货号A25742)进行PCR扩增。扩增程序为: 50 ℃ 2 min,95 ℃ 10 min,95 ℃ 10 s,60 ℃ 1 min,40个循环。IFITM1上游引物为5′-CCAAGGTCCACCGTGATTAAC-3′,下游引物为5′-ACCAGTTCAAGAAGAGGGTGTT-3′;MX1上游引物为5′-GTTTCCGAAGTGGACATCGCA-3′,下游引物为5′-CTGCACAGGTTGTTCTCAGC-3′;OAS1上游引物为5′-TGTCCAAGGTGGTAAAGGGTG-3′,下游引物为5′-CCGGCGATTTAACTGATCCTG-3′;PKR上游引物为5′-GCCGCTAAACTTGCATATCTTCA-3′,下游引物为5′-TCACACGTAGTAGCAAAAGAACC-3′。
1.2.5生化及免疫指标检测 ALT、天门冬氨酸氨基转移酶(AST)均使用罗氏诊断公司生化分析仪及试剂盒分别通过比色法测定;HBsAg、乙型肝炎e抗原(HBeAg)使用希森美康HBsAg/HBeAg定量系统通过电化学发光法检测。
1.2.6HBV-DNA检测 通过罗氏Cobas AmpliPrep/cobas TaqMan48病毒载量检测系统,使用罗氏HBV核酸检测试剂盒检测,跟随检测质控,质控合格。
1.3观察指标
1.3.1RevMan软件分析 综合检索国内外文献,将肥胖设为唯一影响因素,基于筛选出的文献提取数据,将数据分为乙肝治疗有效组与乙肝治疗无效组。采用RevMan软件分析肥胖与乙肝治疗的关系。
1.3.2IFN治疗 临床患者跟踪IFN治疗48周,统计其治疗终点时的ALT、HBsAg等指标差异,并绘制散点图对其进行分析,同时分析BMI与上述指标的相关性,观察肥胖对临床IFN治疗的效果影响。
1.3.3流式细胞术 借助流式细胞术检测A组与B组主要差异的细胞因子,作为体外实验的切入点。
1.3.4体外细胞培养 收集上清液,采用化学发光法检测HBsAg、HbeAg水平,磁珠法检测HBV-DNA。观察不同药物作用下,3种指标变化趋势,探索药物对HepG 2.2.15细胞系表观的影响。
1.3.5JAK-STAT信号通路和抗病毒蛋白检测 收细胞蛋白及RNA,Western-blot实验检测JAK1、p-JAK1、STAT1、p-STAT1、STAT2、p-STAT2抗体;qPCR实验检测抗病毒蛋白引物IFITM1、MX1、OAS1、PKR水平。

2 结 果
2.1RevMan软件结果 结果显示,乙肝治疗有效组和乙肝治疗无效组优势比为3.85(95%CI2.36~6.27),提示肥胖是乙肝治疗有效的不利因素。
2.2两组ALT、HBsAg水平比较 对照组ALT水平为(43.54±20.37)U/mL,肥胖组ALT水平为(60.63±32.85)U/mL,差异有统计学意义(P<0.05)。对照组HBsAg水平为(2 977.90±1 412.57)IU/mL,肥胖组HBsAg水平为(3 024.43±1 586.76)IU/mL,差异有统计学意义(P<0.05)。见图1。
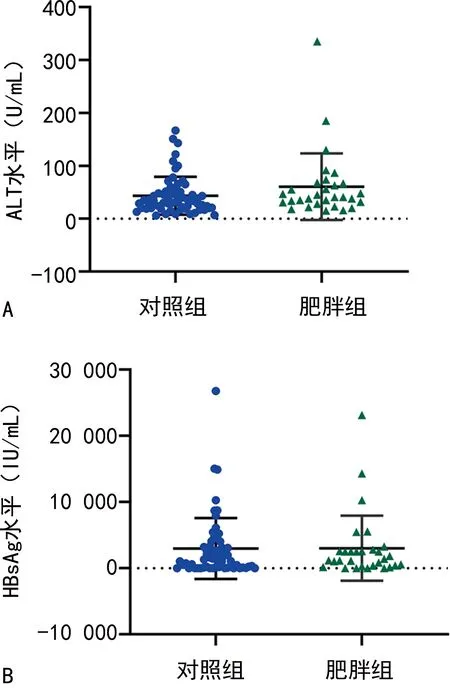
注:A为两组ALT水平均值散点图。B为两组HBsAg水平均值散点图。
2.3各组不同条件下各项指标水平比较 流式细胞术检测结果发现,IL-4、IL-12p70、TNF-α、IFN-γ水平在A组和B组中比较,差异无统计学意义(P>0.05),而IL-2、IL-6、IL-10、IL-17水平在B组中明显升高(P<0.05),有参考意义,作为研究切入点进行后续实验。见图2A。
分别以IL-2、IL-6、IL-10、IL-17作用于体外培养的人HepG2.2.15细胞后,检测结果发现上述4种IL单独作用均能够下调HbsAg水平,尤其是IL-2、IL-17下调作用明显(P<0.05),但是IL和IFN联合作用未见明显变化(P>0.05);HbeAg、HBV-DNA水平较对照组均无明显变化(P>0.05)。见图2B。
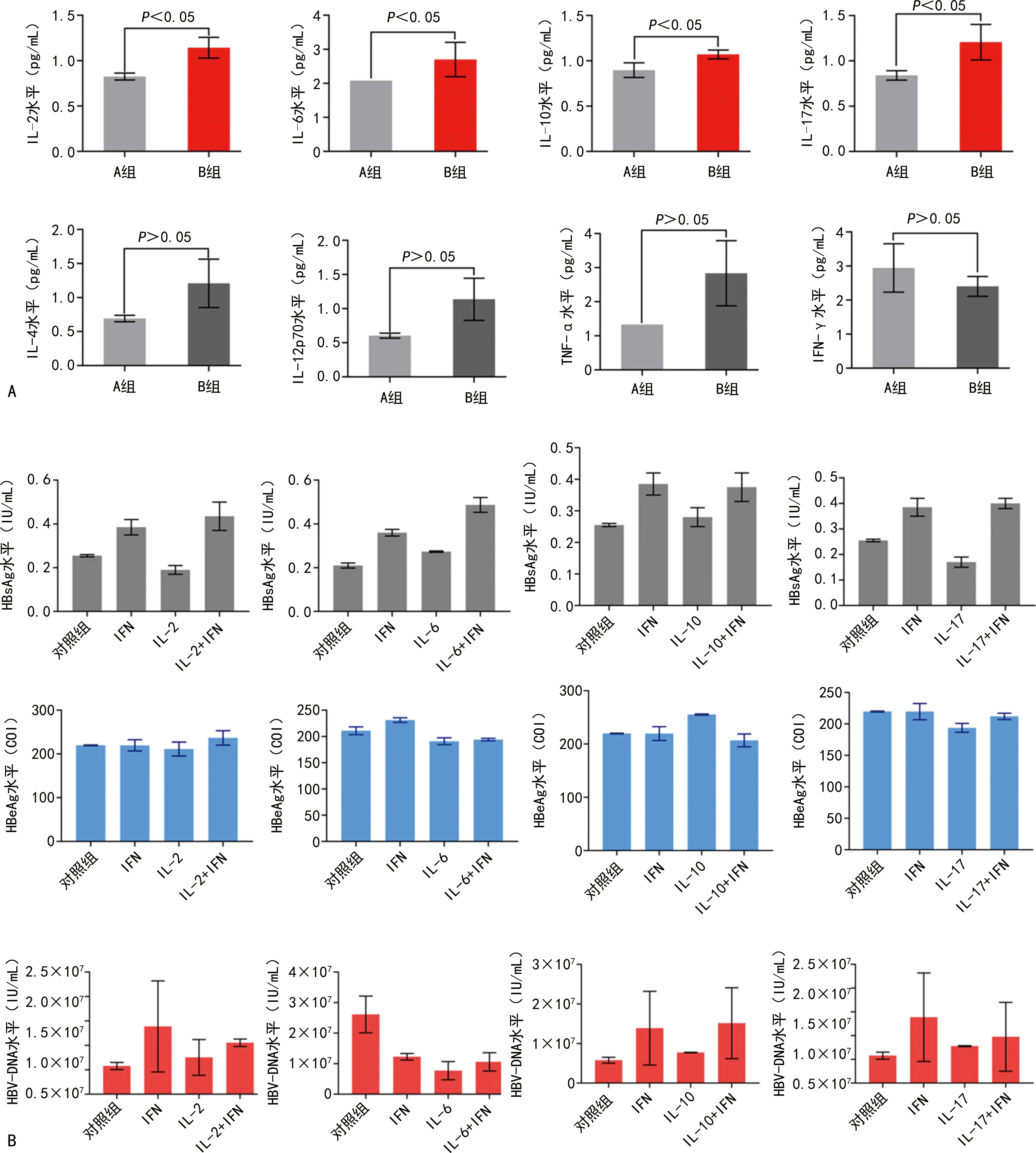
注:A为A组、B组各项指标水平比较;B为IL-2、IL-6、IL-10、IL-17对HepG2.2.15细胞分泌的HBsAg、HBeAg和HBV-DNA水平的影响。
2.4IL在IFNα2b作用下对JAK-STAT信号通路的影响 IL-2、IL-6、IL-10和IL-17均激活了JAK-STAT信号通路,使JAK1、STAT1、STAT2发生不同程度的磷酸化。其中IL-6、IL-10降低JAK1-STAT磷酸化的程度尤其明显。见图3。
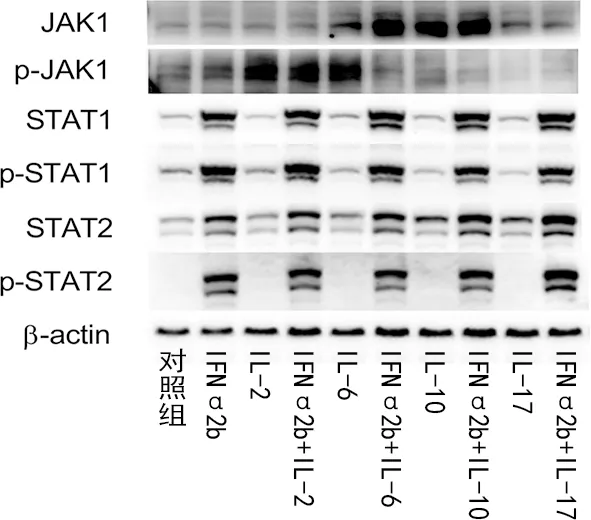
图3 IL在IFNα2b作用下对JAK-STAT信号通路的影响
2.5IL促进抗病毒蛋白IFITM1、MX1、OAS1、PKR的表达 qPCR检测结果发现,IFN单独作用下,抗病毒蛋白IFITM1、MX1、OAS1、PKR水平升高,与IL共同作用下上述指标水平升高更加明显(P<0.05)。见图4。

图4 IL促进抗病毒蛋白IFITM1、 MX1、 OAS1、PKR的表达
3 讨 论
本研究追踪临床乙肝患者IFN治疗48周后主要指标变化,并结合临床,通过查阅、分析文献等方式,发现肥胖是影响乙肝患者治疗效果的因素之一,肥胖导致乙肝患者IFN治疗敏感性下降。通过流式细胞术筛查BMI≥28 kg/m2与BMI≤25 kg/m2个体之间的炎症细胞因子差异,以有统计学意义的IL-2、IL-6、IL-10、IL-17水平为切入点,作用于体外培养的肝HepG 2.2.15细胞,发现4种IL能够激活JAK-STAT信号通路,促进抗病毒蛋白表达。因此,肥胖抑制IFN抗乙肝治疗的效果不是与炎症因子水平升高直接相关。推测炎症与免疫的相互作用是主要分子机制,也是课题组下一步研究的重心。
本研究Western-blot结果验证了JAK-STAT信号通路的激活,这与已有研究一致[14-15]。急性期蛋白IL-6最近被认为在肝癌发生中发挥了突出作用,激活caspase-8形成“坏死体”,诱导肝细胞坏死的发生[16-17]。有研究表明,IL-10/HBV-DNA被认为是预测IFN-α治疗反应谱的有用指标[18]。血清IL-10水平可能反映了宿主免疫激活的情况[19-21]。在本研究中,笔者以IL-2、IL-6、IL-10、IL-17这些炎症因子为切入点,发现肥胖体质导致上述指标水平升高,促进IFN抗病毒。但是本研究是体外细胞培养实验,脱离了体内免疫系统,不排除IL影响机体免疫系统调控IFN抗病毒过程。
本研究采用了多种数据分析方式和研究手段,探索回顾IFN治疗乙肝的分子生物学机制,通过临床试验与基础研究相结合,综合流式细胞术与细胞培养等实验技术,实验结果较为丰富。但是数据分析过程中,细胞上清液检测数据不甚理想,考虑与药物作用时间过短有关。单纯体外细胞实验的结果提示IL促进IFN抗病毒,分析其原因与炎症和免疫系统错综复杂的关系密切相关,独立因素下的研究不能反映机体实际情况。通过体内实验,聚焦炎症和免疫系统相互作用,寻找肥胖抑制IFN抗乙肝治疗的机制是下一步的重点方向。
综上所述,肥胖降低了乙肝患者IFN治疗的敏感性,并导致体内IL-2、IL-6、IL-10及IL-17水平不同程度升高。单纯的IL具有抗炎作用,促进IFN抗乙肝。但是在免疫系统共存的个体内,推测肥胖致IFN治疗敏感性下降与炎症和免疫系统的复杂关系有关,课题组将继续深入研究。
