妊娠晚期B族链球菌感染状况及产时抗生素预防应用对妊娠结局的影响
2022-09-13陶梦佳秦梦路王佳洁
陶梦佳,秦梦路,王佳洁
(同济大学附属第一妇婴保健院产科,上海 201204)
B族链球菌(group B streptococcus,GBS)是一种寄生于人体下消化道及泌尿生殖道的革兰氏阳性菌。临床发现,GBS会沿生殖道或产道传染给胎儿,增加母儿不良结局[1]。由于GBS感染具有短暂、间歇的特点,多数孕中期GBS培养呈阴性的孕妇在孕晚期或产时也会出现GBS感染。因此相关指南建议所有孕晚期(孕周35~37周)的孕妇需入院进行GBS筛查[2]。既往流行病学调查[3]显示,不同地区、国家的孕妇GBS感染率存在差异,我国妊娠期女性GBS感染率为8.33%~11.80%。抗生素是治疗GBS感染的有效手段,但关于产时预防性使用抗生素对妊娠结局的影响尚存争议。一些学者[4]认为,抗生素可以改善妊娠结局;但部分研究[5]发现,抗生素并没有降低母儿感染几率。因此,了解妊娠晚期孕妇GBS感染状况及产时预防性使用抗生素对妊娠结局的影响对临床推广GBS筛查及预防性治疗具有重要意义。本研究旨在探究妊娠晚期GBS感染状况及产时抗生素预防应用对妊娠结局的影响。
1 资料与方法
1.1 一般资料
选取2021年1月至2021年6月于同济大学附属第一妇婴保健院1 502名定期产检并住院分娩的孕妇为研究对象。其中,孕妇年龄23~34岁,平均(31.48±2.06)岁;文化程度:本科以下387例,本科804名,本科以上311名;产次:初产妇933名,经产妇569名;流产次数:≤1次844名,≥2次658名;合并妊娠期糖尿病246例;患有阴道炎127例。根据妊娠35~37周GBS检测结果,将研究对象分为GBS阳性组(n=150)和GBS阴性组(n=1352)。纳入标准:(1)年龄≥20岁;(2)孕周>35周且为单胎;(3)GBS检测前4周内未发生性生活;(4)近期无抗菌药物治疗史。排除标准:(1)伴有慢性感染;(2)合并有严重妊娠期合并症;(3)患有恶性肿瘤。
1.2 方法
1.2.1 GBS采样及检测 所有孕妇均在孕晚期35~37周进行GBS检测。标本采集:孕妇取仰卧截石位,首先清除外阴处的分泌物,然后将无菌棉拭子伸入阴道1/3处旋转1周采集阴道标本;另取一根新的棉拭子置入肛门括约肌约2~5 cm处旋转1周采集直肠标本。将采集的标本送入检验科进行GBS培养,如果18~24 h内培养基中出现可疑菌落则判断为阳性,如果培养48 h仍无菌落生长,则判断为阴性。
1.2.2 用药 GBS阳性孕妇发生规律宫缩或胎膜早破后立即预防性给予哌拉西林钠他唑巴坦钠(邦达)或头孢类抗生素静脉滴注至分娩结束。
1.3 观察指标
(1)一般资料:包括年龄、文化程度、产次、流产次数、妊娠期糖尿病及阴道炎情况;(2)多因素Logistic回归分析;(3)妊娠结局:包括胎膜早破、早产、羊水污染、产时发热、宫内感染、产后出血、产褥期感染等;(4)新生儿结局:包括胎儿窘迫、新生儿窒息、新生儿黄疸、新生儿感染等。
1.4 统计学分析
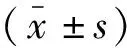
2 结果
2.1 两组孕妇一般资料比较
两组孕妇年龄、产次、流产次数比较,差异无统计学意义(P>0.05);文化程度、妊娠期糖尿病及阴道炎情况比较,差异有统计学意义(P<0.05)。见表1。
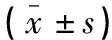
表1 两组一般资料比较
2.2 多因素Logistic回归分析
以单因素分析中有统计学意义的因素为自变量,GBS阳性为因变量。回归分析结果显示,文化程度、阴道炎是GBS感染的独立因素(P<0.05);妊娠期糖尿病不是GBS感染的独立因素(P>0.05)。见表2。
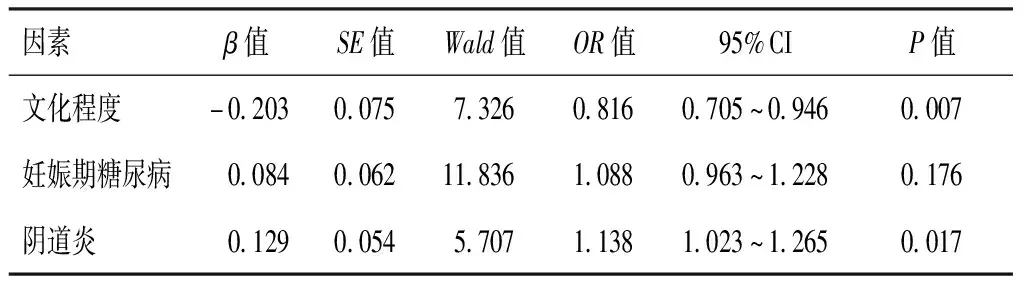
表2 多因素Logistic回归分析
2.3 两组孕妇孕妇妊娠结局比较
两组孕妇早产、羊水污染、产时发热、产后出血及产褥期感染发生率比较,差异无统计学意义(P>0.05);GBS阳性组孕妇胎膜早破、宫内感染发生率高于GBS阴性组(P<0.05)。见表3。
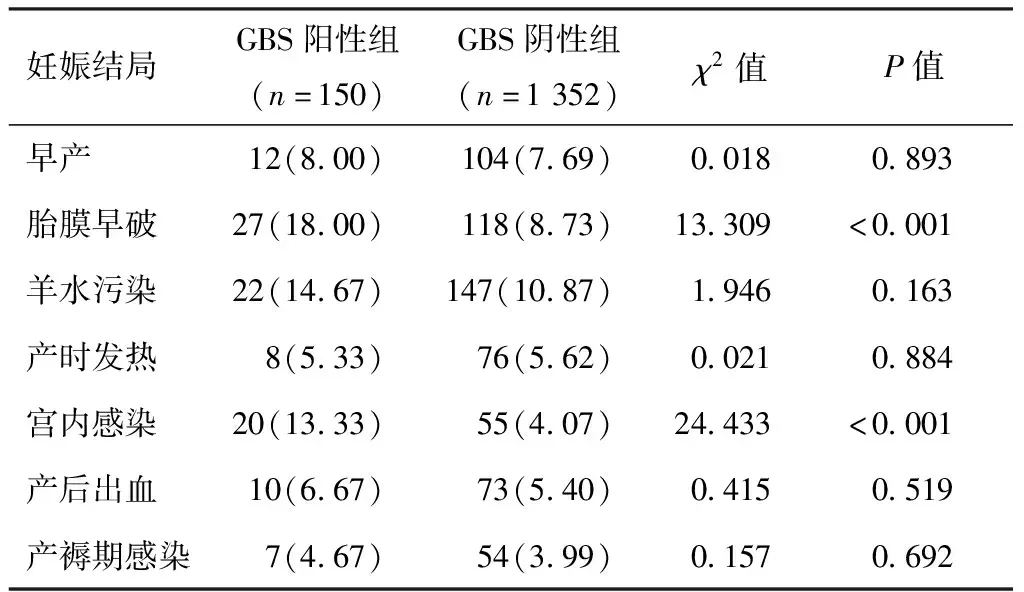
表3 两组孕妇妊娠结局比较[n(%)]
2.4 两组新生儿结局比较
两组胎儿窘迫、新生儿窒息、新生儿黄疸发生率比较,差异无统计学意义(P>0.05);GBS阳性组新生儿感染率高于GBS阴性组(P<0.05)。见表4。
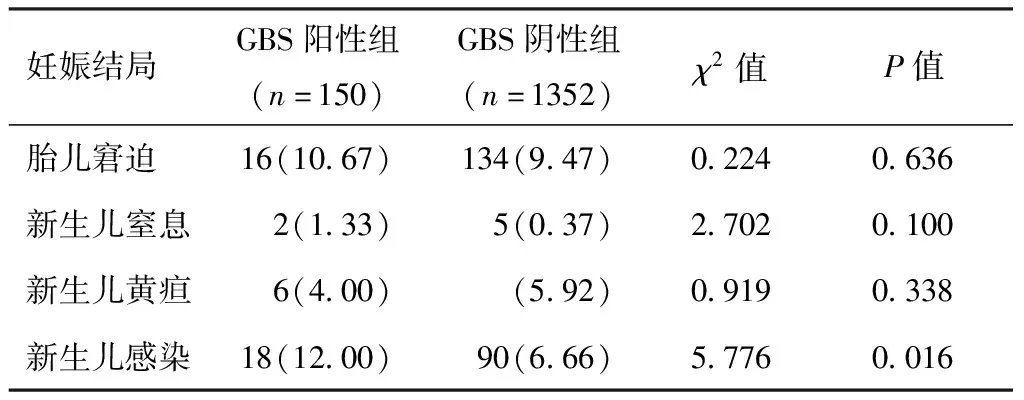
表4 两组新生儿结局比较[n(%)]
3 讨论
本研究显示,妊娠晚期孕妇GBS感染率为9.99%,与我国其他地区的调查结果相当。GBS属于一种毒力较强的条件性致病菌,由于妊娠晚期孕妇阴道黏膜屏障功能降低、阴道内糖原浓度增加、阴道水肿等原因,GBS易定植于该孕周内的孕妇生殖道内[6]。本研究发现,文化程度、妊娠期糖尿病、阴道炎与GBS感染相关(P<0.05);进一步回归分析显示,文化程度、阴道炎是影响GBS感染的独立因素(P<0.05),孕妇文化程度越低则GBS感染风险越高,患有阴道炎的孕妇GBS感染风险明显升高。小肠是细菌的主要寄生地,因阴道靠近小肠,故阴道内的细菌会沿肠道进入阴道,但GBS等细菌定植于阴道需要突破天然的物理屏障、消灭其他优势菌[7]。文化程度高的孕妇对更加注重个人卫生,经常清洁阴道可减少GBS的定植;而合并有阴道炎的孕妇因阴道内环境发生紊乱,各种微生物大量滋生繁殖,从而增加了GBS定植的几率。
既往研究[8-9]发现,GBS阳性菌株对万古霉素、青霉素、利奈唑胺、头孢类抗生素较为敏感。本研究结合医院实际情况主要给予哌拉西林钠他唑巴坦钠(邦达)或头孢类抗生素预防性治疗GBS,结果显示,两组孕妇早产、羊水污染、产时发热、产后出血、产褥期感染及胎儿窘迫、新生儿窒息、新生儿黄疸等发生率比较差异无统计学意义(P>0.05),提示产时预防性使用抗生素可降低GBS阳性孕妇早产、产褥期感染及胎儿窘迫、新生儿黄疸等发生率。既往大量研究[10-11]均显示,GBS是孕妇宫内感染、产褥期感染的主要致病菌,GBS感染会增加早产、胎膜早破、产后出血及母儿感染风险,这是因为GBS带有夹膜外壳,具有较强的吸附及穿透能力,其可沿生殖道侵袭至胎膜,导致胎膜张力下降,从而引起早产;GBS从破裂的胎膜上行至宫腔,继而引起宫内感染。此外,GBS大量繁殖的同时并释放毒素,从而造成孕妇产褥期感染[12-13]。另有文献[14]显示,GBS不仅会在母婴之间发生垂直感染,还会破坏胎儿的正常生存环境,造成新生儿发育不良、产生病理性黄疸、败血症等。可见,孕妇GBS感染会给母儿带来诸多不良影响。欧美地区发现,在GBS阳性孕妇产生给予抗生素预防性治疗,可有效改善母儿不良预后,并且出台了相关预指南[15]。GBS菌株对氨苄西林、青霉素、头孢类有较高的敏感性,一般临床推荐青霉素作为GBS阳性孕妇产生抗生素用药的首选,如果过敏则选择头孢类药物。本研究中,GBS阳性组胎膜早破、宫内感染、新生儿感染发生依然高于GBS阴性组,提示产生抗生素的应用并没有杜绝GBS对母儿造成的影响,可能与GBS耐药有关。因此,解决孕妇GBS感染的最佳方法是接种GBS疫苗,从根本上减少GBS定植,并通过胎盘将GBS抗体输送给胎儿,使胎儿产生免疫力[16]。随着我国老龄化的加剧及生育率的降低,临床应该强加妊娠晚期孕妇GSB筛查工作,尤其是重点高危人群,同时采用有效手段积极控制GBS感染,以确保母儿安全。
综上所述,我国妊娠晚期孕妇GBS感染形式依然严峻,文化程度、阴道炎是GBS感染的独立危险因素,产时预防性使用抗生素可改善妊娠不良结局;但无法完全消除GBS感染带来的不良影响,国家应加强GBS抗体的研发,让更多的孕妇及新生儿受益。
