损伤-修复模型在药物作用癌细胞上的应用
2022-09-09苏晓静耿金鹏曹天光蔡世娟
苏晓静,耿金鹏,曹天光,蔡世娟
(河北工业大学 生物物理研究所,天津 300401)
0 引言
癌症作为威胁人类生命健康的重要因素,其发病率在近年来呈现不断上升的趋势[1-2]。就癌症治疗手段而言,虽然现代医疗科技发展迅速,但对于癌症的治愈率仍然无法达到理想水平[3],因此,对癌症的深入研究就显得尤为重要。癌症治疗手段主要有手术治疗、放射治疗、药物治疗等。近年来,人们对于药物治疗癌症的研究呈现出很大热情,期望能够找出更好的抗癌物质用于治疗癌症。目前,抗癌药物的研究已经取得很大的进展,特别是在抗癌药物筛选的实验方面[3-6]。人们已经通过化学合成及从天然植物中提取的方法筛选出很多抗癌药物,还有一些研究推测了药物的作用路径[7-8]。国内的研究大多集中在提取抗癌药物方面,通过检测在不同浓度的药物作用下的癌细胞存活率,得到不同浓度的药物对癌细胞的抑制率,而药物作用于癌细胞的存活率-剂量曲线的理论模型的研究则较少。实验研究发现,药物作用于癌细胞的存活率-剂量曲线既有“马鞍型”[9-10],又有“肩型”[11]。这与辐射作用于细胞的存活率-剂量曲线具有相同的特点。辐射作用于细胞的模型最早为靶模型[12],然后逐渐发展为线性平方模型(LQ模型)[13]、修复模型[14-15]、局部效应模型[16]、速率模型[17-18]等,但这些模型对于“马鞍型”存活率-剂量曲线不能给出很好的解释。李多芳等在研究了现有的辐射作用于细胞的模型后,在进化模型Crow-Kimura模型[19]的基础之上,引入辐射剂量和植物自身的修复作用,建立了“电离辐射致植物诱变的损伤-修复模型”[20],对于“马鞍型”存活率-剂量曲线的产生机理能够给出很好的解释,为建立可以解释药物作用于癌细胞的“马鞍型”存活率-剂量曲线的产生机理的模型提供了思路。药物作用于癌细胞的存活率-剂量曲线的理论模型的建立对于研究药物治疗癌症的机理和指导药物治疗癌症都具有重要的意义。因此,下面将建立一个描述药物作用于癌细胞的存活率-剂量曲线的理论模型。
1 理论模型
模型假设初始癌细胞组织为一个个体,癌细胞组织的生长增殖过程可以看作个体状态随时间演化的动力学过程,所有在药物作用下的癌细胞组织构成一个生物群体。在药物的作用下,癌细胞的分子将发生多种的变异,这些变异最终将影响到癌细胞组织的状态,使癌细胞组织经历从能够正常生长增殖的存活状态到一系列的亚损伤状态,并最终到达完全失去存活能力的死亡状态的过程。如果忽略癌细胞组织的受损伤程度,则可以把癌细胞组织受到药物作用后的存活状态分为:正常态C0、损伤态C1和濒死态C2。癌细胞组织3种状态在药物作用下的相互转化过程如图1所示。
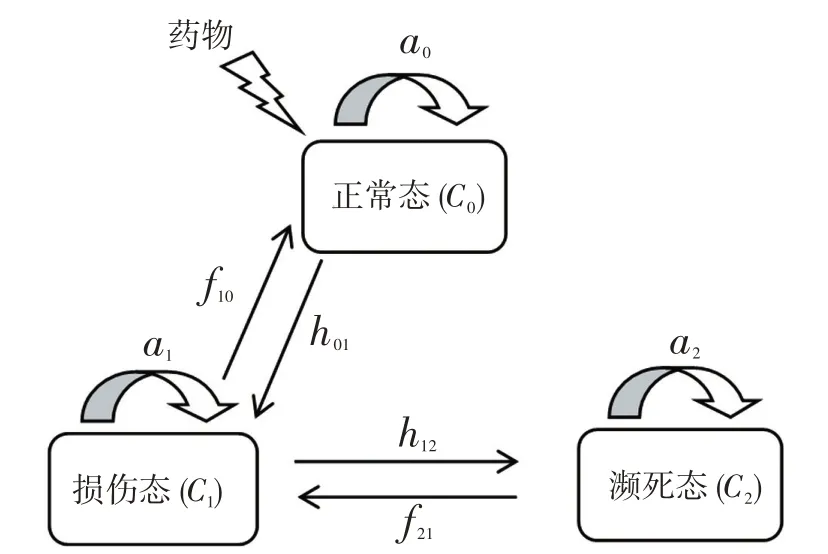
图1 癌细胞组织3 种状态在药物作用下的相互转化过程Fig.1 Transformation of the three states of cancer cells under the action of drugs
假设所有的癌细胞组织在没有药物作用时均为正常态。癌细胞组织3 种状态之间的相互转化过程是在癌细胞组织的适应值、药物对于癌细胞组织的损伤和癌细胞组织的自身修复的共同作用下产生的。而修复作用的引入是出于药物作用于癌细胞组织的反弹现象的考虑。由于癌细胞组织在药物作用下到达死亡态的过程是通过药物对癌细胞组织的损伤不断累积的过程,而癌细胞组织的修复作用也是一步一步累积才能把濒死态的癌细胞组织修复到正常态的,所以,正常态和濒死态之间的转化可以忽略不计。当一定剂量的药物作用于癌细胞组织时,处于正常态的癌细胞组织将有h01的概率转化为损伤态,而处于损伤态的癌细胞组织将有h12的概率转化为濒死态。由于癌细胞组织的自身修复作用,处于濒死态的癌细胞组织将有f21的概率转化为损伤态,处于损伤态的癌细胞组织将有f10的概率转化为正常态。而3种状态的癌细胞组织将分别以a0,a1和a2的概率继续以原有状态进行生长增殖。
根据上述假设,在Crow-kimura模型的基础上,引入药物剂量和修复作用,得到在归一化条件下,药物作用于癌细胞组织群体的各个状态所占比例的动力学方程:
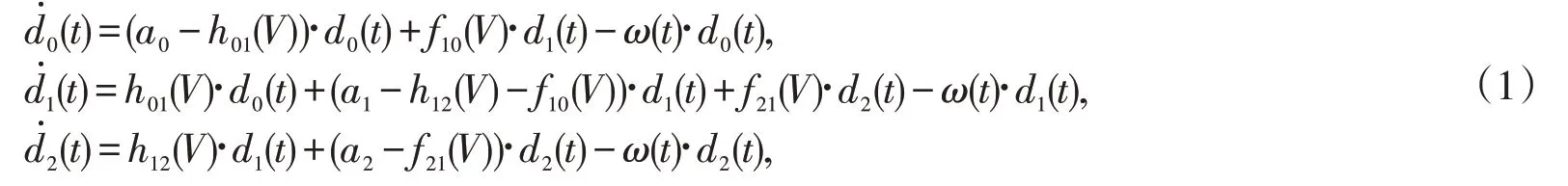
式中:di(t)(i=0,1,2) 表示群体中处于3 种癌细胞组织状态的浓度,并且满足归一化条件ai(i=0,1,2)是3 种状态的适应值,表示癌细胞组织对环境的适应性或环境对个体的选择力;h01(V),h12(V)为癌细胞组织群体各状态之间的药物损伤速率;f10(V),h21(V)表示癌细胞组织群体各状态之间的修复速率,其中V表示药物作用的剂量;ω(t)是考虑到癌细胞增殖因素而引入的稀释流,其数值等于平均适应值
假设DNA双链断裂(DSBs)是药物作用于癌细胞诱导生物性状变异的最主要微观损伤类型。则由LQ模型给出的癌细胞DNA突变率为

式中,k1和k2分别为线性项和平方项系数,线性项表示同一位点上亚损伤的作用几率,平方项表示不同药物分子对相近位点的亚损伤作用几率。引入癌细胞的组织损伤转换速率矩阵

式中:hij为在药物作用下癌细胞组织从状态i转化为状态j的概率;H为药物作用突变矩阵,是下三角形式。
癌细胞受到药物作用时,分子层次的修复首先起作用,之后,随着药物对癌细胞组织损伤的不断累积,分子层次的修复不能对癌细胞进行完全修复,细胞层次的修复开始起作用,通过细胞自噬和凋亡来减少损伤严重的癌细胞,降低癌细胞组织的整体损伤程度。而当药物对癌细胞组织的损伤远远超出癌细胞组织的修复能力时,所有癌细胞将死亡。因此,给出癌细胞的分子层次修复作用为

式中:k3表示癌细胞的修复强度;k4是癌细胞自身修复机理决定的修复系数,与修复范围有关;G0为修复阈值,当药物对DNA的损伤率达到G0时,细胞层次的修复开始起作用。修复阈值为

式中,V0为修复的剂量阈值,超过这一阈值,修复作用不断减弱,癌细胞个体因损伤急剧增加而迅速灭亡。
引入癌细胞的组织修复速率矩阵为

式中:fij为在癌细胞组织自身修复作用下癌细胞组织从状态i转化为状态j的概率;F为癌细胞组织的修复矩阵,是上三角形式。
则方程(1)可以表示为矩阵形式

式中:D为癌细胞组织各状态相对浓度矩阵;A=diag(a0,a1,a2),为适应值矩阵;H表示药物作用突变矩阵;F表示癌细胞组织的修复矩阵。
2 模型应用
将癌细胞组织3种状态的适应值分别假设为a0=1,a1=0.5,a2=0,并应用到几种药物对癌细胞的作用上,结果如下所述。
将药物作用于癌细胞的损伤-修复模型应用到β-胡萝卜素氧化降解产物A 对bel 7402 细胞的作用[9]上,结果如图2所示。
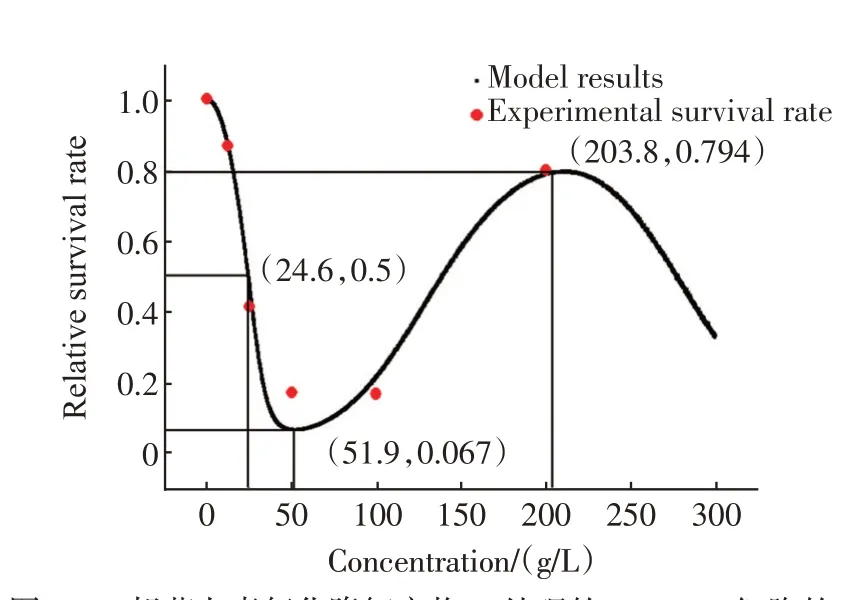
图2 β-胡萝卜素氧化降解产物A 处理的bel 7402 细胞的相对存活率变化Fig.2 Changes of relative survival rate of bel 7402 cells treated with β-carotene oxidation products A
模型参数为k1=0.014,k2=0.000 02,k3=5.6,k4=0.54,V0=227。
将药物作用于癌细胞的损伤-修复模型应用到核桃蛋白胃酶分解产物对MCF-7细胞的作用[10]上,结果如图3所示。
模型参数为k1=0.061,k2=0.000 01,k3=7,k4=0.88,V0=4。
图2 和图3 中的存活率-剂量曲线均为“马鞍型”,这样的存活率-剂量曲线是在适应值、药物损伤和癌细胞的自身修复作用共同作用的结果。在未受药物作用时,2 种癌细胞的相对存活率为1。随着药物剂量的增加,2 种癌细胞的相对存活率逐渐降低,直到达到一个极小值。模型给出的β-胡萝卜素氧化降解产物A对bel 7402细胞和核桃蛋白胃酶分解产物对MCF-7 细胞作用的相对存活率的极小值对应的药物浓度分别为51.9 g/L 和0.91 mg/mL。之后在癌细胞自身修复作用下,其相对存活率有所升高,直到达到一个极大值。模型给出的β-胡萝卜素氧化降解产物A 对bel 7402 细胞和核桃蛋白胃酶分解产物对MCF-7 细胞作用的相对存活率极大值对应的药物剂量分别为203.8 g/L和3.46 mg/mL。然后,随药物剂量的增大,癌细胞的修复作用不断减弱,相对存活率不断降低直至为0。模型给出的β-胡萝卜素氧化降解产物A 对bel 7402 细胞和核桃蛋白胃酶分解产物对MCF-7 细胞作用的半抑制浓度分别为24.6 g/L 和6.16 mg/mL。

图3 核桃蛋白胃酶分解产物处理的MCF-7 细胞的相对存活率变化Fig.3 Changes of relative survival rate of MCF-7 cells treated with pepsin hydrolysate of walnut protein
将药物作用于癌细胞的损伤-修复模型应用到藏药纤毛婆婆钠乙酸乙酯提取物对Hela 细胞、U20S 细胞和SMMC-7721细胞的作用[11]上,结果如图4所示。
Hela 细胞的模型参数为k1=3.4,k2=0.000 01,k3=2.04,k4=0.39,V0=0.022。
U20S细胞的模型参数为k1=8.35,k2=0.000 01,k3=0.75,k4=0.15,V0=0.29。
SMMC-7721 细胞的模型参数为k1=7.38,k2=0.42,k3=1.22,k4=0.22,V0=0.25。
图4中的存活率-剂量曲线均为“肩型”,这样的存活率-剂量曲线也是在适应值、药物损伤和癌细胞组织的自身修复作用共同作用的结果,只是癌细胞的修复作用较小,在图中很难体现出来。在未受药物作用时,3 种癌细胞的相对存活率为1。癌细胞的相对存活率随藏药纤毛婆婆钠乙酸乙酯提取物浓度的增加而逐渐降低直至为0。模型给出的藏药纤毛婆婆钠乙酸乙酯提取物对Hela 细胞、U20S 细胞和SMMC-7721 细胞的作用的半抑制浓度分别为0.539 g/L、0.257 g/L和0.369 g/L。
从图2~图4 可以看出,药物作用于癌细胞的损伤-修复模型的结果与实验数据高度符合。对“马鞍型”的癌细胞相对存活率-剂量曲线和“肩型”的癌细胞相对存活率-剂量曲线的形成均可进行合理解释。当药物损伤在某一剂量范围内与修复作用相差较小时将出现“马鞍型”曲线,当药物损伤一直与修复作用相差很大时,将出现“肩型”曲线。当同种药物作用于不同种类的癌细胞时,由于不同种类癌细胞对同种药物的敏感性和修复效应不同,癌细胞所产生的生物效应结果有所不同。

图4 藏药纤毛婆婆钠乙酸乙酯提取物处理的Hela 细胞、U20S 细胞和SMMC-7721 细胞的相对存活率变化Fig.4 Changes of relative survival rate of Hela cells,U20S cells and SMMC-7721 cells treated with ethyl acetate extract from Veronica ciliata Fisch
3 讨论与结论
药物作用于癌细胞,抑制并杀死癌细胞的过程,涉及药物分子与生物大分子的相互作用、癌细胞组织的修复作用,以及组织调节等因素,是一个十分复杂的过程。现在的癌细胞模型多为以时间为自变量的药代动力学模型,如阿霉素治疗三阴性乳腺癌的模型[21]描述了细胞群对阿霉素作用30 d的反应,少有描述存活率-剂量曲线的。实验发现最初的药物剂量和最终癌细胞组织的存活率间存在某些联系。虽然“马鞍型”曲线的具体内在机理并不十分清楚,但仍可以通过药物作用于癌细胞的损伤-修复模型给出药物剂量与癌细胞存活率的关系,模型结果与实验数据高度符合。因此,模型具有一定的合理性。
药物作用于癌细胞的损伤-修复模型既可以解释癌细胞的“肩型”存活率-剂量曲线,又可以解释“马鞍型”存活率-剂量曲线。这2种曲线的形成均是在适应值、药物损伤和癌细胞组织自身修复作用共同作用的结果。模型参数的不同表示癌细胞对药物敏感性及其修复效应的不同。由于不同癌细胞对同种药物以及同种癌细胞对不同药物的敏感性和修复效应的不同,癌细胞在药物作用时的生物效应结果也不同。通过模型对药物作用于癌细胞的部分实验结果进行模拟,可以得到癌细胞相对存活率随药物浓度的变化曲线。模型结果与实验数据相差越小,理论模型就越具有实际意义。可以根据来需要选择适宜药物浓度进行药物作用癌细胞的实验,同时,理论结果也可以对癌症的临床治疗提供参考。药物作用于癌细胞的损伤-修复模型给出了β-胡萝卜素氧化降解产物A处理的bel 7402细胞的相对存活率变化,核桃蛋白胃酶分解产物处理的MCF-7 细胞的相对存活率变化,以及藏药纤毛婆婆钠乙酸乙酯提取物处理的Hela 细胞、U20S 细胞和SMMC-7721细胞的相对存活率变化。给出了相应的模型参数、半抑制浓度和修复作用阈值。模型的结果与实验数据能够高度符合。不但能够对这些药物抑制癌细胞的实验提供参考,还可以为之后药物抑制癌细胞的理论研究提供新的思路。
