含氮有机废水臭氧氧化过程中氮素形态的转变
2022-09-09邵雨菲曾韵乔季文杰吴德礼
邵雨菲,曾韵乔,季文杰,王 铮,谢 宇,宗 扬,吴德礼,*
(1.同济大学环境科学与工程学院,上海 200092;2.上海城市水资源开发利用国家工程中心有限公司,上海 200082)
化学工业废水中常含有重金属-有机络合物等难降解、高毒性污染物[1],使废水处理非常困难。随着排放标准和回用要求的提高,难降解工业废水污染是我国绿色化工转型发展面临的重大环境问题之一,已成为制约许多行业发展的重要瓶颈[2]。含氮有机物为废水中总氮(TN)指标的重要来源,由于含有氨基而具有较强的络合能力,容易络合废水中重金属离子使其处理变得困难[3]。另外,含氮物质通常具有一定的刺激性气味,影响感官体验。如何高效降解含氮有机物、破坏其络合能力是目前工业废水处理的难点。含氮基团降解后容易产生各类无机态氮素,例如氨氮、硝酸盐等,这些无机氮素的产生情况是探究有机物降解途径的重要评判标准[4]。因此,含氮有机络合物的氮素转化是非常值得研究的问题。
伯氨基有机物在臭氧氧化下,氮素的变化是高级氧化体系中产物分析关键的一步,氨基的转变影响着水体中氨氮和硝态氮的浓度[5]。选取具有两分子氨基(邻位双氨基)的乙二胺(EDA)作为目标污染物[6],研究臭氧氧化去除水中含氮有机物的性能和机制。通过pH、金属离子种类等条件调控臭氧催化过程,并对氮素价态及形态的分析手段研究分析溶液中氮素转化。考虑到有机物中不同氨基类型对反应的影响,分别考察臭氧氧化Ni-3EDA和Ni-乙二胺四乙酸络合物(Ni-EDTA)的氮素产物分布。
1 材料与方法
1.1 试剂与仪器
主要试剂:盐酸、硫酸、硝酸、氢氧化钠、硫酸铜、硫酸锌、氯化亚铁、酒石酸钾钠、纳氏试剂、碘化钾、硫酸镍、EDA(99.9% metals basis)、EDTA。以上试剂除特殊标注外均为分析纯。
主要仪器:KT-OZ-10g型臭氧发生器,上海CONT;TU-1810型紫外分光光度计,北京普析通用;HJ6型恒温磁力搅拌器,上海国华科学仪器;Direct 8型超纯水仪,美国Millipore。
1.2 试验和分析测试方法
臭氧反应过程在自制的有机玻璃反应器内进行,模拟废水一次性加入,持续通入臭氧气体,半连续流反应模式。反应器是内径为12 cm、高为100 cm的圆柱形容器,底部装有直径为12 cm、厚度为3 mm、孔径为0.22 μm的烧结硅质曝气滤板,用于将臭氧气体分散为微小气泡。臭氧发生器以干燥高纯氧为气源,通过调节发生器电流以及气体流量计对臭氧投加量进行控制,正式试验开始前先排空前15 min产生的臭氧气体,使得仪器保持稳定运行状态。向反应器内加入2 L特定浓度的模拟废水溶液,通入臭氧开始反应,反应溶液通过曝气混合搅拌。按特定的时间间隔进行取样,所有样品均通过0.45 μm聚醚砜针式过滤器对其中的固体杂质进行去除,随后进入相应检测仪器进行分析。未被利用的臭氧尾气通过后续的碘化钾吸收液进行消除。
氨氮利用纳氏试剂分光光度法测定,硝酸根利用氨基磺酸分光光度法测定,TN利用消解-氨基磺酸分光光度法测定。
2 结果和讨论
2.1 初始pH和金属离子种类对臭氧降解EDA体系的影响
2.1.1 初始pH对体系氮素转化的影响
控制EDA摩尔浓度为1 mmol/L,臭氧通入速率为2.1 mg/(mg TN),反应时间为30 min,在不同初始pH条件下,EDA与臭氧反应30 min后的氮素变化情况如图1所示。可以看出pH越高,氨基转化为硝态氮的含量越多,推测此时硝态氮的生成与羟基自由基(·OH)的生成增多有关[7]。如图1所示,在各个初始pH条件下反应30 min后,溶液中均检测到大量氨氮存在,说明EDA中的氨基在臭氧氧化下容易氧化脱离生成氨氮,且随着pH的上升,生成氨氮的量逐渐降低。综上,氨基的氧化不仅能够生成硝酸根等氧化态较高的氮素,还能生成还原态较强的氨氮。从还原态分析,氨氮中的氮元素为最低价态(-3价),臭氧氧化氨基有机物后生成还原态更高的物质似乎有悖常理,但是实质上臭氧氧化的物质为有机物中的碳元素,将烷基氧化醛基,所以这依然符合氧化还原基本原理。由试验结果可知,臭氧氧化在酸性条件下容易将氨基转化为氨氮,而在碱性条件下,容易将部分氨基氧化为硝态氮。
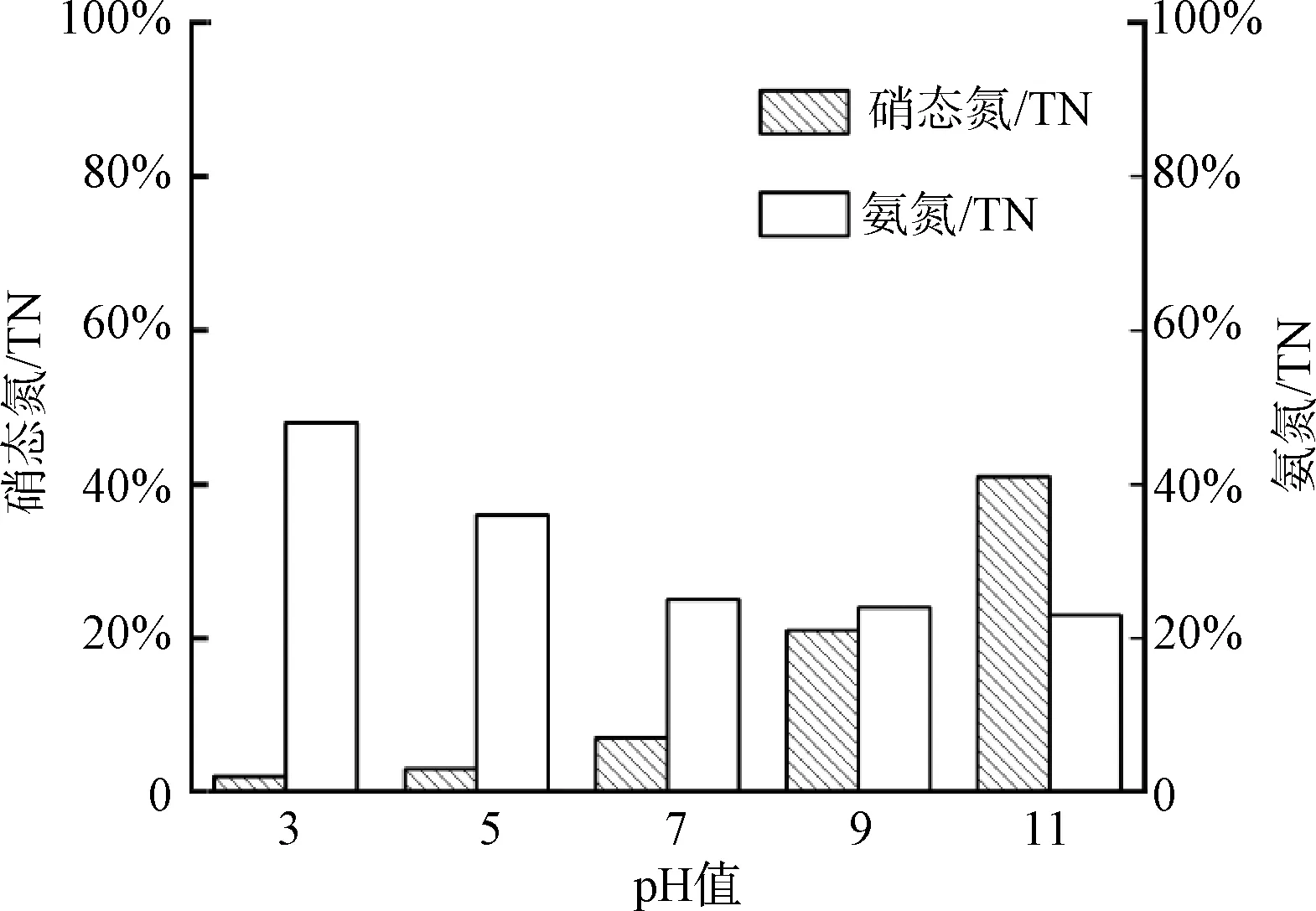
图1 不同初始pH值下臭氧氧化EDA体系硝态氮和氨氮生成比例Fig.1 Generation Ratio of Nitrate Nitrogen and Ammonia Nitrogen in Ozonation of EDA under Different Initial pH Values
2.1.2 过渡金属离子引入对氮素产物分布的影响
金属离子络合会削弱臭氧对配位剂的氧化作用[8],因此,进一步探究金属离子的引入对氮素转化的影响有重要意义。将反应中产生的氨氮和原有的有机氮统一表示为凯氏氮,如图2所示。向体系中加入摩尔浓度为0.3 mmol/L的EDA,金属离子摩尔浓度均为0.1 mmol/L,臭氧通入速率为3.6 mg/(mg TN),初始pH值为7,反应30 min。图2(a)表明,单独EDA臭氧氧化产物中,氮的产物中除凯氏氮之外仅产生硝态氮,占TN的23%。Zn(Ⅱ)或Fe(Ⅱ)存在时,硝态氮的含量提升;Ni(Ⅱ)或Cu(Ⅱ)存在时,氮素产物中不仅出现了硝态氮,而且溶液中TN出现下降趋势,即产生挥发性氮素。
所考察的4种金属离子均为过渡金属离子,其中Zn(Ⅱ)仅有一种价态,其余3种金属离子均具有多种价态。根据高级氧化理论,高价金属可分为两类[9]:一类含有氧原子团簇,例如Fe(Ⅳ)=O和Co(Ⅳ)=O;另一类是普通高价重金属离子,例如Ni(Ⅲ)和Cu(Ⅲ)。在本试验中,Ni(Ⅱ)、Cu(Ⅱ)投加体系中出现挥发性氮素,而Fe(Ⅱ)、Zn(Ⅱ)投加体系中均不出现挥发性氮素。因此,挥发性氮素产生途径为体系中普通高价重金属离子的氧化,即Ni(Ⅱ)和Cu(Ⅱ)在臭氧体系中产生+3价的高价态金属,进而氧化产生挥发性氮素。
Cu(Ⅱ)和Ni(Ⅱ)的引入都能造成挥发性氮素的产生,研究其产生时间有助于探索挥发性氮素的产生机理。如图2(c)所示,挥发性氮素主要产生于反应初期。在反应过程中,溶液中EDA被氧化逐渐产生氨氮和硝态氮,而这两种物质与臭氧的反应速率常数较低[10]。因此,在无其他反应的基础上,这两类无机氮素随着臭氧反应的进行含量逐渐增多。大量挥发性氮素产生于反应初期,说明大部分挥发性氮素的产生与两类无机氮素无关,而主要来自于EDA与臭氧的氧化过程。
上述体系中反应后溶液中硝酸根浓度如图2(d)所示,发现在有Ni(Ⅱ)或Cu(Ⅱ)存在的体系中,随着反应的进行,硝酸盐和挥发性氮素同时生成,在挥发性氮素生成越多的体系中,硝酸盐的生成量较低。氮素氧化的最高价为硝酸盐,硝酸盐生成量减少说明在氮素氧化过程中,氮素中间价态产物减少,因此,挥发性氮素应为价态较低的物质。中间态挥发性氮素生成后快速脱离体系,使得中间态氮素难以进一步氧化为硝态氮。挥发性氮素可能为氮素的中间价态产物,例如氮气或N2O。由于NO与臭氧的反应速率较高[11],反应后即产生酸性气体NO2,NO2具有颜色且较容易溶于非酸性溶液中[12]。而在本试验中,反应后气体无色,因此,挥发性物质并非NO。
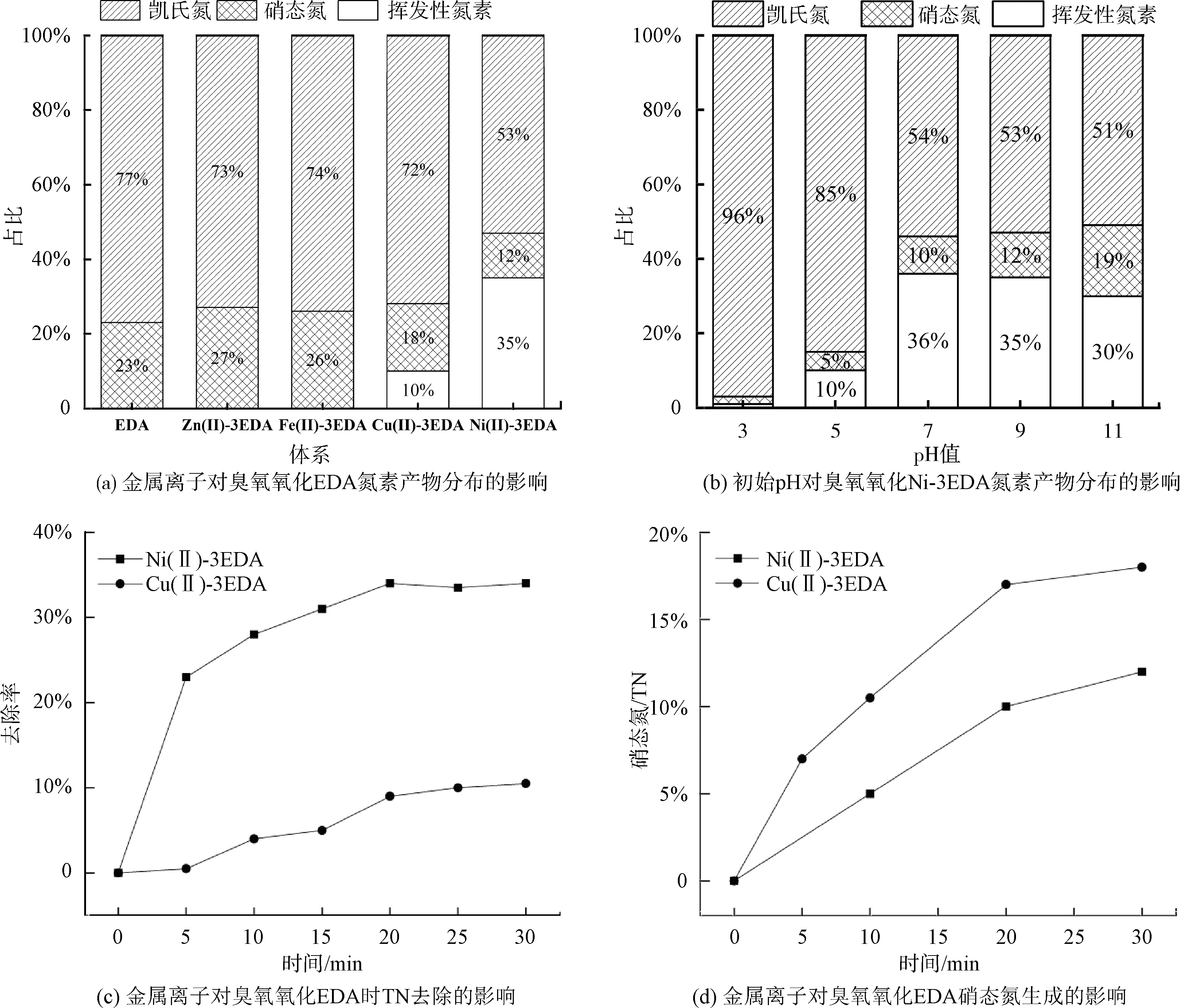
图2 不同过渡金属离子引入对臭氧氧化EDA体系氮素转化的影响Fig.2 Effects of Metal Ions on Nitrogen Transformation in Ozonation of EDA
2.2 初始pH对臭氧降解Ni-3EDA体系的影响
Ni(Ⅱ)的加入为体系中氮素的氧化带来新产物——挥发性氮素,具有脱除水中TN的功能,因此,探究在不同初始pH条件下臭氧降解Ni-3EDA过程中氮素转化的情况具有重要意义。如图2(b)所示,挥发性氮素在中性和碱性条件下产生量较多,在弱酸性条件下产生较少,而在强酸性条件下基本不产生。该现象说明初始pH条件是影响挥发性氮素产生的主要因素。硝酸盐的产生量随着pH升高越来越多,符合单独臭氧降解EDA试验的现象。
下文对体系中氮素产物进行进一步讨论。挥发性氮素的生成量越多,则溶液中TN减少量越多。如图2(b)所示,相比酸性条件,中性和碱性条件有利于挥发性氮素的生成,但是在碱性较强的条件下,挥发性氮素生成量降低。由于挥发性氮素生成后快速脱离体系,不会进一步与氧化剂反应生成硝酸根,此时挥发性氮素生成量减少并非溶液中·OH氧化造成[13]。由试验结果可知,强碱性条件下有机胺的氧化容易生成硝酸盐而非挥发性氮素。
如图3(a)、图3(b)所示,EDA摩尔浓度为0.3 mmol/L,臭氧通入速率为3.6 mg/(mg TN),Ni(Ⅱ)摩尔浓度为0.1 mmol/L,当溶液pH越高时,氨氮的生成量越来越少,说明碱性条件下臭氧氧化EDA生成氨氮的反应速率较低,而酸性条件下生成氨氮的反应速率较高。此外,除强酸性条件下(pH值=3),其余条件均发现氨氮浓度随着反应会逐渐降低,说明生成的氨氮后续会逐渐参与其他反应。在无Ni(Ⅱ)的体系中,随着臭氧的曝入生成的氨氮浓度仅出现少部分降低,而在Ni(Ⅱ)存在的体系中,生成的氨氮变得容易被消耗。对比可知氨氮被氧化的过程中Ni(Ⅱ)发挥了不可或缺的作用。
2.3 氨基类型对氮素形态转化的影响
EDA中氨基为伯氨基,而EDTA中氨基为叔氨基。氨基中氢原子数的不同造成了氨基还原态的不同[14]。在之前的研究中发现,伯氨基在被上述体系氧化的过程中会产生挥发性氮素,为探究叔氨基的氧化是否能产生挥发性氮素,将上述体系中的Ni-3EDA更换为Ni-EDTA,进行初始pH影响试验。臭氧通入速率仍为3.6 mg/(mg TN),Ni(Ⅱ)投加摩尔浓度为0.1 mmol/L,EDTA摩尔浓度为0.1 mmol/L,试验数据表明,各个pH条件下TN均未改变。如图3(c)、图3(d)所示,反应30 min后的硝酸盐生成量仍然随着pH的上升而逐步增多。而氨氮的变化趋势与EDA试验组不同,各个pH条件下氨氮的生成量随着反应的进行而逐渐增多。
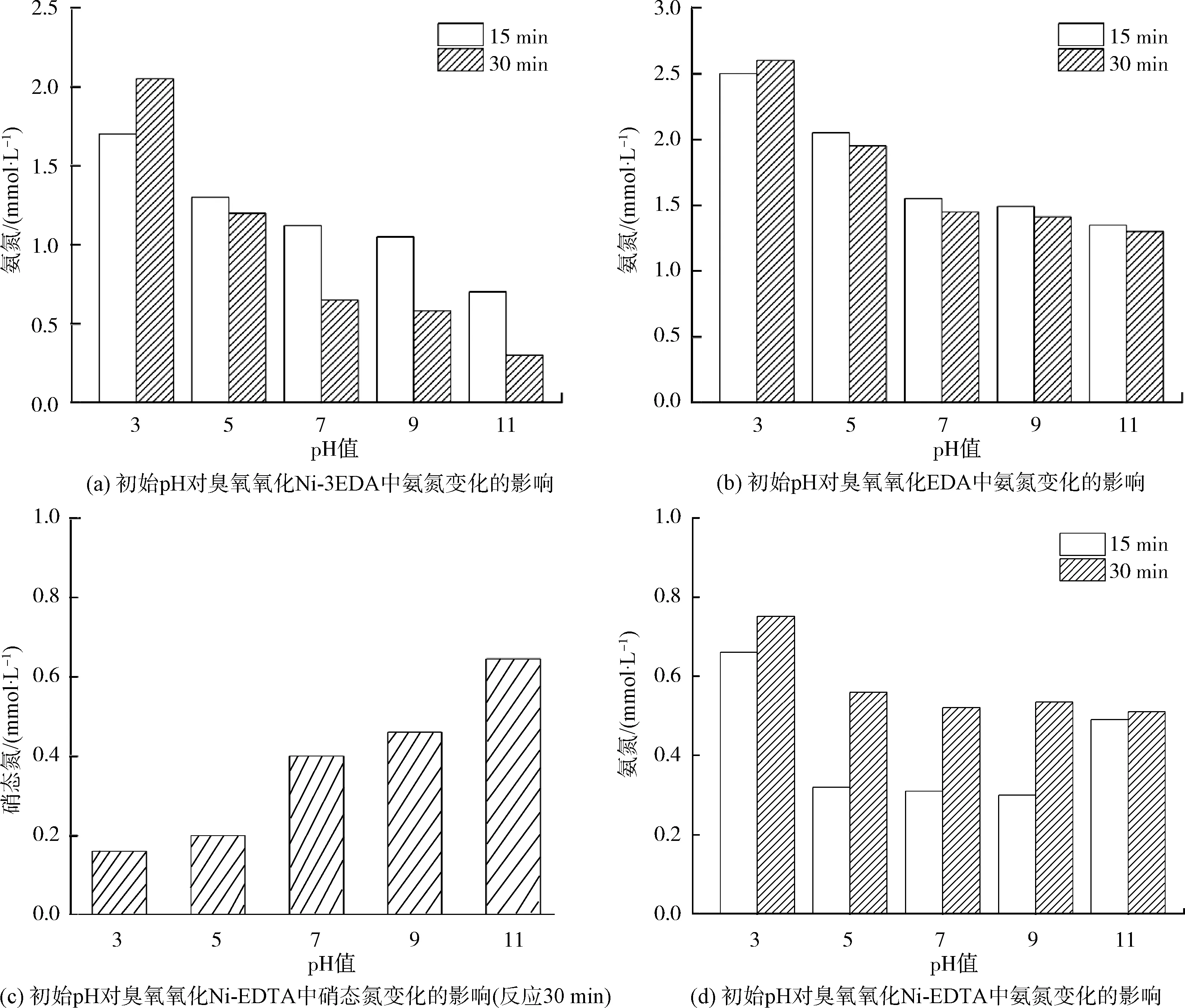
图3 初始pH对臭氧氧化Ni-3EDA、EDA、Ni-EDTA中硝态氮和氨氮变化的影响Fig.3 Changes of Nitrate Nitrogen and Ammonia Nitrogen in Ozonation of Ni-3EDA, EDA and Ni-EDTA under Different Initial pH Values
从叔氨基的臭氧氧化体系中发现氮素转化的规律为:随着臭氧氧化反应的进行,叔氨基的氧化逐渐释放出氨氮和硝酸根,其中pH越高,氧化生成的硝酸盐越多,同时氨氮生成量减少。氨氮在体系中生成速率高于消耗速率,导致随着反应时间增长其浓度逐渐累积。EDTA在中性和碱性条件下臭氧降解时,容易发生“N-C-C-N”键的断裂,使得邻氨基断裂形成两个只有一个氮原子的分子[15]。EDTA分子变化阻碍了氨基产生挥发性氮素,因此,挥发性氮素的产生条件为被臭氧氧化的有机物分子中存在邻氨基结构。
3 结论
(1)臭氧直接氧化EDA能产生氨氮和硝态氮,在酸性条件下主要生成氨氮,在碱性条件下主要生成硝态氮。在重金属如Ni(Ⅱ)或Cu(Ⅱ)存在条件下,臭氧氧化EDA体系中出现挥发性氮素,导致溶液中TN浓度降低。在对比其他重金属离子如Fe(Ⅱ)和Zn(Ⅱ)的作用后,认为挥发性氮素生成与普通高价重金属离子有关。
(2)在臭氧氧化Ni-3EDA体系中,挥发性氮素在中性和碱性条件下产生量较多,在弱酸性条件下产生较少,而在强酸性条件下基本不产生。硝酸盐的产生量随着pH升高而增多,氨氮产生量随着pH升高而减少。Ni(Ⅱ)的存在在氨氮氧化挥发性氮素的过程中发挥了重要作用。
(3)伯氨基的氧化与叔氨基的氧化不同。在伯氨基氧化体系中,生成的氨氮参与挥发性氮素的生成,而在叔氨基氧化体系中,无挥发性氮素生成。叔氨基氧化过程中双氮结构断裂,使得还原性氮素难以氧化至挥发性氮素。
在未来的臭氧氧化含氮有机废水的工艺环节中,可通过改变pH、过渡金属离子种类等条件构建高效的催化氧化体系,将其中难降解、易络合的有机氮素转化为挥发性氮素、硝酸根等进行去除,从而提高有机废水的可生化性。本研究为重金属络合废水的破络转化和臭氧氧化处理含氮有机物提供了新思路。
