Piezo1介导的流体剪切应力通过增强细胞骨架重组上调成骨细胞增殖
2022-09-09杜文佳何良志刘众成詹红伟姜金
杜文佳 何良志 刘众成 詹红伟 姜金
兰州大学第二医院(甘肃省骨科临床医学研究中心),甘肃 兰州 730030
伴随人口老龄化加剧,骨质疏松引起的相关问题逐渐成为社会的重大负担,已演变为严重的公共卫生事件[1,2]。目前研究表明,维持骨量由骨形成、骨重塑等生理进程共同维系动态平衡[3]。当骨稳态的动态平衡被打破,随之会出现骨量下降、骨骼过度矿化等病理过程[4]。然而,骨质疏松的发生、发展机制目前仍不明确。流体剪切应力(fluid shear stress,FSS)在对抗骨质疏松的发生及进程中起着不容忽视的重要作用[5,6]。骨骼的机械负荷可以通过间质液流动产生的FSS传递至成骨细胞和骨细胞,这种流体特性在骨细胞和衬在小梁周围的成骨细胞表面产生剪切应力,剪切应力传递各种生化信号至细胞内,最终发挥生物学效能[7]。2010年Coste B等[8]作者首先在小鼠神经母细胞瘤细胞系中发现一种快速适应的机械敏感性阳离子通道,并将其命名Piezo1(Fam38A)。当前研究认为Piezo1在调控并参与骨质疏松进程中起着重要作用[9-11]。2017年Sugimoto A等[9]作者发现Piezo1对骨骼内环境稳态维持及成骨分化具有重要作用。最近研究发现Piezo1机械敏感性阳离子通道或许在骨质疏松及骨性关节炎的发生及发展过程中起关键作用[10]。Wang L等[11]发现Piezo1主要通过在成骨细胞中的信号传递作用影响破骨细胞活性而在骨组织中发挥作用。Song T等[12]发现Piezo1介导的成骨细胞促进成骨细胞分化,利于骨形成。然而,Piezo1是否参与成骨细胞的增殖过程以及其相关的分子机制仍然需要进一步研究。
细胞骨架是真核细胞中的蛋白纤维网架系统,其在维持正常细胞形态中起重要作用[13]。在成骨细胞中,细胞骨架肌动蛋白在对机械刺激的感知中发挥重要作用[14]。Suzuki H等[15]发现成骨细胞中的细胞骨架的功能对受机械应力调控的骨形成过程十分关键。然而,迄今为止,关于FSS如何介导细胞促进成骨细胞增殖的机制仍不明确,仍缺乏相关研究证实Piezo1通道蛋白是否会对细胞骨架产生影响。本实验中,我们使用课题组自行研发的FSS加载装置(专利号:ZL201520-637211.6)该FSS加载装置由6通道平行小室构成,通过计算机监控实时加载的FSS大小,由计算机监控系统、储液系统、加载系统以及脉管系统构成[16,17]。在体外对MC3T3-E1小鼠成骨细胞作用,探究Piezo1介导的FSS对成骨细胞增殖的具体机制。我们提出如下假设:Piezo1通道蛋白介导的FSS通过增强细胞骨架重组上调成骨细胞增殖。本研究拟使用FSS加载装置探究FSS与Piezo1的具体作用关系,并探讨Piezo1与成骨细胞的细胞骨架蛋白之间的上下游关系及具体作用机制。
1 实验与方法
1.1 器材与仪器 研究所需MC3T3-E1成骨细胞系购自中国北京协和细胞技术资源中心。试剂:α-MEM培养基(Hyclone,美国),胎牛血清(FBS)(Gibco,美国),胰蛋白酶(Gibco,美国),青霉素-链霉素溶液100×、磷酸盐缓冲液(PBS)、4%多聚甲醛、Triton-×100(Beyotime,中国),DAPI染色液(Biosharp,中国),Piezo1一抗、PCNA一抗、MCM2一抗、Cyclin D1一抗、山羊抗兔二抗、山羊抗鼠二抗、山羊抗兔荧光二抗-488(Proteintech,中国),EdU染色试剂盒(Rebobio,中国),CytochalasinD(Topscience,中国),Yoda1、GsMTx4(Tocris,英国)。
1.2 细胞培养 MC3T3-E1成骨细胞培养于含有1%青霉素-链霉素的完全培养基(α-MEM∶FBS=9∶1)中,细胞培养瓶中加入4mL完全培养基,将细胞置于37℃、5%CO2培养箱内,每日观察一次,细胞增长至90%密度进行1∶2传代。
1.3 细胞干预 按课题组既往操作将细胞置于FSS加载装置中,调整加载参数,待加载完成后取出玻片进行下一步操作[18]。Piezo1激动剂Yoda1溶解于DMSO,并配置成100μmol/L浓度,将其加入需要进行干预的细胞培养瓶并使最终浓度为10μmol/L,作用2h。Piezo1抑制剂GsMTx4溶解于PBS并配置成10μmol/L浓度,将其加入需要进行干预的细胞培养瓶,并使最终浓度为4μmol/L,作用0.5h。
1.4 免疫荧光及鬼笔环肽染色 使用4%多聚甲醛进行固定30min(室温),PBS清洗三遍,将细胞置于1%Triton-×100中通透30min(室温),PBS清洗三遍,然后将细胞置于10%山羊封闭血清封闭30min(37℃),PBS清洗三遍,将细胞置于Piezo1一抗(1∶300)中过夜(4℃),PBS清洗五遍,然后将细胞置于荧光二抗(-488)中染色1h(37℃),PBS清洗五遍,将细胞置于DAPI染色液中15min(37℃),在荧光显微镜下观察细胞。
1.5 EdU染色 将干预后的MC3T3-E1细胞种植在直径12mm的盖玻片,分别置于24孔板内,每孔滴加200μLEdU染液,37℃水浴锅内放置1h。吸弃EdU染液,PBS洗2次,3min/次,每孔加0.5mL 4%多聚甲醛固定细胞,室温静置30min。吸弃甲醛,每孔加入0.5mL 1g/L甘氨酸中和醛基,室温摇床摇洗5min。吸弃甘氨酸溶液,PBS洗2次,3min/次,每孔滴加0.5mL 0.5%Triton×-100,室温摇床放置10min。PBS摇洗2次,3min/次,每孔加入200μL染液,避光室温摇床放置30min。吸弃反应液,再次滴加0.5mL 0.5%Triton×-100通透液,清洗2次,10min/次,滴加0.5mL甲醇洗1次,5min,PBS洗1次,5min。每孔加入200μL Hoechst染液,室温、避光摇床放置30min,弃反应液,PBS洗2次,3min/次,随后将盖玻片取出,荧光显微镜下观察。
1.6 Western Blot使用RIPA细胞裂解液与PMSF以100∶1比例配置裂解液,向干预完成的细胞中加入1.0mL裂解液,冰上裂解30min,12 000rpm离心20min后弃去沉淀。向剩余裂解液中加入1/3的4×蛋白质上样缓冲液。蛋白在10%SDS-PAGE胶中120V电泳,待电泳完成后350 mA恒流转印30min,封闭1h后将转印膜置于相应一抗中4℃过夜,取出转印膜并置于相应二抗中作用1h。拭干转印膜后滴加ECL发光液并曝光。
1.7 统计学分析 定量分析实验重复至少3次。所有数据以“均值±标准差”(M±SD)呈现。其次使用双尾t-检验或单因素方差分析计算是否具有统计学意义并绘制统计图;P<0.05为差异具有统计学意义。Image-J用于计算Western blot条带灰度值。Adobe Illustrator(2019版本,美国)进行图像组装及成图。
2 结果
2.1 不同强度循环FSS对成骨细胞Piezo1表达的影响 Western Blot结果表明未加力时成骨细胞内Piezo1蛋白处于低表达状态,随着施加不同强度FSS,细胞内Piezo1蛋白表达呈先增后减的趋势,6dyne/cm2时表达量最高,与未加力组相比差异有统计学意义(P<0.001),后文加载FSS强度设定为6dyne/cm2。加载9dyne/cm2、12dyne/cm2FSS时,与未加力组相比仍有明显统计学差异(P<0.001),但较加载6dyne/cm2力时有所下降。而当FSS加载到15dyne/cm2、18dyne/cm2时,Piezo1蛋白表达量下降,这可能与强FSS致细胞膜破坏有关。见图1。
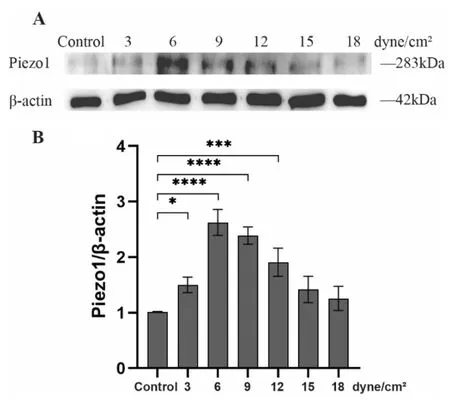
图1 Western Blot检测不同强度FSS对Piezo1蛋白表达的影响
2.2 Yoda1和GsMTx4对成骨细胞Piezo1蛋白的影响早期研究发现,Piezo1蛋白激活剂Yoda1和抑制剂GsMTx4对细胞的最适作用时间分别为3h和2h。对成骨细胞干预不同浓度Yoda1和GsMTx4、免疫荧光染色检测成骨细胞内Piezo1蛋白表达结果如图2示,Yoda1可以促进成骨细胞内Piezo1蛋白表达,而20μM组相比于其他各浓度组Piezo1蛋白表达更高。同样,GsMTx4则抑制细胞内Piezo1表达,相比之下,0.5μM组内Piezo1蛋白抑制最明显。

图2 免疫荧光检测不同浓度Yoda1和GsMTx4对成骨细胞内Piezo1蛋白影响
2.3 Piezo1上调成骨细胞增殖 如图3所示,对成骨细胞分别以Yoda1(Piezo1特异性激活剂,20μM,3h)、DMSO(Piezo1溶剂)、GsMTx4(Piezo1特异性抑制剂,0.5μM,2h)干预,Western Blot检测Piezo1、PCNA、MCM2、Cyclin D1的表达。结果显示,Yoda1可促进成骨细胞内Piezo1蛋白表达上调(P<0.001,图3B),GsMTx4则明显下调Piezo1蛋白(P<0.001,图3B)表达,上调Piezo1蛋白后成骨细胞增殖相关蛋白明显上调(PCNA∶P<0.01、MCM2∶P<0.01、Cyclin D1∶P<0.001,图3C-E),而沉默Piezo1蛋白则抑制成骨细胞增殖相关蛋白的表达(PCNA∶P<0.01、MCM2∶P<0.05、Cyclin D1∶P<0.001,图3C-E),溶剂DMSO则不会影响Piezo1蛋白及增殖相关蛋白表达(图3B-E)。
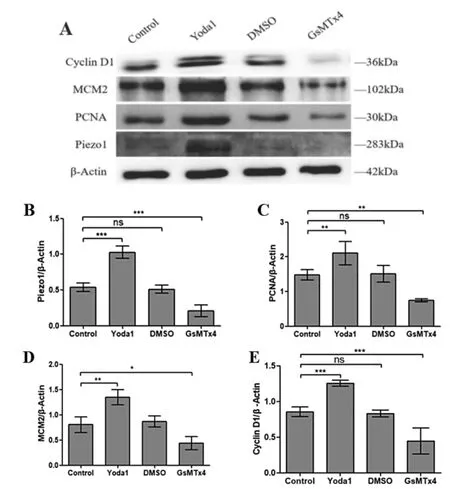
图3 Western Blot检测Piezo1蛋白对成骨细胞增殖的影响
EdU染色观察成骨细胞增殖,如图4所示,Yoda1组成骨细胞增殖率明显高于空白组,与空白组相比具有统计学意义(P<0.001,图4B)。GsMTx4组细胞增殖率则低于空白组(P<0.05,图4B)。
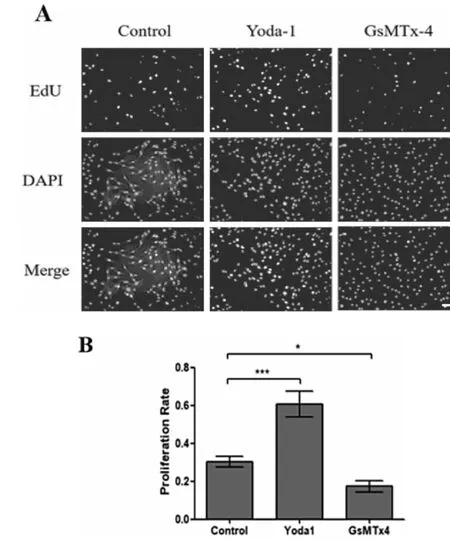
图4 EdU染色观察Piezo1蛋白对成骨细胞增殖的影响
2.4 FSS及Piezo1蛋白对成骨细胞细胞骨架的影响相比于空白组,FSS组细胞内应力丝阳性率明显增高(P<0.001)。给予GsMTx4干预后,与FSS组相比,FSS+GsMTx4组内成骨细胞应力丝阳性率明显降低(P<0.001)。证明FSS促进成骨细胞内细胞骨架重组,而抑制Piezo1蛋白则抑制成骨细胞内细胞骨架重组。见图5。
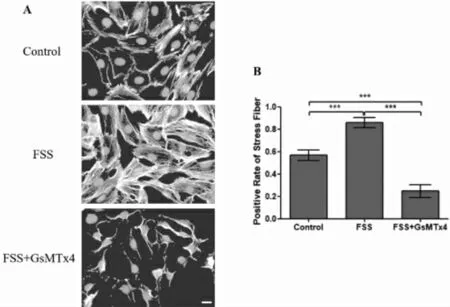
图5 鬼笔环肽染色观察FSS与Piezo1对成骨细胞内细胞骨架的影响
2.5 FSS通过细胞骨架上调成骨细胞增殖 如图6所示,EdU染色显示空白组、FSS组以及FSS+骨架蛋白F-actin特异性抑制剂细胞松弛素D(CytoD)组中成骨细胞增殖表现,与空白组相比,FSS组增殖率明显升高(P<0.001,图6B),使用CytoD进行干预后,相较于FSS组细胞增殖率出现显著下调(P<0.001,图6B)。证明抑制骨架蛋白后抑制成骨细胞增殖。
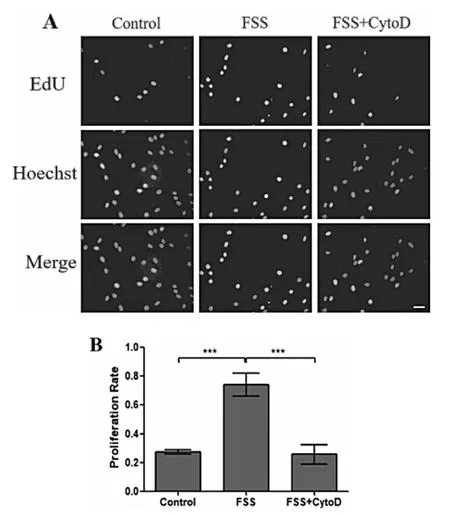
图6 FSS通过细胞骨架上调成骨细胞增殖的EdU染色
3 讨论
本研究主要发现Piezo1介导的FSS上调小鼠MC3T3-E1成骨细胞增殖相关蛋白以及增殖率。进一步研究发现细胞骨架在Piezo1介导的FSS上调成骨细胞中发挥重要作用,抑制骨架蛋白表达可以显著降低生物力学信号对成骨细胞增殖的影响。
Piezo1机械敏感性离子通道是促进胚胎发育和成人骨环境稳态的重要机械传感器。《自然》杂志最新列出的2021年值得关注的7种技术中指出,除了生长因子和其他分子,细胞还可以感知物理力,这种力可以调节基因表达、细胞增殖以及癌症发生,在感受力学刺激的诸多分子中,Piezo1离子通道被提到首位[19]。之前我们的研究发现,成骨细胞细胞膜上Piezo1通道可以感受FSS并对FSS刺激做出反应[10,16,20]。虽然后续有多项研究发现Piezo1蛋白调节成骨细胞增殖及在小鼠骨骼发育中的关键作用,这些研究分别从不同层面阐明了Piezo1在成骨细胞中的作用,但是关于流体剪切力介导Piezo1调控成骨细胞增殖的机制知之甚少,而且流体剪切力作用后,细胞内信号传递的方式也不十分不明确[11,12,21,22]。
关于其他细胞的研究中已发现流体剪切力对Piezo1通道的影响,如Wang S等[23]发现,流体剪切力诱导的血管内皮细胞内ATP释放和P2Y2/Gq/G11介导的信号传递中,Piezo1参与了下游磷酸化过程和内皮NOS的激活,促进Piezo1表达诱发血管舒张,这为高血压治疗提供了新见解。后续研究发现Piezo1可以调节内皮细胞中TRPV4通道的激活,并且Piezo1介导的TRPV4通道打开与FSS强度和作用时间相关[24]。本研究证明了流体剪切力可以介导Piezo1通道促进成骨细胞增殖。对成骨细胞分别以Yoda1和GsMTx4干预后,成骨细胞内Piezo1蛋白表达分别上调和下调,这与之前报道的结论相一致[25-27]。随后我们进一步检测Piezo1蛋白上下调后对成骨细胞增殖的变化,发现Piezo1蛋白表达与成骨细胞增殖呈正相关,说明Piezo1通道打开后释放Ca2+入胞,而这些递质具有促成骨作用。这是继前期关于流体剪切力介导Piezo1促进成骨细胞迁移后的进一步研究,也进一步丰富了流体力学对成骨细胞的作用机理。
细胞骨架重组指骨架蛋白重新排列形成应力丝的过程,应力丝的形成爱表细胞骨架重组良好、细胞形态正常[28,29]。通过鬼笔环肽染色可以观察到成骨细胞内的应力丝表现[30]。我们进一步探究了FSS及Piezo1对成骨细胞细胞骨架的影响。首先对成骨细胞加载流体剪切力显示相比未加力时细胞内应力丝阳性率明显升高,但使用Piezo1抑制剂GsMTx4后细胞内应力丝阳性率明显降低。这证明FSS促进成骨细胞细胞骨架重组,而抑制Piezo1表达则减弱这一作用,证明FSS可能介导Piezo1调控成骨细胞骨架重组。随后的研究中,我们发现,使用细胞骨架抑制剂细胞松弛素D(CytoD)后,成骨细胞内应力丝重组率明显降低,而对成骨细胞干预CytoD后,减弱了FSS促成骨细胞增殖的作用,表明细胞骨架重组与成骨细胞增殖呈正相关。但是,细胞骨架是通过何种途径调控成骨细胞增殖的机制仍不明确,这就有待后续更进一步的研究加以验证,若能完全解析外界刺激—离子通道—细胞骨架—信号通路之间的单向或相互作用机制,将对骨形成机制的完善填补空缺。
本研究未开展动物体内实验,对Piezo1介导的FSS通过细胞骨架对哺乳动物骨表型的影响未进行系统的研究,因此,存在一定的局限性,后续研究应将研究中心倾向于进行动物在体实验,并对Piezo1在动物体内的具体功能及作用机制进行深入研究。
综上所述,我们的研究完善了FSS对成骨细胞内Piezo1蛋白表达的最适作用条件,论证了Piezo1介导的Piezo1通过增强细胞骨架重排进而上调成骨细胞增殖,探究了机械应力对治疗骨质疏松的具体机制,阐释了Piezo1及细胞骨架可能会成为治疗骨质疏松的新靶点。
