免疫检查点抑制剂对非小细胞肺癌患者的影响
2022-09-09钟莉
钟莉
肺癌是目前临床上发病率和死亡率增长最快,对人类身体健康和生命安全威胁最大的恶性肿瘤之一[1]。根据流行病学的调查研究结果显示,非小细胞肺癌约占所有肺癌的85%[2]。目前主要以铂类为基础的化疗和分子靶向治疗作为临床上治疗非小细胞肺癌的主要方式,能有效提高患者的生存期,但多数采用标准的化疗和分子靶向治疗的患者,会出现恶心呕吐、骨髓抑制、皮疹等各种不良反应[3],加之治疗药物较为昂贵,给患者的家庭带来沉重负担,因此寻找一种新的方式治疗非小细胞肺癌成为临床上热议的焦点。近年来,免疫检查点抑制剂的研究取得突破性进展,特别是程序化死亡因子-1(PD-1)和程序化死亡因子受体-1(PD-L1)抑制剂,能将T细胞表面的PD-1和肿瘤细胞表达的PD-L1结合,起到一定的抑制作用,从而有效增强T细胞的增殖能力,提高肿瘤细胞的免疫应答效应,在抗肿瘤治疗方面具有一定的积极作用[4]。因此本次研究将探讨免疫检查点抑制剂对非小细胞肺癌患者外周血生物标志物水平的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2019年5月-2020年4月龙岩市第二医院收治的70例非小细胞肺癌患者为研究对象,纳入标准:(1)符合文献[5]《中华医学会肺癌临床诊疗指南(2018版)》中非小细胞肺癌的诊断标准;(2)首次接受治疗;(3)无自身免疫性疾病。排除标准:(1)心、肝、肾等重要器官患有严重的功能障碍;(2)意识不清晰或患有精神类疾病,无法进行简单的沟通交流,无法配合完成试验;(3)有心脑血管等原发性疾病;(4)病历资料不全。按照随机数字表法将其分为观察组和对照组,各35例。观察组男21例,女14例;年龄45~58岁,平均(51.51±7.72)岁;病程1~9年,平均(5.11±0.77)年;TNM分期:Ⅱ期11例,Ⅲ期15例,Ⅳ期9例。对照组男22例,女13例;年龄44~59岁,平均(51.59±7.73)岁;病程2~8年,平均(5.08±0.76)年;TNM分期:Ⅱ期12例,Ⅲ期13例,Ⅳ期10例。两组患者一般资料比较,差异无统计学意义(P>0.05)。本次试验已由本院医学伦理委员会获准执行,且患者本人或家属同意并签署知情同意书。
1.2 方法
对照组给予TP化疗方案:d2,将150 mg/m2紫杉醇注射液(Hospira Australia Pte Ltd,注册证号H20150350,规格:30 mg/支)溶于 500 ml生理盐水中静脉滴注;d3,卡铂注射液(齐鲁制药有限公司,国药准字H20020180,100 mg/支),其中卡铂用量计算方式,为卡铂剂量(mg)=药时曲线下面积(AUC)(取AUC=5)×[肌酐清除率(ml/min)+25],21 d为1个周期。观察组则采用增加免疫检查点抑制剂进行治疗:根据患者的病情,给予PD-1抑制剂,d1,静脉滴注3 mg/kg纳武利尤单抗注射液(Bristol-Myers Squibb Holdings Pharma, Ltd.Liability Company,注册证号 S20180015,规格:10 mg/ml)、2 mg/kg帕博利珠单抗注射液(MSD Ireland,注册证号 S20180019,规格:100 mg/4 ml)、200 mg 卡瑞利珠单抗(苏州盛迪亚生物医药有限公司,国药准字 S20190027,200 mg/瓶)、200 mg 信迪利单抗注射液[信达生物制药(苏州)有限公司,国药准字S20180016,规格:100 mg(10 ml)/支 ],21 d 为 1个周期,直至患者疾病出现进展或不可接受毒性。两组均连续治疗6个周期。
1.3 观察指标及评价标准
1.3.1 临床疗效 根据文献[6]《实体瘤疗效评价标准(RECIST)指南1.1版》评估两组治疗2、4、6个周期后的临床疗效,CR:目标病灶消失;PR:病灶最大径之和至少减少30%;SD:病灶最大径之和有减少但未达到PR或有增加但未达PD;PD:病灶最大径之和至少增加20%或者出现新的病灶组织。治疗总有效率=(CR+PR+SD)/总例数×100%。
1.3.2 癌胚抗原(CEA)和血清细胞角蛋白19片段抗原(CYFRA21-1)水平 分别在两组治疗前和治疗后,抽取患者空腹静脉血5 ml,离心将上层血清分离,采用免疫透射比浊法进行检测,记录CEA、CYFRA21-1水平。
1.3.3 CD4+、CD8+水平 分别于两组患者治疗前后,抽取其空腹静脉血5 ml,进行离心处理,分离血清,采用流式细胞仪[型号:Attune NxT,生产厂家:赛默飞世尔科技(中国)有限公司]检测其血清CD4+、CD8+水平。
1.3.4 不良反应总发生率 分别记录两组不良反应发生情况,主要包括恶心呕吐、血小板减少、骨髓抑制、皮疹等。
1.4 统计学处理
应用SPSS 21.0软件进行数据处理,对两组CEA、CYFRA21-1、血清CD4+、CD8+水平等计量资料以(±s)描述,采用t检验比较;对两组不同时间治疗总有效率、不良反应发生率等计数资料以率(%)描述,采用χ2检验比较。P<0.05表示差异有统计学意义。
2 结果
2.1 两组不同时间临床疗效比较
观察组治疗2、4、6个周期后的治疗总有效率分别为37.14%、77.14%、88.57%,均高于对照组的31.43%、54.29%、65.71%,两组治疗4、6个周期总有效率比较差异有统计学意义(P<0.05),见表1。
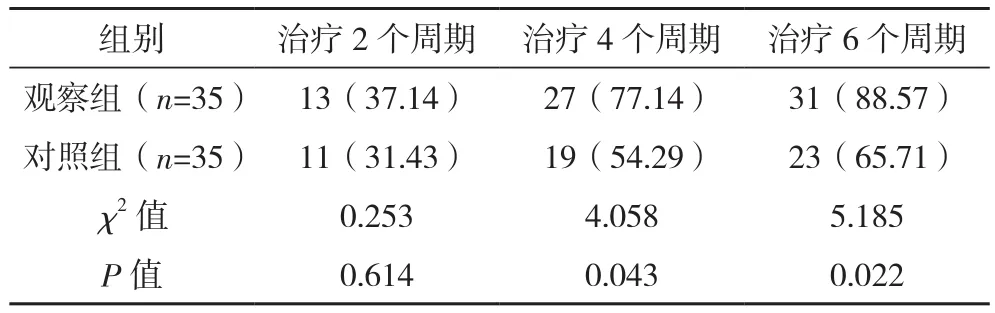
表1 两组不同时间临床疗效比较[例(%)]
2.2 两组治疗前后CEA、CYFRA21-1水平比较
治疗前两组CEA、CYFRA21-1水平比较,差异无统计学意义(P>0.05),治疗后,两组CEA、CYFRA21-1水平均有所下降,且观察组CEA、CYFRA21-1水平均明显低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组治疗前后CEA、CYFRA21-1水平比较[ng/ml,(±s)]
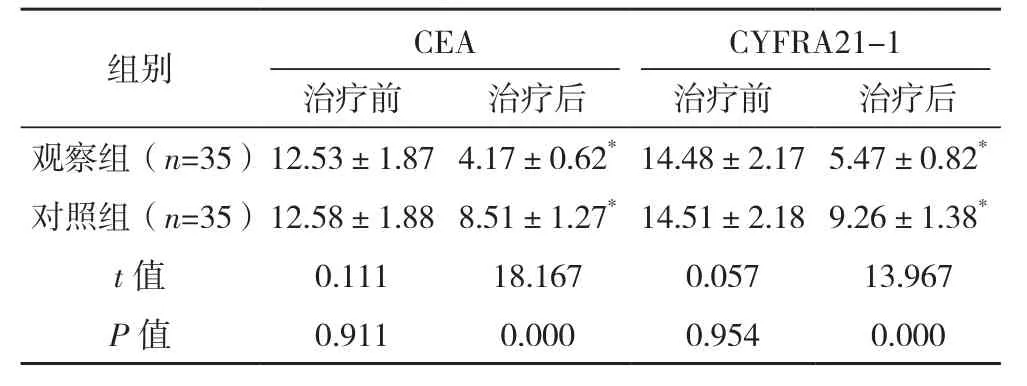
表2 两组治疗前后CEA、CYFRA21-1水平比较[ng/ml,(±s)]
*与本组治疗前比较,P<0.05。
治疗前 治疗后 治疗前 治疗后组别 CEA CYFRA21-1观察组(n=35)12.53±1.87 4.17±0.62*14.48±2.17 5.47±0.82*对照组(n=35)12.58±1.88 8.51±1.27*14.51±2.18 9.26±1.38*t值 0.111 18.167 0.057 13.967 P值 0.911 0.000 0.954 0.000
2.3 两组治疗前后血清CD4+、CD8+水平比较
治疗前两组血清CD4+、CD8+水平比较,差异无统计学意义(P>0.05),治疗后,两组血清CD4+水平均上升,CD8+水平下降,且与对照组比较,观察组血清CD4+水平较高,CD8+水平较低,差异有统计学意义(P<0.05),见表3。
表3 两组治疗前后血清CD4+、CD8+水平比较[%,(±s)]

表3 两组治疗前后血清CD4+、CD8+水平比较[%,(±s)]
*与本组治疗前比较,P<0.05。
治疗前 治疗后 治疗前 治疗后观察组(n=35) 36.21±5.43 52.14±7.82* 37.74±5.66 26.18±3.92*对照组(n=35) 36.37±5.45 44.77±6.71* 37.83±5.67 32.46±4.86*t值 0.123 4.132 0.066 5.950 P值 0.902 0.000 0.947 0.000组别 CD4+CD8+
2.4 两组不良反应发生情况比较
观察组不良反应发生率为11.42%,明显低于对照组的31.43%,差异有统计学意义(P<0.05),见表4。

表4 两组不良发应反生情况比较[例(%)]
3 讨论
本研究分析两种非小细胞肺癌患者的治疗措施,在该项临床随机对照试验中,结果显示采用免疫检查点抑制剂进行治疗在调节肿瘤标志物CEA、CYFRA21-1水平,降低患者不良反应发生率,提高患者生存率方面临床效果显著,从本研究成果出发,可初步认为与PD-1/PD-L1抑制剂能将T细胞表面的PD-1和肿瘤细胞表达的PD-L1结合,起到一定的抑制作用,从而有效增强T细胞的增殖能力,有效发挥其免疫清除作用有关。
目前临床上有关非小细胞肺癌的发病机制尚未完全明确,但临床研究显示,其发生和发展的过程受诸多因素的共同影响,其中肿瘤、癌细胞的复发、转移时由多种因素、多阶段等综合作用,同时经过较长时间发展所产生的[6]。目前临床上对非小细胞肺癌的控制主要是通过抑制癌细胞的分裂、增殖,因此化疗是较为常用的治疗方式,但化疗周期长,且不良反应较多,再加上非小细胞癌容易转移,具有复发率较高、治愈率较低等特点,故亟待寻找一种新的方式治疗非小细胞肺癌[7]。
PD-1/PD-L1是目前临床上应用较为广泛的免疫检查点抑制剂,为治疗癌症提供了新的方式[8]。且部分临床研究将PD-L1表达作为临床疗效预测生物标志物之一,PD-1/PD-L1作为癌症治疗过程中的关键靶点,为癌症患者的治疗提供了有力保障,故本次研究中观察组治疗4、6个周期后的临床疗效明显优于对照组(P<0.05),提示采用免疫检查点抑制剂对非小细胞肺癌患者进行治疗,临床效果显著,可迅速达到治疗的目的,这与陈冠璇等[9]研究结果相符。
CYFRA21-1主要用作肿瘤标志物,其水平的变化和非小细胞肺癌的分期和肿瘤组织的大小有密切关联,在非小细胞肺癌的诊断中具有较大意义,同时对患者的CYFRA21-1水平进行检测,能有效评价患者的治疗效果。而CEA是一种具有人类胚胎抗原特性的酸性糖蛋白,存在于内胚层细胞分化而来的癌症细胞表面,是细胞膜的结构蛋白,肿瘤组织的发生和发展与CEA水平表达有密切关联[10]。本次研究结果显示,治疗后,观察组CEA、CYFRA21-1水平均明显低于对照组(P<0.05),究其原因这可能是因为PD-1是一种免疫抑制分子,属于免疫球蛋白超家族。在健康人群中,PD-1的功能是与T细胞表面的PD-L1结合,从而有效抑制T细胞激活,避免因T细胞的过度激活引起人体自身免疫性疾病的发生[11]。而肿瘤细胞则也利用了这一特性以此来降低免疫细胞的活性,免疫细胞的杀伤作用因此被阻断。非小细胞肺癌患者机体免疫力的下降,使癌细胞大量增殖,癌细胞上的PD-L1蛋白与T细胞上的PD-1蛋白进行结合,对T细胞的增殖、细胞因子的分泌等起到抑制作用。而PD-1/PD-L1免疫抑制剂可特异性地对PD-1和PD-L1的结合进行阻断,重新对T细胞进行激活,使其恢复对癌细胞的杀伤作用,从而降低CEA、CYFRA21-1等肿瘤标志物水平。这与江美林等[12]研究结果相符,提示对非小细胞肺癌患者给予免疫检查点抑制剂治疗,能有效抑制癌组织的发生和发展。T细胞在人体免疫系统中具有十分重要的意义,其中CD4+是调控免疫反应重要的枢纽细胞,对细胞免疫功能具有明显的辅助作用;而CD8+主要作用则是抑制细胞毒作用和免疫作用[13]。有报道称,通过对肺癌患者T淋巴细胞亚群水平予以调控,在提高患者免疫功能方面具有积极意义[14]。本次研究结果显示,治疗后与对照组比较,观察组血清CD4+水平较高,CD8+水平较低(P<0.05),提示免疫检查点抑制剂治疗非小细胞肺癌患者,能对其T淋巴细胞亚群水平进行有效调控,改善患者免疫功能。这可能是因为拮抗PD-1和PD-L1之间的结合,对负向调控信号进行阻断,能有效增强人体内源性的抗肿瘤免疫效应,这与李龙等[13]研究结果相符。徐洁等[15]、杨勇等[16]在报道中称,免疫检查点抑制剂在治疗非小细胞肺癌患者的过程中,部分患者可能会出现皮疹的情况,但与常规的化疗方式比较,总体不良反应发生率较低,安全性较高,这与本次研究中观察组不良反应发生率较低的结果相符。
综上所述,将免疫检查点抑制剂应用于非小细胞肺癌患者的治疗中,临床效果显著,不仅能有效调节肿瘤标志物CEA、CYFRA21-1水平,抑制癌组织生长,提高人体免疫功能,同时在降低不良反应发生率方面具有积极意义,值得在临床推广和应用。
