子宫内膜间质肉瘤26例临床病理分析
2022-09-08汪向明刘银华梅晶晶
汪向明,黄 曦,顾 倩,刘银华,梅晶晶,李 硕
(1.皖南医学院第一附属医院 弋矶山医院 a.病理科;b.妇产科,安徽 芜湖 241001;2.皖南医学院 病理解剖学教研室,安徽 芜湖 241002)
子宫内膜间质肉瘤(endometrial stromal sarcoma,ESS)是间叶源性恶性肿瘤,瘤细胞来自子宫内膜间质细胞,其发生率较低,约占子宫肉瘤的7%~25%,占妇科生殖道恶性肿瘤的0.2%~1%[1]。2020年第5版WHO女性生殖系统肿瘤分类中,将子宫内膜间质肿瘤(endometrial stromal tumours,ESTs)分为4组:子宫内膜间质结节(endometrial stromal nodule,ESN)、低级别子宫内膜间质肉瘤(low-grade endometrial stromal sarcoma,LG-ESS)、高级别子宫内膜间质肉瘤(high-grade endometrial stromal sarcoma,HG-ESS)和未分化子宫肉瘤(undifferentiated uterine sarcoma,UUS)[2]。本文回顾性分析我院26例ESS的临床病理特征、诊断、鉴别诊断及预后,进一步加深对本病的认识。
1 资料与方法
1.1 临床资料 收集2008年2月~2021年10月在弋矶山医院手术治疗的26例ESS(LG-ESS 18例、HG-ESS 8例)。临床病理资料均从医院电子病历资料库中获得。病理切片均经2位高年资病理医师阅片确诊。电话随访截止时间为2021年11月16日。
1.2 方法
1.2.1 HE制片观察 所有ESS组织标本均经10%中性福尔马林固定,常规石蜡包埋,切片厚4 μm,苏木素伊红(HE)染色,显微镜下观察。
1.2.2 免疫组化方法 免疫组化染色采用Envision两步法。应用的抗体包括AE1/AE3、CD10、h-caldesmon、Desmin、SMA、Ki-67。免疫组化染色步骤按说明书进行操作,用PBS代替一抗为阴性对照,以已知阳性片为阳性对照。
1.2.3 试剂 鼠抗人单克隆抗体AE1/AE3、鼠抗人单克隆抗体CD10、鼠抗人单克隆抗体Desmin、鼠抗人单克隆抗体SMA、鼠抗人单克隆抗体Ki-67、二步法鼠抗人免疫组化试剂盒(北京中杉生物技术开发公司)。
1.2.4 结果判定 AE1/AE3、Desmin、h-caldesmon和SMA表达:以细胞质出现棕黄色细颗粒为阳性表达。CD10表达:以细胞膜出现棕黄色细颗粒为阳性表达。Ki-67表达:以细胞核出现棕黄色细颗粒为阳性表达。
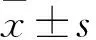
2 结果
2.1 ESS患者年龄分布与临床分期情况 26例ESS患者中绝经8例,未绝经18例,年龄(50.81±11.51)岁。按FIGO(2014)临床分期,26例ESS病例中Ⅰ期17例,Ⅱ期3例,Ⅲ期4例,Ⅳ期2例。见表1。

表1 ESS患者年龄分布及临床分期情况
2.2 ESS患者临床表现 18例LG-ESS中异常阴道出血4例,月经紊乱5例,盆腔包块6例,腹痛1例,痛经伴月经量增多2例;8例HG-ESS中异常阴道出血5例,盆腔包块2例,腹痛1例。26例ESS患者中25例行彩超检查,22例患者提示子宫壁有实性较低或较高回声,2例内膜增厚,1例子宫不规则增大,1例患者因腹痛行肠镜检查提示结肠癌可能。
2.3 治疗方案 26例ESS患者均在我院行手术治疗。手术治疗的主要方式为全子宫+双附件切除术+盆腔淋巴结清扫术。术后行化疗13例,其中1例为化疗加靶向治疗,2例为化疗加服用中药辅助治疗;化疗方案主要是吡柔比星+异环磷酰胺联合用药,化疗疗程3~6个疗程。
2.4 随访情况 门诊定期随访,个别转当地医院治疗者进行电话随访,随访时间20 d~159个月。18例LG-ESS中2例失访,8例HG-ESS中1例失访。
2.5 患者的生存情况分析 23例ESS患者术后1、3、5年的总体生存率分别为95.7%、91.3%、91.3%。Ⅰ+Ⅱ期与Ⅲ+Ⅳ期ESS患者术后1、3、5年的总体生存率差异均无统计学意义(Log Rankχ2=0.341,P=0.559)。LG-ESS患者Ⅰ+Ⅱ期与Ⅲ+Ⅳ期术后1、3、5年的总体生存率差异均无统计学意义(Log Rankχ2=1.992,P=0.158),而HG-ESS患者Ⅰ+Ⅱ期与Ⅲ+Ⅳ期术后1、3、5年的总体生存率差异有统计学意义(Log Rankχ2=4.654,P=0.031)。见表2。

表2 23例ESS患者生存情况分析[n(%)]
2.6 ESS患者的淋巴转移与复发情况分析 26例ESS病例中12例行盆腔淋巴结清扫术,均未发现淋巴结转移;1例术后2年内肿瘤复发而死亡,1例术后19个月肿瘤复发。1、2、3年内肿瘤复发率分别为4.3%(1/23)、13.0%(3/23)、13.0%(3/23)。
2.7 病理检查 26例ESS患者中肿瘤位于子宫内21例,另5例ESS患者肿瘤同时位于宫腔内及子宫外。肿瘤直径0.5~24.0 cm,切面灰白色到黄褐色,鱼肉状,质地柔软、细腻,部分患者肿瘤出现出血、坏死。光镜检查显示,LG-ESS瘤细胞呈短梭形,围绕小动脉呈“漩涡状”排列(图1A),胞质稀少,细胞轻度异型性,核分裂像0~4个/10HPF,瘤细胞向肌层呈“舌状”浸润生长方式(图1B);其中2例LG-ESS伴有平滑肌分化。HG-ESS瘤细胞呈高级别圆形细胞和短梭形细胞以不同比例混杂组成,瘤细胞异型性明显,染色质空泡状或颗粒状,可见核仁,核分裂像10~30个/10HPF(图1C、D),其中1例HG-ESS伴有平滑肌分化。免疫表型显示,LG-ESS与HG-ESS组AE1/AE3、CD10、h-caldesmon、Des、ER阳性表达率差异均无统计学意义(P>0.05),LG-ESS组织PR阳性表达率高于HG-ESS组织,差异有统计学意义(P<0.01)(表3);LG-ESS患者中Ki-67阳性表达率低于HG-ESS患者,差异有统计学意义(Z=3.846,P<0.001)。LG-ESS组织和HG-ESS组织CD10表达见图1E、F,LG-ESS组织h-caldesmon表达见图1G。

A.LG-ESS肿瘤细胞呈均匀的椭圆形或短梭形,瘤细胞类似于增生期子宫内膜间质细胞,瘤细胞围绕小动脉呈“漩涡状”排列(×40);B.LG-ESS肿瘤细胞呈“舌状”浸润子宫肌层(×100);C.HG-ESS肿瘤细胞在肌层呈浸润性生长方式(HE,×100);D.HG-ESS肿瘤细胞异型性明显,染色质空泡状或颗粒状,可见核仁,核分裂像易见(HE,×400);E.LG-ESS肿瘤细胞CD阳性(Envision两步法,×400);F.HG-ESS肿瘤细胞CD阳性(Envision两步法,×400);G.LG-ESS肿瘤细胞h-caldesmon阴性,平滑肌细胞h-caldesmon阳性,并显示瘤细胞在平滑肌组织中呈浸润性生长方式(Envision两步法,×400)。

表3 LG-ESS组织和HG-ESS组织免疫组化阳性表达情况表[n(%)]
3 讨论
ESS是比较少见的子宫间质肿瘤,主要发生于绝经期后妇女,青少年少见,发病年龄40~55岁[3],临床表现主要为子宫增大、腹痛、月经紊乱或不规则阴道流血。因缺乏特异的影像学和临床表现,常被误诊为良性实体肿瘤如平滑肌瘤,通常是在手术后病理诊断[4]。本组26例ESS患者年龄(50.28±11.28)岁,其中HG-ESS患者年龄较LG-ESS患者年龄大,与文献报道的发病年龄较一致。
ESS是来自子宫内膜间质细胞的恶性肿瘤[5]。LG-ESS瘤细胞呈均匀的椭圆形或短梭形,瘤细胞类似于增生期子宫内膜间质细胞[6],细胞异型性不明显;瘤细胞围绕小动脉呈“漩涡状”排列,并呈“舌状”浸润到肌层生长方式。瘤细胞可发生纤维化,并向平滑肌、性索、上皮性腺管、上皮样分化[7-8]。HG-ESS瘤组织呈浸润性、膨胀性生长方式,瘤组织内常见坏死,淋巴管血管常见瘤栓;瘤细胞呈高级别圆形细胞和短梭形细胞以不同比例混杂组成,瘤细胞异型性明显,染色质空泡状或颗粒状,核仁明显,核分裂像20~30个/10HPF[9]。
LG-ESS瘤细胞表达CD10、ER、PR、IFITM1,可以局灶表达cyclin D1。向平滑肌分化的,可以表达Desmin、h-caldesmon;向性索分化的,可以表达α-inhibin、calretinin、WT-1、CD99、melan-A[10]。HG-ESS瘤细胞表达CD10、ER、PR、cyclin D1。伴有ZC3H7B-BCOR基因融合的HG-ESS,50%的病例表达BCOR。LG-ESS存在JAZF1-SUZ12、JAZF1- PHF1等基因融合[3,11]。HG-ESS有ZC3H7B-BCOR、BCOR ITD、EPC1-BCOR等融合基因。
本病需与以下疾病相鉴别。①子宫内膜间质结节。细胞形态学类似于LG-ESS瘤细胞,瘤组织与周围组织境界清楚,罕见肿瘤组织呈局灶性不规则突起,但是数量<3个,其深度≤3mm。②富于细胞性平滑肌瘤。瘤细胞数量明显增多,核异型性不明显。瘤细胞desmin和h-caldesmon阳性。③平滑肌肉瘤。瘤组织与周围组织境界不清,呈浸润性生长方式,其内可见凝固性坏死;瘤细胞呈梭形,异型性明显。瘤细胞表达desmin、h-Caldesmon,CD10阴性或弱阳性。④血管周上皮样细胞肿瘤(PEComa)。瘤细胞呈上皮样形态,细胞核圆形至卵圆形,核仁小而明显,病理性核分裂像罕见。瘤细胞围绕血管呈放射样排列。瘤细胞表达HMB-45、Melan-A、MiTF、SMA,不表达Desmin、h-caldesmon、CD10。⑤类似卵巢性索肿瘤的子宫肿瘤。肿瘤边界清楚,瘤细胞排列呈索状、巢状、岛状、小梁或小管状,细胞质稀少或丰富,细胞核呈卵圆形,瘤细胞异型性不明显。瘤细胞表达CK、WT-1、CD56、CD99。
目前,ESS的治疗手段主要包括外科手术、化疗、放疗和激素治疗。手术主要是全子宫+双侧附件±盆腔淋巴结清扫术,一般术中留取盆腹腔冲洗液行病理细胞学检查,用来评估病情及判断预后,有一定的作用。对于淋巴结清扫的作用尚不明确,有学者认为ESS患者,若出现临床可疑的淋巴结转移、子宫外腹腔盆腔转移灶及肿瘤进展较迅速的患者应行淋巴结切除术;对于晚期及HG-ESS患者预后差,术后生存期短,行淋巴结清扫术意义不大。Zhang等[9]在40例HG-ESS患者研究中,15例患者进行了淋巴结清扫术,其中3例患者有淋巴结转移。16例患者接受了大网膜切除术,有4例患者发生了大网膜转移,经分析,淋巴结或大网膜转移与预后没有相关性(P>0.05),淋巴结清扫和/或大网膜切除并不能改善预后。本组26例ESS病例,其中行盆腔淋巴结清扫术12例,均没有发现淋巴结转移。虽然手术是ESS治疗的重要手段,但ESS有早期血行转移的可能,手术后行化疗可以减少肿瘤复发和降低肿瘤转移的风险,所以多主张手术+化疗。
本组23例ESS病例,术后1、3、5年的总体生存率分别为95.7%、91.3%、91.3%,其中HG-ESS患者Ⅰ+Ⅱ期与Ⅲ+Ⅳ期术后1、3、5年的总体生存率差异有统计学意义(P<0.05)。说明HG-ESS患者分期越晚,预后越差。总之,HG-ESS预后不好,一般发现时已经是进展期(Ⅲ期或Ⅳ期)[12],5年生存率相关只有33%,而LG-ESS肿瘤生长缓慢,预后良好,5年生存率可以达到91%[6,13]。
