BioMind影像辅助诊断软件在颅内肿瘤磁共振诊断中的应用
2022-09-08王伟徐振宇杨冠英李悦杨冰洋高明勇
王伟,徐振宇,杨冠英,李悦,杨冰洋,高明勇*
(1.佛山市第一人民医院 影像中心,广东 佛山 528010;2.佛山市第一人民医院 转化医学研究院,广东 佛山 528010;3.北京天医智医疗技术服务有限公司 临床科研部,北京 101318;4.大连医科大学 附属第一医院,辽宁 大连 116000)
近年来全球脑肿瘤发病率呈明显增长趋势[1-2],2020年我国前10位癌症数据统计示脑肿瘤死亡率位居第8位[3]。核磁共振影像(MRI)检查是目前评估颅内肿瘤类型和分级最常用的影像学检查方法,提高治疗前MR影像诊断的准确率,对后续的治疗策略的制定和患者预后评估具有重要意义。随着人工智能技术(artificial intelligence,AI)的蓬勃发展,深度学习系统(deep learning system,DLS)在影像诊断中的应用日渐广泛[4-7]。本次研究将探讨DLS在颅内肿瘤MRI诊断中的作用。
1 材料与方法
1.1 一般资料
该研究获得佛山市第一人民医院医学伦理委员会批准,审批号“L[2022]第8号”,回顾性分析该院2018年1月~2021年11月经手术病理证实的颅内肿瘤患者共455例。纳入标准为:病例MR影像资料包括T1WI、T2WI和增强T1WI横断位;肿瘤病理类型已包括在DLS数据库内。排除标准:手术干预(包括活检)、肿瘤复发。
1.2 DLS系统及设备
采用北京安德医智科技有限公司研发的BioMind人工智能影像辅助诊断软件。该产品核心为“注意力密集网络”深度学习模型。软件算法结构分为以U-Net为基础的“分割网络”及以DenseNet为基础的“分类网络”两个部分;其中分割网络包含多个编码器、多个解码器和一个输出卷积器;分类网络包含5个密集卷积器和两个全连接层;两个网络之间搭建“注意力连接”来传递特征信息;因此整个结构称为“注意力密集网络”。算法的输入为患者横断为MR图像序列(T1WI,T2WI,增强扫描),每个序列图像大小为24×256×256;算法的输出为肿瘤分割图和肿瘤类别概率。其训练集来自北京天坛医院颅内肿瘤的MR影像数据,所采用的磁共振设备包括GE、Philips、Siemens和联影的1.5T、3.0T MR,入组数据涵盖了不同年龄、不同性别的颅内病变患者的MR影像,DLS数据库的病变类型共26种包括:表皮样囊肿、神经鞘瘤、脊索瘤、听神经瘤、胶质瘤、星形细胞瘤、胶质母细胞瘤(glioblastoma,GBM)、室管膜瘤、髓母细胞瘤、血管外皮细胞瘤、垂体瘤、颅咽管瘤、颈静脉球瘤、淋巴瘤、脑膜瘤、血管母细胞瘤、转移瘤、节细胞瘤、生殖细胞瘤、畸胎瘤、胚胎发育不良性神经上皮瘤、脉络丛乳头状瘤、动静脉畸形、海绵状血管畸形、中枢神经细胞瘤、小脑发育不良性节细胞瘤。
所使用的后处理工作站配置为:CPU Intel Xeon Silver 4210R、内存32GDDR4 RECC2933*4、运算卡NVIDIA RTX 3090 24GB、硬盘1.92T STAT3 SSD*3、操作系统ubuntu 20.04.2 Server。
1.3 MRI和病理检查
采用3.0T MR机(Discovery MR 750W,GE公司,美国),标准头颅线圈,常规行横轴位T1WI、T2WI、T2-FLAIR、扩散加权成像(diffusion weighted imaging,DWI)及增强T1WI横轴位、冠状位及矢状位。T1WI:TR 2 010 ms、TE 24 ms;T2WI:TR 6 853 ms、TE 116 ms;DWI:b值1 000、TR 4 100 ms、TE 77.20 ms;FOV 240 mm×240 mm、层厚5 mm、层间隔1 mm。增强扫描采用对比剂钆双胺注射液(GE Healthcare Ireland Limited,爱尔兰),静脉注射速率1 mL/s、剂量0.1 mmoL/kg。由放射科副主任医师职称以上的诊断医师对图像进行判读并提供第一诊断和包含一个鉴别诊断在内的综合诊断。
标本行常规HE染色和免疫组化染色,由1名病理科副主任医师分析病理切片并诊断。
1.4 统计学方法
采用SPSS 25.0统计软件进行数据分析,计量资料采用()描述,计数资料用例数(%)表示。采用Kappa一致性检验评估DLS和放射科医生诊断的一致性。对于准确率的比较,组间差异采用McNemar配对卡方检验,其中对于GBM和星形细胞瘤使用Fisher精确检验(样本量小于40),P<0.05说明差异有统计学意义。
2 结果
2.1 一般资料比较
纳入研究共283例,排除共172例,其中包括肿瘤病理类型未包括在DLS数据库内的13例,手术干预或复发性肿瘤17例,MRI资料不全共142例。病例平均年龄是(53.55±14.34)岁,男性占52.9%,肿瘤类型如图1所示。

图1 不同类型肿瘤的例数和比例Figure 1 Number of cases and percentage of different types of intracranial tumors
2.2 DLS与放射科医生诊断一致性比较
不论第一诊断还是综合诊断,DLS和放射科医生均存在一致性(Kappa值分别为0.331和0.263,P=0.000)。
2.3 DLS与放射科医生诊断准确率比较
在总体肿瘤中,DLS和放射科医生第一诊断准确率差异无统计学意义(83.4%vs86.9%,P=0.194),总体诊断准确率差异无统计学意义(91.9% vs 90.8%,P=0.728);在脑膜瘤(160例)中,DLS第一诊断准确率低于放射科医生(91.2% vs 97.5%,P=0.021),诊断准确率差异无统计学意义(96.2% vs 98.8%,P=0.728);在垂体腺瘤(47例)中,DLS和放射科医生第一诊断准确率差异无统计学意义(95.7% vs 100%,P=0.500),诊断准确率差异无统计学意义(95.7%vs 100%,P=0.500);在GBM(30例)中,DLS和放射科医生第一诊断准确率差异无统计学意义(76.7%vs63.3%,P=0.372),诊断准确率DLS高于放射科医生(100% vs 76.7%,P=0.016)。在星形细胞瘤(22例)中,DLS第一诊断准确率高于放射科医生(45.4% vs 40.9%,P=0.027),诊断准确率高于放射科医生(63.6% vs 45.4%,P=0.024)。
3 讨论
近十几年随着AI的发展,计算机辅助诊断(computer-aided diagnosis,CAD)开始被应用于颅内肿瘤影像诊断研究并取得了令人振奋的结果。MRI检查是目前评估颅内肿瘤类型和分级最常用的影像学检查方法[8],近年随着算法和算力的快速发展,已经实现多模态MRI海量参数的快速提取和特征分析(如形态、纹理和信号强度),诊断准确性有望进一步得到提升[9-11]。虽然目前国内外诸多实验室的研究结果令人鼓舞,但商用化的颅内肿瘤智能辅助影像诊断软件尚未普及,本研究采用已获得国家药监局颁发的人工智能辅助诊断类三类医疗器械注册证的BioMind人工智能影像辅助诊断软件,评估此商用软件的临床应用价值。
Georgiadis[12]利用单模态-增强T1WI的纹理特征,采用改进的概率神经网络模型,鉴别胶质瘤和脑膜瘤的准确性达到81.2%。Mohsen[13]基于T2WI图像,采用多种基于神经网络的深度学习模型对正常脑、胶质瘤、肉瘤和肺癌转移瘤进行分类研究,平均分类率最高达到96.97%。Kunimatsu[14]采用T1WI增强后纹理特征的支持向量机(support vector machine,SVM)鉴别GBM和淋巴瘤,其预测准确性为75%。Kevin[15]基于增强T1WI上信号强度相关的量化数据,采用提取全局和局部信号强度特征的CAD系统可较好的区分GBM和低级别胶质瘤并提高了放射科医生的诊断水平。Hie[16]基于增强T1WI、T2WI、T2液体衰减反转恢复图像,采用放射组学的鉴别非典型GBM和淋巴瘤,发现CAD较放射科医生具有更高的准确率。
除了常规序列(T1WI、T2WI和增强扫描),其他新型功能MR技术的发展也为AI准确性提高提供了数据支持。Server[17]通过构建包含肿瘤表观扩散系数(apparent diffusion coefficient,ADC)平均值、最大值以及瘤周波谱等参数的模型预测胶质瘤分级,准确性达到91.5%。Wang[18]基于肿瘤强化区域的ADC值、弥散各向异性分数(fractional anisotropy,FA)值以及瘤周水肿部位的局部脑血流量(regional cerebral blood volume,rCBV)值,应用层次树分类网络技术较好的区分了GBM与非GBM(转移瘤和淋巴瘤),其曲线下面 积(area under curve,AUC)值 为 0.938。Tsolaki[19]基于瘤周组织波谱数据和rCBV数据,采用SVM鉴别GBM和转移瘤获得高达98%的准确率。Svolos[20]基于瘤周FA值和rCBV,采用模式识别技术区分GBM和孤立性转移瘤,准确率高达96%。Shai[21]基于灌注、扩散张量参数图和形态学数据,采用留一交叉验证的SVM用于二元分类和特征选择,结果显示对GBM、转移瘤、脑膜瘤和淋巴瘤的分类准确率分别为95.7%、92.7%、97%和91.5%。
本研究采用BioMind人工智能影像辅助诊断软件回顾性分析了283例颅内肿瘤的数据,发现DLS第一诊断的准确性为83.4%,而包括鉴别诊断在内的综合诊断的准确性为91.9%,与放射科医生的准确性差异无统计学意义,充分显示了目前AI在脑肿瘤MRI分析中的价值(图2)。但针对具体肿瘤类型,DLS和放射科医生的准确率显示出不同程度的统计学差异。在脑膜瘤诊断方面放射科医生表现要优于DLS,可能是由于脑膜瘤的影像特征明显且发病率较高,医生在日常工作中积累了丰富的经验。而在星形细胞瘤和GBM方面,DLS表现更好,但对于星形细胞瘤不论DLS还是医生的第一诊断准确率均小于50%,说明此类型肿瘤影像表现多样,需要进一步提取特征性的影像参数和指标。

图2 BioMind诊断正确的病例界面展示Figure 2 Case interface display of BioMind correct diagnosis
在数据方面,本软件基于的是T1WI、T2WI和T1增强的横断位MRI,上述序列均是医院进行颅内肿瘤检查的常规序列,并且由于无需进行多平面成像,因此可减轻扫描人员的工作负担,增加患者的流通量,具有较高的可接受度和较好的推广性。在算法方面,本软件以U-Net和DenseNet为基础,此为目前国际上流行和通用的算法,相较于本软件研发医院-北京天坛医院内部测试74.91%准确率,在我院研究中获得了更高的准确率,证明算法具有较好的鲁棒性和可移植性。在算力方面,采用主流工作站配置,软件可以在3 min之内给出诊断报告,较人工诊断具有更高的诊断效率。此外本软件还可以提供发病部位、病灶体积等临床治疗中有价值的附加信息。
在研究中,DLS的局限性也需要关注,比如未能充分利用MR多平面成像的优势,因此漏掉了一些横断面难以显示的病灶;偶尔会出现难以解释的低级错误(图3),需要加大对DLS可解释性的研究;DLS对于肿瘤的分类具有滞后性:本系统采用的肿瘤分类标准仍是较陈旧的WHO标准,而最新的2021版分类标准强调了分子诊断的重要性。因此在未来很长时间内AI的发展需要医工人员合作引导。
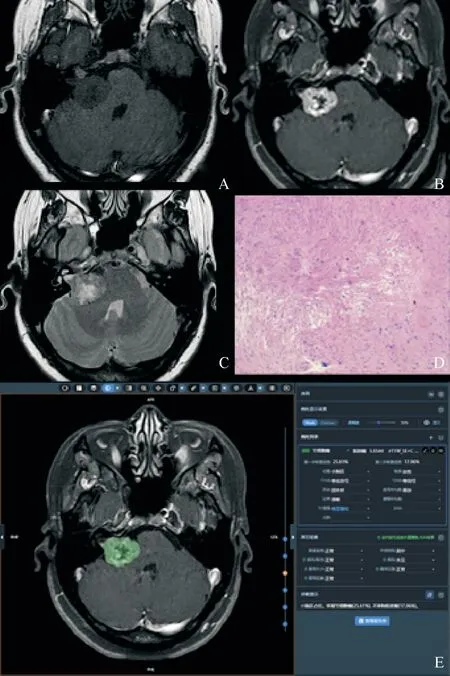
图3 BioMind诊断错误的病例界面展示Figure 3 Case interface display of BioMind error diagnosis
本研究显示DLS用于颅内肿瘤磁共振诊断具有较好的准确率,可以辅助放射科医生提高工作效率和诊断的准确率,具有较好的推广应用前景。
作者贡献声明
王伟:项目具体实施、设计;徐振宇:数据整理;杨冠英:影像资料判读;李悦:统计学分析;杨冰洋:AI软件操作及结果整理;高明勇:提出研究思路和框架。
利益冲突声明
本研究由北京天医智医疗技术服务有限公司提供统计方法和软件使用的指导;未受天医智及其他第三方资助;相关单位或个人不存在潜在利益冲突。
