人体肝组织全场光学相干层析成像及用于筛选病变样本的参数研究
2022-09-08高万荣
牟 宁,高万荣
(1.无锡职业技术学院 物联网技术学院,江苏 无锡 214121;2.南京理工大学 电子工程与光电技术学院,江苏 南京 210094)
癌症问题严重威胁着人类的身体健康。根据国家癌症中心的统计数据,我国每年新发肿瘤病例约为393万例,死亡约234万人;近10年来,恶性肿瘤发病率每年保持约3.9%的增幅,死亡率年增幅约2.5%,癌症负担持续上升[1]。研究癌症的早期筛查、手术间的快速诊断以及准确确定疾病的性质等技术具有极其重要的应用价值。
在癌症的手术治疗实践中,基于冰冻和石蜡切片的病理学分析是进行肿瘤诊断的主要方法,但此方法也有一些明显的局限性。在组织处理过程,即冰冻、切片和染色时会导致组织形貌的改变,可能造成假性诊断;同时,组织处理过程耗时,特别是冰冻切片分析中病理诊断反馈的时间相对较长,直接导致手术时间的延长;另外,对非常小的肿瘤,或需要对样品进行进一步生化分析时,不宜采用冰冻切片分析进行疾病诊断。
为了克服常规冰冻切片组织病理学诊断中组织处理过程所带来的问题,研究人员开始寻找不需要对组织进行处理就可实现病理诊断的方法,即研究可对新鲜组织(未经染色、未经冰冻、未经切片)进行组织学水平的高质量成像的技术。在这方面的研究中,各种光学成像技术因其分辨率高、成像速度快、非接触和非侵入特性[2],越来越受研究者的重视。20世纪90年代,麻省理工学院的Fujimoto团队首创光学相干层析术(Optical coherence tomography,OCT)[3],这一技术具有虚拟光学切片能力,利用生物组织内生的光学特性进行高分辨率成像。全场光学相干层析术(Full-field optical coherence tomography,FFOCT)[4]是光学相干层析术的一个重要分支,通过同时测量由全视场内的显微结构后向散射回来的光线,无需逐点扫描即可获得某一深度的光学断层图像。全场光学相干层析术的高成像速度在离体成像时可缩短组织样本临床诊断时所需的成像时间,而在体成像时则可减少活体组织细微运动对图像质量的影响[5]。相较于X射线、核磁共振等毫米级别分辨率成像手段[6],光学相干层析在较好地实现非侵入和非接触成像的同时,还能获得更高的分辨率。
近年来,许多学者都在致力于将FFOCT应用于临床癌症诊断相关工作。对人体结肠组织[7]、乳腺组织[8]、脑部组织[9]以及肝组织[10]等进行FFOCT成像,通过组织剖面图,可以较好地区分正常和病变的不同组织形态,以及判定不同肿瘤组织学亚型。以上大多数的研究主要基于病理学专家的直接目视观测结果,很大程度上依赖于医师的主观经验,另外在病变早期,组织相应的形态变化有限,难以直接目视观测。因此,对FFOCT成像结果的量化研究也逐渐成为新的研究热点[11-13],定量分析数据不仅可以为病理学专家的诊断提供新的依据,而且为这一过程往高精度的自动化发展提供了新的方向。
1 试验系统和组织样本
搭建的全场光学相干层析成像系统的原理图如图1所示。

图1 全场光学相干层析成像系统原理图
系统基于Linnik干涉显微镜,使用卤素灯(12 V/20 W,光谱宽度200 nm,中心波长550 nm)作为光源,采用水浸显微物镜(NA=0.5)。宽带光源经科勒照明系统后,被分光棱镜分光成参考臂光束和样品臂光束,分别投射在两个完全相同的显微物镜的后焦平面上,实现对样品的均匀照明。参考镜置于锆钛酸铅压电陶瓷(Piezoelectric ceramic transducer,PZT)上,位于参考臂显微物镜的焦面上。样品载物台安装在电动线性微位移平台上,通过平台的移动,使不同深度位置的生物组织移到样品臂显微物镜的焦面上。YAG晶体(反射率8%)作为参考镜附着PZT的前端。当参考光和样品光光程小于光源相干长度时,两光束发生干涉。使用面阵电荷耦合器件(Charge coupled device,CCD)(640像素×480像素,像元7.4 μm×7.4 μm,帧率110 fps)采集干涉信号,电脑控制单片机给正弦信号调制PZT,同时晶体管-晶体管逻辑(Transistor-transistor logic,TTL)信号触发CCD。
如图2所示,通过测量系统的点扩展函数(Point spread function,PSF)的半峰全宽(Full width at half maximum,FWHM),得到系统的轴向分辨率约为0.8 μm。用1951 USAF标准分辨率板测量系统的横向分辨率,取拟合曲线峰谷之间光强的20%~80%所占的距离,得到横向分辨率约为0.9 μm。系统的轴向及横向分辨率均已达到微米级别。

图2 系统分辨率测量
试验采用人体肝脏组织样本,术中切除的肝脏组织首先用福尔马林溶液固定,随后被切割为5 mm×5 mm×3 mm的小块。分别对6组正常肝组织样本和6组病变肝组织样本成像,每次成像由组织表面开始,并以10 μm的深度递增。在每个深度上,分别对每个小组块的6处不同区域成像,总共获得72个组织样本成像(36个正常组织样本成像和36个病变组织样本成像)。
2 参数提取
2.1 一阶统计参数
基于成像结果图像的灰度值,直接计算一阶统计参数,是较为常用的反映图像统计特征的方法。正常组织与病变组织在空间异质性上的差别是癌症诊断的基础,在病变早期难以通过医师肉眼观察,通过提取成像图形中的一阶统计参数,定量分析组织质地变化,可以帮助判别病变组织中潜在的结构改变[13]。本文中使用的5个一阶统计参数定义如下
(1)
(2)
(3)
(4)
(5)
式中:xi为成像图中i点的灰度值,N为成像图中的像素总量,p(xi)为灰度xi出现的概率。Mean为像素灰度的均值,Variance代表像素间灰度波动的程度,Skewness和Kurtosis表征图像直方图的非对称性与抖缓程度,Entropy用来衡量图像的不规则程度。
2.2 中心对称自相关参数
基于前期FFOCT成像结果的定性分析,在微米级FFOCT剖面图中,光强及组织结构特征更加倾向于在局部的小范围内变化[10]。而一阶统计参数只针对单个像素进行评估,忽略了相邻像素点间的关联性,因此具有一定的局限性。为了评估光学相干层析图像在小范围空间内的变化,使用中心对称自相关参数(Center symmetric auto-correlation,CSAC)来计算局部像素点间的强度差异。CSAC方法主要关注相邻像素点之间的差异[14],在计算CSAC参数时,一般以3×3的邻像素组为基本单位,如图3所示。

图3 CSAC3×3的邻像素组
在本文中,使用6个CSAC参数进行评估,其定义如下[14]
(6)
(7)
(8)
(9)
(10)
(11)
式中:gi为像素I的灰度值,μ为3×3像素组的平均灰度。上述六个CSCA参数均在像素组内进行计算,SCOV用来测量邻像素间的相关程度,VAR为像素组内灰度的方差,BVAR为像素对间方差,WVAR为像素对内方差,且VAR等于BVAR与WVAR之和,SVR为像素对内方差与像素对间方差的比值,SAC为SCOV相对于VAR的归一化值。
2.3 分形参数
分形参数从整体上评价图像的不规则性,当成像精度达到一定的长度尺度时,分形维度可以反映组织细胞级的微观结构[15];本文中FFOCT系统的微米级分辨率允许通过成像结果来测量分形参数随深度的变化情况。由前期的研究结果可知,病变组织的分形参数与其对应的正常组织的分形参数比率可以表示为[12]
(12)
式中:Δm=mp-mn,mp和mn分别为病变和正常组织的分形参数,L0为折射率相关距离尺度,λc为光源中心波长,kc=2π/λc,α=λfx,β=λfy,fx和fy分别为x和y方向上的空间频率,λ为波长。从式(12)可以看到,当组织发生病变时,比率rm呈逆幂律分布。在对数坐标上绘制rm曲线,可以通过线性拟合的方法得到Δm,从而评估正常组织与病变组织分形参数的差异。
3 试验结果分析和讨论
图4和图5分别为人体正常肝组织与病变肝组织在不同深度下的FFOCT成像结果。可以看到,正常肝组织中空心箭头所指示的多边形状肝细胞,其直径多在15~20 μm之间,排列规则,构成紧密的网状。肝细胞间明亮的结构为胆小管,在正常肝组织中,胆小管粗细均匀,分布较规则。而病变组织中肝细胞形状各异,大小不均,排列松散无规律。胆小管排列混乱,部分胆小管塌陷消失。

图4 正常肝组织层析成像

图5 病变肝组织层析成像
基于正常与病变肝组织的FFOCT成像结果,分别计算5个一阶统计参数,其箱型图如图6所示。

图6 正常与病变肝组织的统计参数箱型图
可以看到,病变肝组织的均值相对正常肝组织的均值更高,这与组织发生病变时细胞核的增大现象是一致的。病变组织方差和熵的增加,可以解释为当生物体组织发生病变后质地结构的不规则性增加。病变组织更小的峰度和偏度值,说明病变组织在结构上的强度变化更剧烈。
基于箱型图的特征,从病变样本离群值异常多、病变样本中位数超过正常样本分位数、箱体不重叠和病变样本箱体高度<1/3正常样本箱体高度这4个维度分别评估5个一阶统计参数,如表1所示。可见,Variance和Entropy两个参数均达到两个以上的维度条件,可以作为区别正常与病变组织的关键参数。其中Variance参数表现最好,达到了3个维度条件,这也说明了在病变发展过程中,成像图形中像素间的波动明显增加。

表1 一阶统计参数箱型图特征分析
基于正常与病变肝组织的FFOCT成像结果,计算正常与病变组织的CSAC参数直方图,如图7所示。可以看到,在6个CSAC参数中,SCOV、VAR、BVAR和WVAR这4个参数的正常与病变组织成像直方图具有非常明显的差异,可以作为筛选病变组织的关键参数。正常肝组织的这4个CSAC参数均更加向原点集中,这表明正常组织的局部结构波动明显比病变组织更缓慢,质地更均匀。而参数SVR与SAC的正常与病变直方图基本重合,因而不能作为区分正常与病变组织的关键参数。

图7 正常与病变肝组织的CSAC参数直方图
对正常和病变肝组织成像分别计算不同深度上分形参数的差值,见表2。可以看到当组织发生病变时,分形参数值相应增加,即Δm>0。这一现象可以解释为组织发生病变时伴随着大量的异常增生,从而造成组织结构的不规则性增加。另外,因为成像的对比度随着成像深度增加而降低,分形参数也随之减小,即对于同样的组织结构,表面与深度成像的分形参数值之间存在差异。基于病变组织分形参数明显增加的统一趋势,分形参数可以作为评估病变组织的关键参数。

表2 不同深度上病变与正常肝组织成像的分形参数差值
基于以上试验结果分析和讨论,将可以用于筛选病变组织样本的参数集合汇总在表3中。
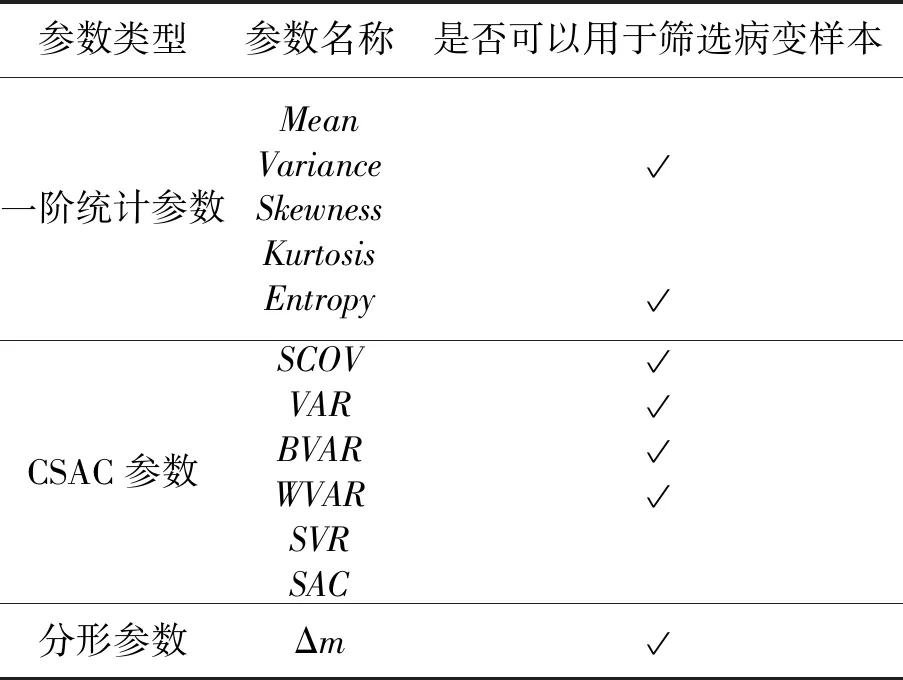
表3 用于筛选病变样本的参数集合
4 结束语
本文对FFOCT的剖面成像进行了一系列量化分析,由于组织质地的改变,相较于正常组织,病变组织呈现出一些典型的量化特征,其中包括更大的分形参数、均值、方差和熵,且病变组织的CSAC参数直方图更加离散。以上这些量化特征均体现出正常组织的质地较病变组织更加均匀和规则,而病变组织的结构变化更加剧烈,在一定程度上揭示了组织的病变程度。对以上量化参数进行评估,本文提出了用于筛选病变样本的参数集,可以帮助病理专家进行快速分析诊断:首先,通过手术前的活体成像或是术中深度层析成像,快速判断组织是否有病变;其次,可以在术中更加精准快速地判断病变组织的边界,实施更加精准的病变组织切除;最后,在术后的随访中,及时观察和跟踪组织病变的发展进程。
以上的研究工作还处于概念验证阶段,下一步的工作将聚焦于基于更大样本数量和种类,进一步提高FFOCT系统的成像对比度,以确定用于筛选病变组织的参数的阈值,并探索高效的基于FFOCT成像的定量诊断方法。
