柳枝稷BiP基因的鉴定、表达分析和抗逆境功能
2022-09-07方志刚王玉龙蔡庆生
宋 刚, 方志刚, 王玉龙, 蔡庆生
(1.江苏农林职业技术学院茶与食品科技学院,江苏 句容 212400; 2.南京农业大学生命科学学院,江苏 南京 210095; 3.喀什大学生命与地理科学学院,新疆 喀什 844099)
内质网(Endoplasmic reticulum,ER)是所有真核生物细胞中蛋白质的分泌场所,其介导了蛋白质合成、折叠和组装,负责调节新生蛋白质的质量[1]。在ER腔体空间内,由驻留的分子伴侣蛋白执行这些任务和功能,如属于热激蛋白70家族(Hsp70)的免疫重链绑定蛋白(BiP)。为了维持ER功能的精确性,细胞演化出一种蛋白质监控信号通路——未折叠蛋白应答途径 (UPR)[2-4]。ER系统在遭受外来胁迫(如高温、干旱、盐害等)时,细胞内会积累大量未折叠蛋白或错误折叠蛋白,发生ER胁迫,此时细胞会启动UPR[5]。为恢复体内蛋白质合成的平衡,植物细胞需要通过上调编码内质网分子伴侣和折叠酶的基因来重建蛋白质折叠能力和需求之间的平衡,BiP即为这些基因之一[6]。类似Hsp70家族中其他同源蛋白,BiP具有2个保守结构域: N端相对分子质量大约44 000的ATP绑定结构域(ABD),C端相对分子质量大约16 000的多肽绑定结构域(PBD)。PBD结构域负责与未折叠蛋白质底物结合,并受与ABD结构域结合的核苷酸调控[7]。BiP还包括一个C端ER驻留信号(ER retention signals),功能是使蛋白质留在ER内腔,在植物中其氨基酸序列通常是“HDEL”,在哺乳动物中是“KDEL”[8]。BiP在酵母和哺乳动物中是单个存在的,但在高等植物中是小且高度保守的基因家族并且分散在基因组内,如大豆中含2个[9],拟南芥[10]、小麦[11]和辣椒[12]中都含有3个,烟草[13]和水稻[14]中则均含有6个。研究结果表明,过表达BiP能增强植物对环境胁迫的耐受性。大豆BiP在烟草[15]和大豆[16]中的过表达,通过防止内源性氧化应激,赋予转基因植物抗旱性。过表达辣椒CaBiP1的拟南芥转基因植株自身降低了活性氧积累量,增加了保水性,刺激UPR通路和相关应激基因的表达,提高了对多个环境胁迫的耐受性,包括热、渗透、盐和干旱[17]。此外,枸杞LcBiP在烟草中过表达提升了烟草对重金属Cd的耐受性[18]。
柳枝稷(PanicumvirgatumL.)为原产于北美的多年生暖季C4型禾本科植物,根系发达,抗旱能力强,产量高,适合在边际土地中生长[19-20]。由于低成本和高生物量,尤其纤维素含量高,使其成为理想的生物质能源植物[21]。研究指出,在重金属污染尤其是Cd污染土地上种植柳枝稷为代表的能源植物可实现生物质资源开发与污染土地利用的双赢[22],因此提升柳枝稷对重金属Cd的耐受性就显得尤为重要。植物BiP基因在细胞中响应UPR,逆境条件下表现出多样化功能,可作为柳枝稷提升耐性的候选基因,但关于柳枝稷BiP基因的研究还未见报道。本研究对柳枝稷BiP基因进行鉴定,分析非生物胁迫下BiP基因的表达模式和功能,为柳枝稷分子改良,提升其对重金属尤其Cd的耐受性提供理论基础。
1 材料与方法
1.1 植物材料和试验处理
选取大小一致、均匀饱满的柳枝稷品种Alamo种子在50%的硫酸中浸泡(摇床振荡)20 min,用去离子水冲洗干净,再用70%乙醇溶液浸泡30 min,用去离子水冲洗干净,播种于盛有去离子水的培养盒水面的塑料滤网上发芽,培养温度为(25±2) ℃,相对湿度70%,光照每天12 h。待柳枝稷发芽生长至3张幼叶时,将大小一致的健壮幼苗转移至塑料烧杯中水培,培养条件设置为:温度30 ℃(日)/20 ℃(夜),光周期14 h(日)/10 h (夜)。培养过程中每隔1 d调整烧杯的位置,降低边缘效应[23]。
待植株生长至5张全展叶时用0.1 mmol/L脱落酸(ABA)和15.0 mmol/L二硫苏糖醇(DTT)喷施处理,以正常生长植株为对照,在喷施处理后0 h、3 h、6 h、12 h和24 h分别采集叶片为样品。对幼苗分别用 200 mmol/L NaCl、200 g/L聚乙二醇(PEG)、50 μmo/L CdCl2水溶液培养,进行盐胁迫、干旱渗透胁迫和重金属Cd胁迫处理,处理后在0 h、1 h、3 h、6 h、12 h和24 h 6个时间点进行全株采样[24]。样品经液氮速冻后存放于-80 ℃用于RNA提取。本试验每个处理设置3个生物学重复和2个技术重复。
1.2 试验试剂、菌株和载体
实时荧光定量PCR试剂盒Roche SYBR GREEN Master(ROX)购自罗氏(Roche)公司,T4连接酶、限制性内切酶购自NEB公司,植物基因组DNA提取试剂盒购自原平皓(天津)生物技术有限公司,植物RNA提取试剂盒、质粒提取试剂盒、PCR产物回收试剂盒、琼脂糖凝胶DNA回收试剂盒均购自OMEGA公司,其他化学试剂与耗材统一购自南京寿德实验器材有限公司。
大肠杆菌菌株DH5α、酵母菌株YCF1、G19、HOG1以及入门载体pEND-linker和酵母表达载体pGAD426均由南京农业大学草业学院草坪生理生化实验室馈赠。
1.3 生物信息学分析
柳枝稷参考基因组数据下载自植物基因组网站Phytozome(http://phytozome.jgi.doe.gov/,PanicumVirgatum_516_ V5.1),从美国国家生物技术信息中心(NCBI)网站(https://www.ncbi.nlm.nih.gov/)检索BiP蛋白并下载序列,将下载序列与柳枝稷蛋白质序列进行本地BLAST比对。比对上的序列通过CDD(Conserved Domain Database)数据库(https://www.ncbi.nlm.nih.gov/cdd)检索是否具有GPR78/BiP/KAR2保守结构域(KOG数据库编号KOG0100)[25],如有则为BiP候选序列。再检查候选序列C端是否含有ER驻留信号序列“HDEL”以确定BiP。使用在线工具PROTPARAM (http://web. expasy.org/protparam/)预测分析BiP蛋白质编码氨基酸序列大小、相对分子质量、等电点和氨基酸残基的疏水性。用WOLF PSORT(https://www.genscript.com/wolf-psort.html)预测蛋白质亚细胞定位,用SignalP5.0(http://www.cbs.dtu.dk/services/SignalP/)预测蛋白质信号肽位点。多序列比对采用MEGA 7.0完成,通过MEGA 7.0构建多物种系统发育树(Neighbor-joining method,bootstrap=1 000)。使用MEME(http://meme.nbcr.net/meme/)网站鉴定 PvBiPs的保守基序(motif),motif的最大数目设定为10个,motif长度为6~100 个氨基酸,其他参数默认设置。从柳枝稷基因组注释文件中提取出BiP基因的注释信息,导入Gene Structure Display Server (GSDS)网站(http://gsds.cbi.pku.edu.cn/)分析基因的外显子-内含子结构。提取PvBiPs上游2 kb启动子序列,使用PlantCARE v1.0 (http:// bioinformatics.psb.ugent.be/webtools/plantcare/html/)数据库进行顺式作用元件分析。
1.4 植物基因组DNA和总RNA提取、cDNA合成与实时荧光定量PCR
取柳枝稷新鲜植物组织0.1 g,用植物基因组DNA提取试剂盒[原平皓(天津)生物技术有限公司产品]提取gDNA。取柳枝稷幼苗全株样100 mg并用液氮速冻,使用OMEGA E.Z.N.A.® plant RNA Kit提取植物总RNA。以2 μg总RNA为模板,使用RNA反转录试剂盒反转录合成cDNA。
利用在线引物设计工具(http://www.genscript.com/tools.html#biology)设计扩增引物,引物序列见表1,内参基因使用PvFTSH4[26],引物由生工生物工程(上海)股份有限公司合成。qRT-PCR反应体系:2×SYBR Green I Master 10.0 μl、cDNA 2.5 μl、Genen specific primersf(F/R) 2.5 μl,添加ddH2O至20.0 μl。反应程序:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 20 s,荧光信号检测, 40个循环。试验在Applied Biosystems 7500 real-time PCR system (Applied Biosystems,Foster City,CA,USA) 上进行,每个处理设置3次独立生物学重复和2次技术重复取样,采用2-△△Ct法计算基因相对表达量。
1.5 柳枝稷PvBiP基因克隆、酵母异源表达与抗性分析
根据PvBiP基因编码序列(Coding sequence,CDS),设计合成引物(表1),以gDNA为模板,通过Q5高保真DNA聚合酶扩增获得目的基因片段,PCR反应体系为:Q5 Reaction buffer 10.0 μl、Q5 GC Enhancer 10.0 μl、dNTPMix 4.0 μl、Template gDNA 4.0 μl、F + R (2.5 μl +2.5 μl)、Q5 high-fidelity DNA polymerase 0.5 μl,添加ddH2O至50.0 μl 。反应程序为: 98 ℃预变性3 min;98 ℃变性30 s,63 ℃退火10 s,72 ℃延伸1 min,30个循环;72 ℃延伸5 min,10 ℃,10 min。用E.Z.N.A Gel Extraction Kit-Spin试剂盒回收产物。将双酶切后的入门载体pEND-linker与PvBiP目的基因片段连接,转化大肠杆菌感受态细胞DH5α,挑取阳性克隆进行PCR检测。选取与目标条带大小一致的菌液提取质粒,送南京擎科生物科技有限公司测序。

表1 本试验所用引物序列
提取测序结果正确的阳性克隆质粒,用限制性内切酶PvuⅠ进行线性化处理。将目的片段与表达载体pGAD426进行LR重组反应,转化大肠杆菌感受态DH5α,挑取阳性克隆,根据载体大小和通过PCR检测的情况,确定重组反应得到正确的表达载体并提取阳性克隆质粒。制备盐敏感酵母菌株G19、Cd敏感酵母菌株YCF1和旱敏感酵母菌株△HOG1感受态细胞并加入表达载体pGAD426-PvBiP质粒和pGAD426-GUS对照质粒进行酵母转化。将转化后的含PvBiP1a、PvBiP2和PvBiP3的酵母菌株单一克隆在液体培养基中培养至平台期(OD600=1),然后使用无菌水将菌液按10倍、100倍和1 000倍梯度稀释,分别取5 μl菌液按浓度依次点在对照和处理平板上培养,胁迫处理分别使用300 mmol/L NaCl、0.5 mol/L甘露醇和100 μmol/L CdCl2。5~6 d后观察酵母表型并采集照片。
2 结果与分析
2.1 柳枝稷PvBiP基因的鉴定
在NCBI网站共检索并下载到23个不同物种(烟草、拟南芥、水稻、玉米、大豆、石榴等)中报道的BiP蛋白序列,与柳枝稷参考基因组数据进行本地BLAST比对,候选序列有多个转录本的取1号转录本,再经 “KOG0100”结构域和 “HDEL”2个筛选条件,共筛选出4个BiP基因,分别位于柳枝稷基因组chr01K、chr01N、chr05K、chr05N染色体上,蛋白质理化信息及亚细胞定位预测信息见表2。由于Pavir.1KG020800.1和Pavir.1NG010600.1的蛋白质序列、理化参数完全一致,CDS也只有微小差异,因此将它们分别命名为PvBiP1a和PvBiP1b,分别把Pavir.5KG300400.1与Pavir.5NG387200.2命名为PvBiP2和PvBiP3。亚细胞定位预测结果显示,4个基因均定位在ER,所含信号肽(Signal peptide,SP)分别由23个、25个、23个和27个氨基酸残基组成。
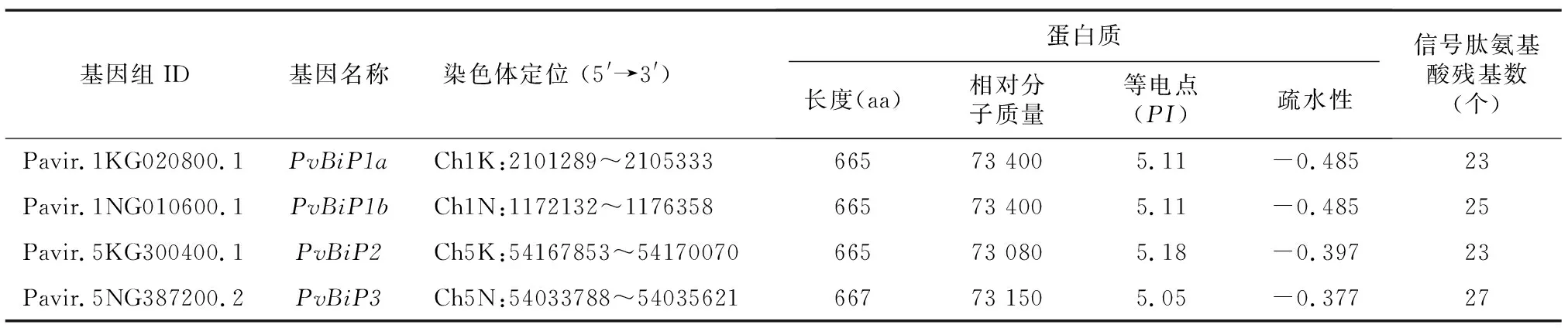
表2 柳枝稷BiP基因特征和亚细胞定位信息
2.2 柳枝稷PvBiP基因的生物信息学分析
使用水稻[14]、拟南芥[10]、枸杞[18]、大豆[9]、石榴[14]、烟草[14]等BiPs与PvBiPs蛋白构建系统发育进化树(图1)。进化树显示,PvBiP1a和PvBiP1b聚为一个分支,这与2个基因编码相同的氨基酸序列相吻合。另外,它们与水稻OsBiP1的进化关系最近。PvBiP2、PvBiP3与水稻OsBiP3、OsBiP4、OsBiP5的遗传距离较近。

bootstrap=1 000,括号内为GenBank登录号。图1 Neighbor-joining法构建的柳枝稷与不同植物BiP 同源蛋白质的系统进化树Fig.1 Phylogenetic tree of BiP homologous proteins between different plant species and switchgrass by neighbor-joining method
多物种同源序列比对结果(图2)显示,4个PvBiPs与7个同源BiPs的保守结构域domain1~domain5以及5个高度保守氨基酸残基组成上高度一致,domain 6(HDEL)组成全部一致。 motif分析发现,在4个PvBiPs中10个motif的分布完全相同(图3a),domain1 序列“TVIGIDLGTTYSC”是Hsp70家族成员中普遍存在的高度保守序列[27],位于motif 2 N端,为β-磷酸化结合功能区。Domain 2序列对应motif 4 N端,为γ-磷酸化结合功能区,domain 3(腺苷酸结合功能区)位于motif 3 N端,domain 4(钙调素蛋白结合功能区)位于motif 5 N端[25]。C端5个高度保守的氨基酸残基,能促进与多肽底物氢键的结合[5-6],还有重要的α或β多肽底物结合基序domain 5(位于motif 7和motif 9),能确保初始多肽底物不从结合位置脱落释放[11]。综上,PvBiPs具有BiP结构域且高度保守。

方框表示所对应domain的氨基酸序列范围,箭头所指为高度保守氨基酸残基。图2 柳枝稷BiP与拟南芥、水稻和枸杞中同源蛋白多序列比对Fig.2 Multiple alignment of the BiP of switchgrass with BiP homologous proteins of Arabidopsis, rice and Lycium chinense
基因结构(图3b)显示,PvBiP1a、PvBiP1b具有7个内含子,PvBiP2、PvBiP3没有内含子。PvBiPs上游2 kb启动子序列分析结果(表3)显示,它主要包括响应非生物胁迫相关和激素应答2类顺式作用元件,这些元件包括:响应低温胁迫的 LTR 元件、响应干旱胁迫的MBS元件、与机械损伤有关的 WUN-motif元件、植物响应胁迫和防御的TC-rich repeats元件、响应脱落酸作用的ABRE元件、参与厌氧诱导调节的ARE元件、与缺氧特异性诱导有关的增强因子GC-motif元件、响应生长素的TGA-element元件、参与水杨酸反应的TCA-element元件、参与赤霉素响应调节的TATC-box元件、参与生长素响应调节的AuxRR-core元件、参与茉莉酸甲酯响应调节的CGTCA-motif元件和TGACG-motif元件。

CDS:编码序列;UTR:非翻译区;Intron:内含子。图3 柳枝稷BiP基因保守基序分布(a)和基因结构(b)Fig.3 Distribution of conserved motifs (a) and gene structure (b)of BiPs in switchgrass
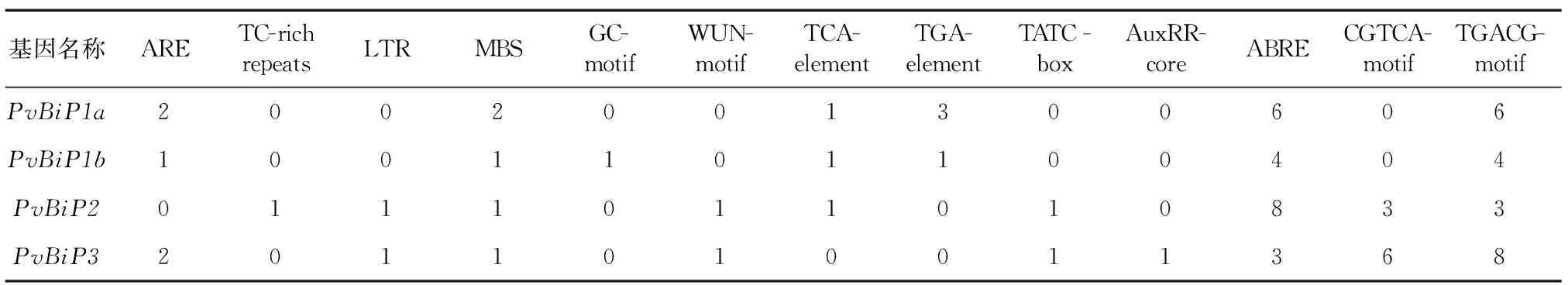
表3 柳枝稷BiP基因启动子区胁迫和激素相关顺式作用元件
2.3 非生物胁迫对柳枝稷BiP基因表达的影响
二硫苏糖醇(DTT)是一种内质网诱导剂,能引起被处理对象发生内质网胁迫而激发UPR[28]。通过qPCR检测柳枝稷幼苗经15 mmol/L DTT 喷施处理后0~24 hPvBiPs的相对表达量,结果(图4)表明,PvBiPs相对表达量总体呈现先下降后上升然后又下降的趋势,到24 h时降至接近0 h的水平。各基因对DTT的响应存在差异,PvBiP1a与PvBiP1b的相对表达量峰值出现在12 h,PvBiP2、PvBiP3的相对表达量在3 h达到峰值,且与PvBiP1a、PvBiP1b的相对表达量相比更高,最高的是PvBiP2。

图4 二硫苏糖醇(DTT)诱导内质网胁迫下柳枝稷BiP基因的表达Fig.4 Expression of BiPs in switchgrass under endoplasmic reticulum stress induced by dithiothreitol (DTT)
用NaCl、PEG、ABA和CdCl2处理柳枝稷幼苗24 h,不同时间点PvBiPs相对表达量的变化如图5所示。总体上PvBiPs的相对表达量是先上调后下降的趋势。NaCl胁迫下,各基因相对表达量峰值基本出现在12 h。PEG渗透胁迫下,PvBiP1a相对表达量峰值出现在6 h,比0 h处理上调6.2倍,PvBiP1b相对表达量上调5.6倍;PvBiP2相对表达量峰值表现在3 h,上调4.0倍,PvBiP3相对表达量峰值在12 h,上调4.7倍。ABA处理下,PvBiP2相对表达量的峰值在12 h ,上调9.0倍,明显高于其他基因。CdCl2处理下,PvBiP2相对表达量峰值仍然出现在处理12 h,上调9.0倍,PvBiP3相对表达量的峰值在6 h,达到8.0倍。

图5 NaCl、ABA、PEG和CdCl2胁迫处理下柳枝稷BiP基因的表达Fig.5 Expression of BiPs in switchgrass under NaCl stress, ABA stress, PEG stress and CdCl2 stress treatments
2.4 柳枝稷BiP基因克隆与酵母功能验证
通过PCR扩增得到PvBiP1a、PvBiP2和PvBiP3全长,扩增产物见图6。

M:DL5 000 DNA Marker。图6 PCR扩增的PvBiP1、PvBiP2、PvBiP3基因的产物条带Fig.6 Amplified product strips of PvBiP1, PvBiP2 and PvBiP3 genes amplified by PCR
将扩增的PvBiP1(实际按PvBiP1a扩增)、PvBiP2和PvBiP3产物经同源重组分别连接到pGAD426酵母表达载体上 ,转化酵母菌株。在100 μmol/L CdCl2SD/-Ura选择培养基平板上,与对照pGAD426-GUS菌株比较,PvBiP1a、PvBiP2和PvBiP3过表达酵母菌株的生长显著增强(图7a),呈现出一定的耐Cd表型。在300 mmol/L NaCl SD/-Ura-His平板上,3个基因相比于对照盐胁迫表现出明显耐性,尤其PvBiP1a和PvBiP2的耐盐表型更明显(图7b)。而0.5 mol/L甘露醇胁迫处理表型与对照间没有明显差异(图7c),说明柳枝稷BiP基因可能对甘露醇模拟干旱胁迫响应敏感。上述结果表明,酵母过表达PvBiPs后具有耐盐和耐Cd胁迫的能力,但对渗透干旱胁迫较敏感,与对照表型基本一致。

a:CdCl2胁迫;b:NaCl胁迫;c:甘露醇胁迫。YCF1/pGAD426-GUS为空白对照Cd敏感酵母菌株,G19/pGAD426-GUS为空白对照盐敏感酵母菌株、△HOG1/pGAD426-GUS为空白对照干旱敏感酵母菌株,其余为相应处理转基因酵母菌株。图7 柳枝稷BiP基因在非生物胁迫下的酵母功能验证Fig.7 Yeast function verification of BiPs in switchgrass under abiotic stresses
3 讨 论
四倍体柳枝稷具有2套亚基因组K和N,据推测它们来自1.00×106年前同源四倍体化事件的2个近亲祖先[29-30]。本研究在柳枝稷基因组中共鉴定了4个BiP基因,分布在chr01K、chr01N和chr05K、chr05N 2对同源染色体上。序列比对结果表明,它们彼此相似度很高,尤其PvBiP1a和PvBiP1b编码的氨基酸序列完全一致,可能是基因复制形成。柳枝稷BiPs和其他物种BiP序列高度相似,体现在具有相同保守结构域,如domain 4是钙调素结合基序,能与Ca2+结合蛋白质起作用,调节N端ATP酶活性[11],使ATP水解产能驱动BiP在新生蛋白质组装过程中结合未折叠或错误折叠的多肽底物[31]。另一必需腺苷结合功能域domain 3(motif 3 N端)和C端5个氢键结合氨基酸位点(V-T-Y-Q-S)则高度一致。基因内含子结构有3种模式:无内含子、1个内含子、超过1个内含子[32],研究结果证明,内含子通过外显子重组驱动进化[33],对于含多个内含子的基因,通过可变剪接实现单个基因的多个蛋白质翻译,对基因功能具有重要影响[34-35]。如辣椒CaBiP1、CaBiP2有7个内含子,CaBiP3有6个内含子,CaBiP3的整体表达水平远远低于CaBiP1、CaBiP2,在盐和高温胁迫下,CaBiP3受诱导,表达量显著高于CaBiP1、CaBiP2[17]。柳枝稷PvBiP1a、PvBiP1b内含子为7个,PvBiP2、PvBiP3无内含子,暗示它们可能存在功能分化上的差别。
研究结果表明,植物BiPs表达受组织特异性和生长发育调节[17,25,36]。分析数据库(https://switchgrassgenomics.noble.org)中柳枝稷RNA-seq表达量数据发现,PvBiP2在授粉后形成种子阶段的表达量要明显高于其他组织或发育阶段,这与小麦TaBiP在种子中高表达、在茎叶器官中低表达[11]的结果相近,PvBiP2可能在种子发育过程中扮演重要的调控角色。基因启动子分析发现,PvBiPs中普遍存在响应干旱胁迫的作用元件 MBS、脱落酸作用反应元件ABRE、茉莉酸甲酯作用元件TGACG-motif,低温响应元件LTR、机械损伤响应元件wun-motif只在PvBiP2、PvBiP3中检测到,顺式作用元件的差异预示PvBiPs面对非生物胁迫时会有不同响应。在DTT与NaCl、PEG、ABA、CdCl2处理下,PvBiP基因均表现为随胁迫时间先上调表达后逐渐下降至本底表达水平的变化趋势。PvBiP1a和PvBiP1b由于蛋白质序列完全一致,其相对表达量变化趋势和峰值大小也基本一致。尽管PvBiP2与PvBiP3的变化趋势类似,但峰值大小存在差异。PvBiP2在DTT、NaCl、ABA和CdCl2胁迫处理下表达峰值都是最高的,PvBiP1a和PvBiP1b仅在PEG渗透胁迫下表现出高于PvBiP2、PvBiP3的上调表达量。非生物胁迫下BiP基因表达量的差异,涉及胁迫信号传导复杂的调节网络,反映了转录水平和蛋白质合成水平的不同。由于BiP不仅能体现响应UPR的分子伴侣活性,还可以作为内质网胁迫调节因子起到调节作用[37-38],所以上调表达最高的PvBiP2可能是BiPs中主要的胁迫调节因子。进一步在酵母中异源过表达3个PvBiP基因(PvBiP1a与PvBiP1b编码的蛋白质序列一致,只研究PvBiP1a),结果显示,PvBiP基因有耐Cd和耐盐表型,对渗透胁迫敏感。在PvBiP基因中,PvBiP2在CdCl2胁迫下(1~12 h)持续上调表达,表达量也最高,其耐镉调控作用值得进一步研究。
4 结 论
本研究在柳枝稷基因组中共鉴定了4个定位于内质网的BiP基因,命名为PvBiP1a、PvBiP1b、PvBiP2、PvBiP3,分别位于柳枝稷的1号和5号染色体上。多物种序列比对和进化分析结果表明,PvBiPs具有BiP蛋白典型功能结构域,PvBiPs启动子序列主要包括胁迫防御和激素应答顺式作用元件。PvBiPs受DTT诱导表达,在NaCl、PEG、ABA和CdCl2胁迫下都上调表达,其中PvBiP2的相对表达量峰值较高。酵母异源转化耐逆功能验证结果显示,PvBiPs对镉和盐胁迫有耐性表型,对甘露醇渗透胁迫较敏感。PvBiP2可作为镉胁迫响应基因进行深入研究。
