CT定位下经颅磁刺激对卒中后运动功能障碍的治疗效果
2022-09-07徐亚辉张晓芸张冉王培福
徐亚辉,张晓芸,张冉,王培福
航天中心医院神经内科,北京 100049
前言
脑卒中是一种由于脑部血管破裂(出血性卒中)或阻塞(缺血性卒中)引起的急性脑功能障碍疾病,其中,缺血性卒中在所有病例中约占70%。随着世界人口的增长和老龄化,卒中已逐渐成为世界范围内第二大致死因素和第一大致残原因[1]。尽管介入治疗的发展有效降低了急性期患者的死亡率,但在卒中的疾病转归过程中伴随着诸多并发症的发生。根据缺血缺氧影响的脑功能区的不同,卒中患者在恢复期常常存在躯体运动障碍、感觉障碍、语言障碍以及认知功能障碍等表现[2-4]。此外,卒中住院患者长期卧床,使其坠积性肺炎、压疮、下肢深静脉血栓等并发症发病率显著增加[5]。因此,针对卒中患者采取积极有效的治疗,尽早恢复患者的运动功能对预防并发症和提高患者生存质量极其重要。经颅磁刺激(Transcranial Magnetic Stimulation,TMS)是一种通过一定频率的磁刺激改变目标脑区的活性达到改善相应脑区功能的治疗手段[6]。有报道显示在治疗特异性上,通过MRI 技术定位TMS 能够显著改善患者的语言、认知等功能[7]。计算机断层扫描(Computed Tomography,CT)作为一种卒中常用检查方法能有效定位缺血病灶所在位置。基于此,本研究拟观察CT定位下TMS 治疗对卒中后患者运动障碍的治疗效果。
1 资料与方法
1.1 一般资料与分组
纳入北京航天中心医院2018年1月~2021年4月收治的缺血型脑卒中患者150 例,无脱落和退出患者,所有患者均于急性期接受介入取栓或溶栓治疗,处于康复治疗期。按入院时间分为观察组(n=75)和对照组(n=75)。观察组患者男性40例,女性35例,年龄37~65 岁,平均(53.73±6.96)岁,体质量指数(BMI)(27.12±3.00)kg/m2,病程1~3 个月,平均(1.8±0.7)月;对照组患者男性42 例,女性33 例,年龄37~62岁,平均(54.08±6.41)岁,BMI(28.16±3.53)kg/m2,病程1~3个月,平均(1.7±0.8)月。两组患者在性别构成、年龄、BMI 和病程方面无显著性差异(P>0.05),具有可比性。本研究通过本院医学伦理委员会批准,患者或家属均签署知情同意书。
1.2 纳入和排除标准
1.2.1 纳入标准(1)符合《各类脑血管疾病诊断要点》中脑卒中诊断标准[8];(2)卒中首次发病,病程2~5个月,未接受TMS 治疗;(3)发病前无肢体残疾及运动功能障碍,发病后存在上下肢运动障碍;(4)认知、语言功能正常。
1.2.2 排除标准(1)有头部金属异物、人工耳蜗等不适合进行TMS 治疗患者;(2)发病前存在肢体残疾、肢体功能障碍者;(3)合并帕金森病、冠心病或其他不能配合完成本研究者。
1.3 治疗方法
两组患者均接受常规控制血压、血脂、血糖水平,营养脑细胞等药物治疗以及常规物理康复治疗、饮食干预和健康宣教等措施。在此基础上,对照组患者采取常规TMS 治疗方案:由同医疗组具有2年以上工作经验的治疗师运用经颅磁刺激仪(Mdetronie公司,MAGPROR30型)进行治疗,线圈为8 字线圈,最大磁场强度3.0T。患者取平卧位,去除手表等金属物品,将治疗线圈中心放置于健侧初级运动皮层上、下肢对应投射区域,与治疗部位颅骨表面相切。取刺激频率20 Hz,刺激量为600脉冲,每次刺激持续时间2 s,间歇期28 s,每次刺激15 min,每周治疗5 次(d1,d2,d4,d5,d7),治疗周期8 周。观察组患者在对照组运动皮层上、下肢对应区域TMS 基础上采取CT 定位下治疗,步骤:(1)CT 扫描,治疗前采用西门子64 排CT 对患者头部进行扫描,取螺距0.934,层厚5 mm,电压120 kV,电流200 mA,准直宽度40 mm;(2)利用CT图像对患者大脑进行三维重构,利用梗死区低密度灶特点精确定位梗死区及梗死区相对应健侧脑区所在位置。三维重构颅骨模型,将颅骨模型与大脑进行匹配,确定病变脑区及对应健侧脑区在颅骨表面的投影点,并测量拟刺激位置(投影点)处线圈放置角度,并在患者头部进行标记(图1);(3)8 字线圈安放:将8 字线圈中心点分别置于颅骨表面标记位置,线圈平面与刺激靶点部位颅骨相切,与水平面呈45~55°角,对靶点进行刺激。每4 周对患者进行1 次重新扫描,匹配线圈与患者目标脑区及颅骨模型间的关系,确保刺激点精确定位至目标脑区;(4)刺激参数及治疗周期:取刺激频率20 Hz,刺激量为600 脉冲,每次刺激持续时间2 s,间歇期28 s,每次刺激15 min,每周刺激5 次(d1,d2,d4,d5,d7),治疗周期8周。
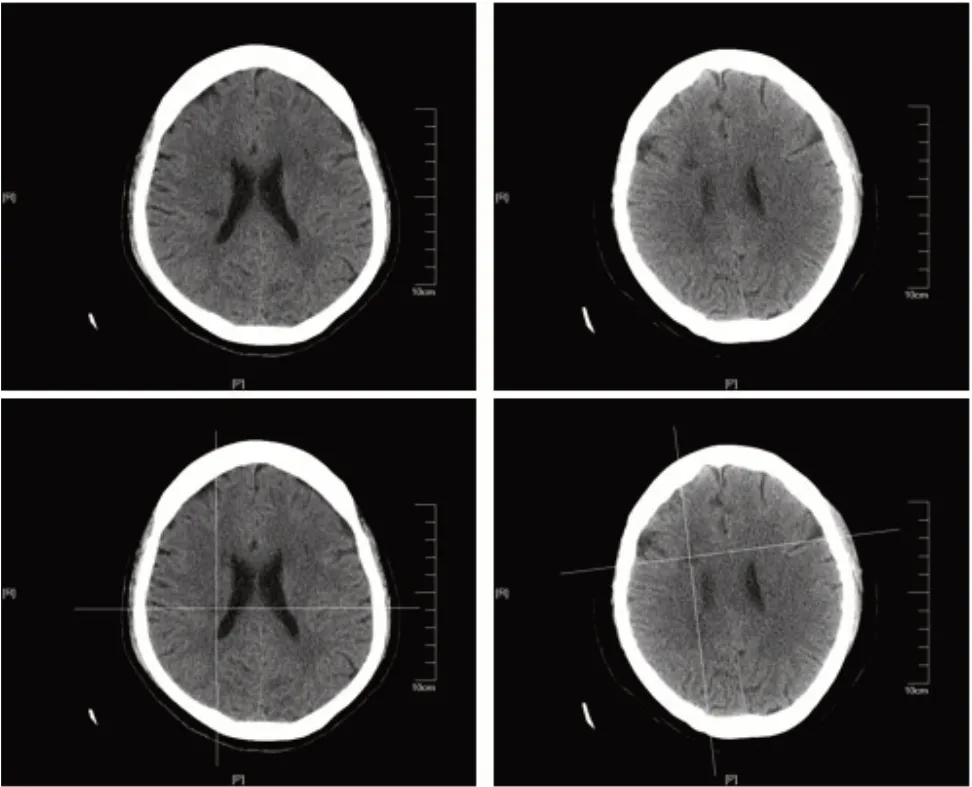
图1 病损脑区(上)及颅骨定位(下)Figure 1 Locations of diseased brain area(upper)and skull(lower)
1.4 评价指标
于治疗前、治疗8 周后由同组医师在双盲情况下对两组患者治疗情况进行评价。评价指标包括:(1)下肢肌力评价:患者取平卧位,采用0~5 分肌力评估法对患者下肢肌力进行评估;(2)上、下肢运动功能评价:采用Fugl-Meyer 运动能力评价量表对患者上、下肢运动功能进行评估,Fugl-Mayer量表包括运动协调性、反射等17 个项目(上肢10 个,下肢7 个),总分100 分;(3)平衡能力评价:采用Fugl-Mayer 平衡量对患者平衡功能进行评价,总分14分,评分越高代表平衡能力越好;(4)生活能力评分:采用改良Barthel 指数评定量(MBI)对患者生活能力进行评估,该量表共包括用厕、穿衣等11个项目,共计100分,评分越高代表生存能力越好;(5)治疗有效性评估:根据神经功能损伤程度(NIHSS)和病残程度对有效性进行评估,包括基本痊愈、显著进步、进步、无变化、恶化和死亡,有效率=(基本痊愈+显著进步+进步)/总例数。
1.5 统计学方法
采用SPSS20.0 软件进行统计学分析。计数资料以n(%)表示,采用卡方检验;计量资料采用均数±标准差表示,先判断是否符合正态分布,随后进行方差齐性检验,最后进行双尾非配对t检验、t'检验或非参检验。P<0.05表示存在统计学差异。
2 结果
2.1 下肢肌力评分
治疗前两组患者下肢肌力均≤3 分,无显著差异(P>0.05)。治疗后两组患者下肢肌力均显著提高(P<0.05),观察组患者下肢肌力高于对照组患者(P<0.05),见表1。
表1 两组患者下肢肌力评分比较(± s)Table 1 Comparison of lower extremities muscle strength score between two groups(Mean±SD)
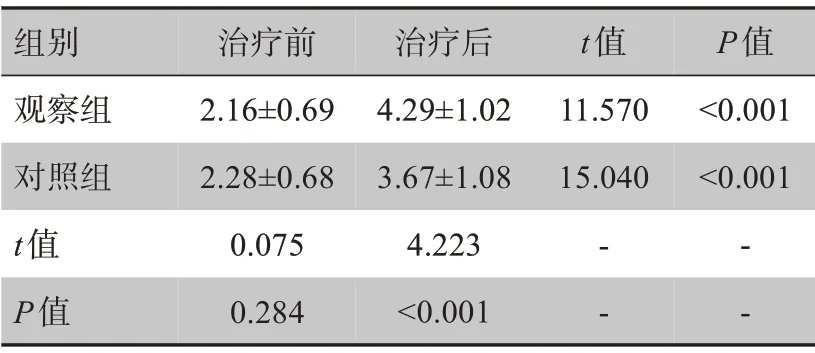
表1 两组患者下肢肌力评分比较(± s)Table 1 Comparison of lower extremities muscle strength score between two groups(Mean±SD)
组别观察组对照组t值P值治疗前2.16±0.69 2.28±0.68 0.075 0.284治疗后4.29±1.02 3.67±1.08 4.223<0.001 t值11.570 15.040- -P值<0.001<0.001- -
2.2 上下肢运动能力Fugl-Mayer量表评分
治疗前两组患者Fugl-Mayer 量表上下肢评分及总分无显著性差异(P>0.05)。治疗后两组患者上下肢评分及总分均显著提高(P<0.05),且观察组患者下肢评分及总分显著高于对照组(P<0.05),见表2。
表2 两组患者运动能力Fugl-Mayer量表评分比较(± s)Table 2 Comparison of Fugl-Mayer assessment scale scores of motor ability between two groups (Mean±SD)
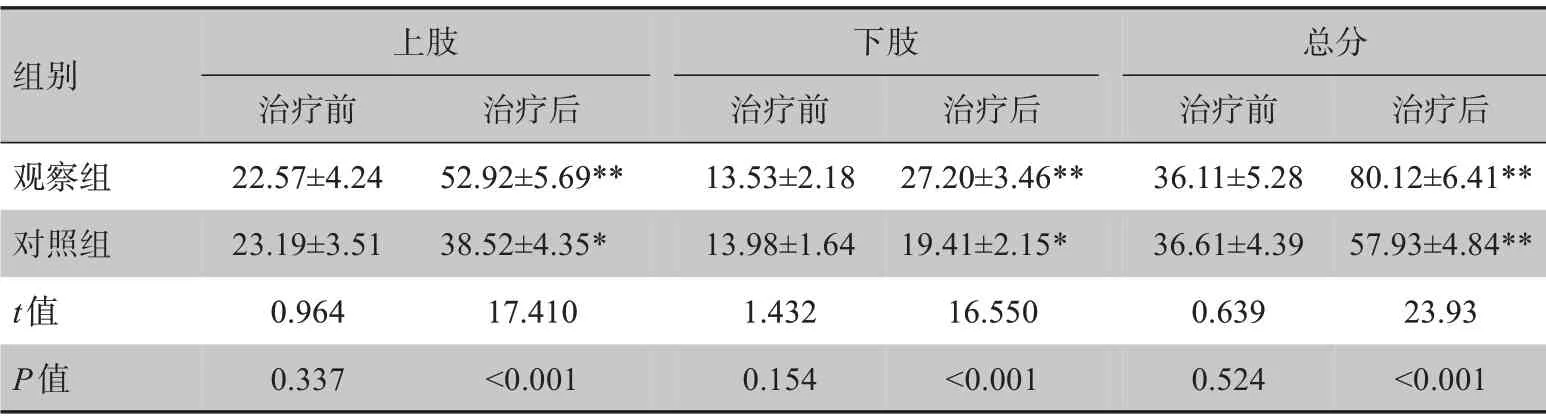
表2 两组患者运动能力Fugl-Mayer量表评分比较(± s)Table 2 Comparison of Fugl-Mayer assessment scale scores of motor ability between two groups (Mean±SD)
*:与治疗前相比,P<0.05,**:与治疗前相比,P<0.01
组别观察组对照组t值P值上肢治疗前22.57±4.24 23.19±3.51 0.964 0.337治疗后52.92±5.69**38.52±4.35*17.410<0.001下肢治疗前13.53±2.18 13.98±1.64 1.432 0.154治疗后27.20±3.46**19.41±2.15*16.550<0.001总分治疗前36.11±5.28 36.61±4.39 0.639 0.524治疗后80.12±6.41**57.93±4.84**23.93<0.001
2.3 平衡能力及生活能力评价
治疗前两组患者Fugl-Mayer 平衡能力评分及生活能力评分无显著差异(P>0.05);治疗后两组患者Fugl-Mayer 评分及生活能力评分均显著提高(P<0.05),且观察组患者两项评分显著高于对照组(P<0.05),见表3。
表3 两组患者平衡能力评分和生活能力评分比较(± s)Table 3 Comparison of assessment scale scores of balance and living ability between two groups(Mean±SD)
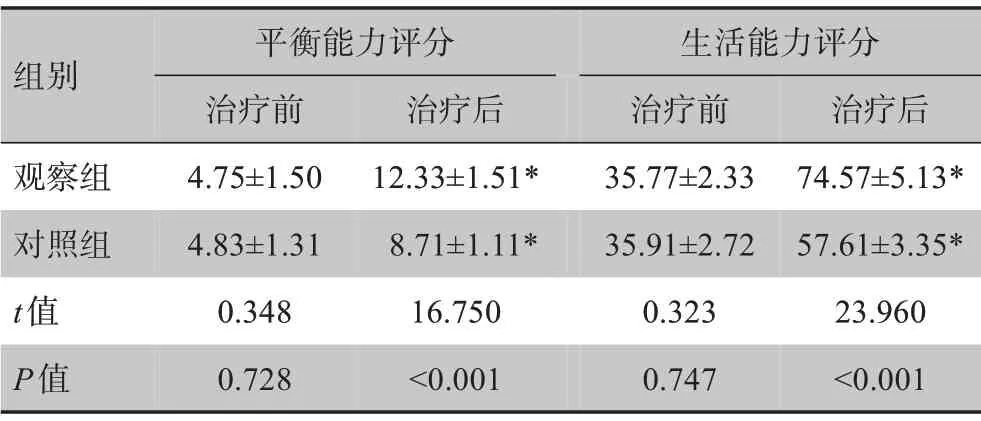
表3 两组患者平衡能力评分和生活能力评分比较(± s)Table 3 Comparison of assessment scale scores of balance and living ability between two groups(Mean±SD)
*:与治疗前相比,P<0.05
组别观察组对照组t值P值平衡能力评分治疗前4.75±1.50 4.83±1.31 0.348 0.728治疗后12.33±1.51*8.71±1.11*16.750<0.001生活能力评分治疗前35.77±2.33 35.91±2.72 0.323 0.747治疗后74.57±5.13*57.61±3.35*23.960<0.001
2.4 治疗有效性评价
与对照组相比,观察组治疗有效人数及有效率显著高于对照组,差异有统计学意义(P<0.05,表4)。
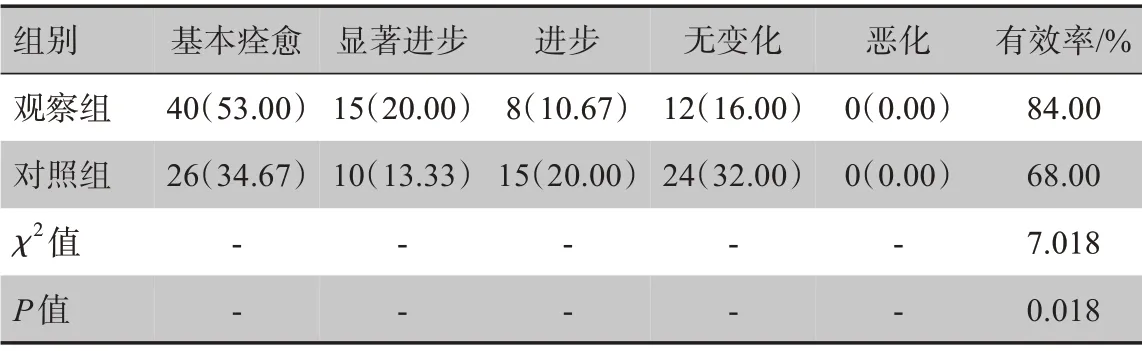
表4 两组患者治疗效果比较[例(%)]Table 4 Comparison of therapeutic effect between two groups[cases(%)]
3 讨论
脑卒中患者常存在运动平衡功能障碍、感觉障碍等诸多表现,其中,运动功能障碍是最常见表现[9]。跌倒是老年人伤害性死亡的第一大原因[10]。此外,运动功能损伤后长期卧床出现的下肢静脉血栓、坠积性肺炎、压疮等并发症,也大大增加了患者的疾病痛苦和经济负担[11]。因此,有效地恢复卒中患者的运动平衡功能对预防跌倒、防止继发性损伤极其重要。在神经系统疾病治疗中,TMS 是一种通过变化的磁场刺激进行治疗的方法。因其刺激区域可特异性定位到额叶、额中回、运动皮层等区域,TMS 被广泛运用于抑郁症、阿尔兹海默病以及脑卒中等疾病的康复治疗并取得了良好的临床疗效[12-13]。对卒中患者而言,康复期表现的功能缺失或功能障碍主要与病损脑区密切相关,实现损伤脑区的精确定位和精准化治疗对卒中患者的功能恢复至关重要[14]。据此,本研究观察CT定位下特定脑区的TMS对卒中后运动功能障碍患者的治疗效果。
下肢肌力是机体对抗重力、保持站立姿势的基础[15]。卒中后,由于运动皮层及运动相关脑区的损伤使下肢出现失神经性病变,即表现为肌力降低甚至肌肉组织萎缩等表现[16]。既往研究显示TMS通过变化的磁场刺激神经元电活动的变化,从而达到改变目标脑区活性[17]。本研究结果显示两组患者治疗后下肢肌力均显著提高,且与对照组相比,CT定位下特定脑区TMS治疗的观察组患者下肢肌力显著高于对照组。这表明卒中后运动功能障碍患者存在下肢运动控制脑区功能损伤,且针对病损脑区及对应健侧脑区的刺激有效改善了患者的下肢肌力水平[18]。除稳定的站立外,上下肢功能的精细化控制及协调活动对机体完成协调、稳定的运动,预防跌倒极其重要[16]。运动平衡功能的训练过程依赖于运动相关脑区及其上下游突触可塑性的提高。本研究结果显示观察组患者上下肢运动能力评分及平衡能力评分显著高于对照组,这可能与TMS 对特定脑区的电活动改变有关[19]。有研究显示突触可塑性依赖于神经元特定模式下高强度放电,从而调控突触相关蛋白的变化引起突触结构和功能的改变[20]。对病损脑区及健侧对应脑区的刺激有效促进了神经元的电活动改变,从而使运动相关病损脑区实现突触可塑性的增加,进而表现为运动和平衡控制功能的改善[21-22]。生活能力是卒中患者功能恢复的综合表现,是影响患者主观体验和自我效能感的重要因素[23]。治疗有效率是对卒中患者治疗效果的总体反映。本研究结果显示观察组患者的生活能力评分和治疗有效率显著高于对照组,这表明CT定位下TMS治疗对脑卒中患者康复的有效性显著高于常规治疗方法。综上所述,CT 定位下TMS 治疗对卒中后运动功能障碍患者疗效显著,其具体机制有待于神经生物学基础研究进一步揭示。
