乌头碱致HT22细胞凋亡的研究
2022-09-07刘奕伶唐丽辉赵文星郭梓豫吴可欣张云昊莫重辉赵宝玉
刘奕伶,唐丽辉,赵文星,王 辉,郭梓豫,吴可欣,张云昊,莫重辉,赵宝玉,路 浩*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.青海大学农牧学院,青海西宁 810016)
乌头(Aconitum)为毛茛科多年生草本植物,该属植物大部分块根内含有剧毒乌头碱,因此被列为有毒植物[1]。近年来我国牧区乌头等毒草大量滋生,家畜误食后中毒,对畜牧业发展造成极大危害[2-3]。乌头属有毒植物中含有多种毒性成分,主要为二萜类生物碱,常见的有乌头碱(aconitine)、中乌头碱(mesaconitine)、次乌头碱(hypaconitine)、异乌头碱(isoaconitine)等,其中乌头碱毒性最强[4]。动物中毒后临床表现为流涎、呕吐、腹痛、瞳孔散大、呼吸困难、运动中枢和感觉麻痹等[5]。
乌头碱的研究主要集中在药理作用方面,如强心[6]、抗炎[7]、抗肿瘤[8]、抗衰老及抗病毒[9]等,对其毒理研究较少。乌头碱的毒性主要是影响心脏、中枢神经系统和肌肉组织[10]。通过与生物膜上的脂质或蛋白质反应,刺激细胞促凋亡基因的表达增加,诱导动物组织细胞凋亡[11]。其在心肌细胞中促凋亡有剂量依赖性,通过p38/MAPK信号通路引起大鼠心律失常[12],通过线粒体、内质网通路等诱导细胞凋亡[13]。本研究以小鼠海马神经细胞(HT22)为研究对象,探讨乌头碱体外对HT22细胞凋亡的影响。
1 材料与方法
1.1 材料
1.1.1 细胞来源 HT22细胞,北京北纳创联生物技术研究院(BNCC)提供。
1.1.2 主要试剂 胎牛血清(FBS)和DMEM培养基,Gibco公司产品;胰蛋白酶和青链霉素,Hyclone公司产品;Annexin V-FITC/PI和Hoechst 33258,Solarbio公司产品;乌头碱(纯度98.36%),成都曼思特生物科技有限公司产品。
1.1.3 主要仪器设备 电子天平PTI-FA110,福州华志科学仪器有限公司;79-2双向磁力加热搅拌器、PHS-3E型酸度计和三用水箱,北京科伟公司;YI-CJ-IN型超净工作台,北京亚泰科隆公司;CKX31型倒置显微镜,日本Olympus公司;EPOCH酶标仪,美国BioTek公司;CO2恒温培养箱,美国Thermo Fisher Scientific公司;Axio Observer倒置荧光显微镜,德国Zeiss公司;BD-FACSAria型流式细胞仪,美国BD公司。
1.2 方法
1.2.1 小鼠海马神经细胞复苏与培养 冻存的HT22细胞于37℃水浴解冻,用DMEM完全培养基于37℃、体积分数为5%的CO2培养箱中培养,待细胞铺满培养皿底部80%时传代并进行细胞计数。
1.2.2 小鼠海马神经细胞存活率测定 取对数生长期细胞,按常规方法制成细胞悬液,以1.5×103个/孔均匀接种至96孔板中,设不加细胞的调零孔,置于37℃、体积分数为5% CO2饱和湿度培养箱中预培养,待细胞进入对数生长期,用乌头碱分别处理HT22细胞6 h和12 h。试验分阴性对照组为HT22细胞、培养液、无药物;处理组为HT22细胞、培养液、乌头碱(0、50、100、200 μg/mL)。按照MTT试剂盒说明检测细胞存活率(将含有乌头碱的培养液吸弃,每孔加入含5 g/L的MTT培养液,4 h后将培养液吸弃,每孔加入100 μL二甲基亚砜,低速振荡10 min后用酶标仪OD490 nm测吸光度值),细胞存活率=(处理组OD值-调零孔OD值)/(阴性对照组OD值-调零孔OD值)×100%。
1.2.3 小鼠海马神经细胞核荧光染色 取对数生长期的细胞,按常规方法制成细胞悬液,4.5×104个/孔均匀接种至6孔板中,设不加细胞的调零孔,置于37℃、体积分数为5% CO2饱和湿度的培养箱中预培养,待细胞进入对数生长期,用乌头碱分别处理HT22细胞6 h、12 h。试验分组同1.2.2,按照Hoechst 33258试剂盒说明对细胞核染色(将含有乌头碱的培养液吸弃,加入Hoechst固定液0.5 mL,37℃孵育20 min后吸弃,PBS缓慢振荡漂洗3次,加入Hoechst 33258染色液0.5 mL,继续孵育5 min后吸弃),用荧光显微镜对HT22细胞进行凋亡形态学检测。
1.2.4 小鼠海马神经细胞凋亡率测定 取对数生长期细胞,按常规法制成细胞悬液,以1.0×105个/皿的细胞密度均匀接种至60 mm细胞培养皿,在培养箱中预培养,待细胞进入对数生长期,用乌头碱分别处理HT22细胞6 h、12 h。试验分组同1.2.2,按照Annexin V-FITC/PI试剂盒说明对细胞进行染色(收集细胞,PBS洗涤后重悬,使细胞密度达1×106个/mL,每管加入100 μL细胞和5 μL Annexin V-FITC,室温避光,轻轻振荡10 min,加入5 μL PI,室温避光孵育5min,加入PBS至500μL,轻轻混匀),用流式细胞仪检测HT22细胞凋亡率。
1.2.5 数据分析 用SPSS20.0软件对数据进行方差分析,P<0.05差异显著,P<0.01差异极显著。
2 结果
2.1 乌头碱对小鼠海马神经细胞存活率影响
不同浓度乌头碱处理HT22细胞6 h、12 h,MTT法检测细胞存活率,乌头碱抑制细胞生长有时间-剂量依赖性。与对照组相比,50 μg/mL乌头碱作用6 h对细胞存活率无影响,其余剂量和作用时间细胞存活率均极显著降低(P<0.01)(图1)。

与各自空白对照组相比,*P<0.05,**P<0.01 *P<0.05,**P<0.01,compared to the control group
2.2 乌头碱对小鼠海马神经细胞核的影响
不同浓度乌头碱的细胞染色后,荧光显微镜可见对照组细胞核为蓝色,圆形或卵圆形,呈弥散均匀荧光;试验组细胞核有不同程度的致密浓染,部分呈颗粒状、碎块状、边集呈新月形(图2)。
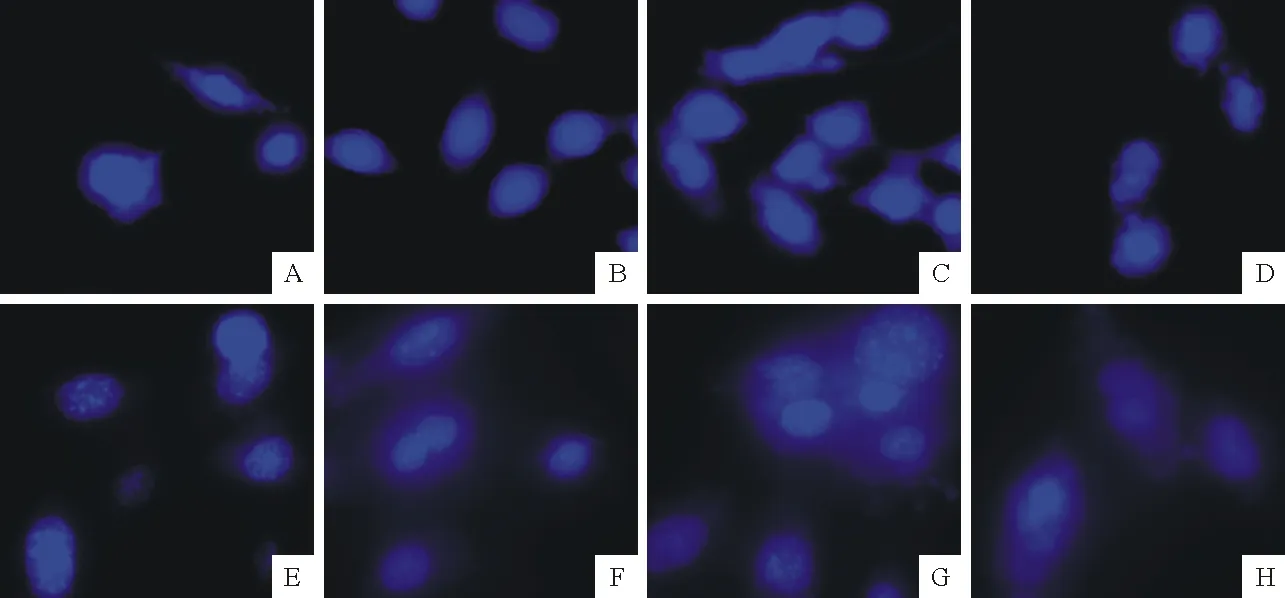
A.6 h,0 μg/mL;B.6 h,50 μg/mL;C.6 h,100 μg/mL;D.6 h,200 μg/mL;E.12 h,0 μg/mL;F.12 h,50 μg/mL;G.12 h,100 μg/mL;H.12 h,200 μg/mL
2.3 乌头碱对小鼠海马神经细胞凋亡率的影响
图3中左下象限Q4代表正常活细胞,Annexin V-FITC-/PI-;右下象限Q3代表早期凋亡细胞,Annexin V-FITC+/PI-;右上象限Q2代表坏死细胞或晚期凋亡细胞,Annexin V-FITC+/PI+;左上象限Q1代表细胞收集过程中出现的损伤细胞,V-FITC-/PI+。从图3可以看出,用不同浓度(0、50、100、200 μg/mL)乌头碱处理HT22细胞6 h或12 h后,在相同时间下,不同浓度乌头碱处理组的正常细胞比例明显下降,凋亡细胞比例显著上升(P<0.05);随乌头碱浓度的增加,凋亡的HT22细胞显著增加,呈现明显剂量-效应关系(图4)。
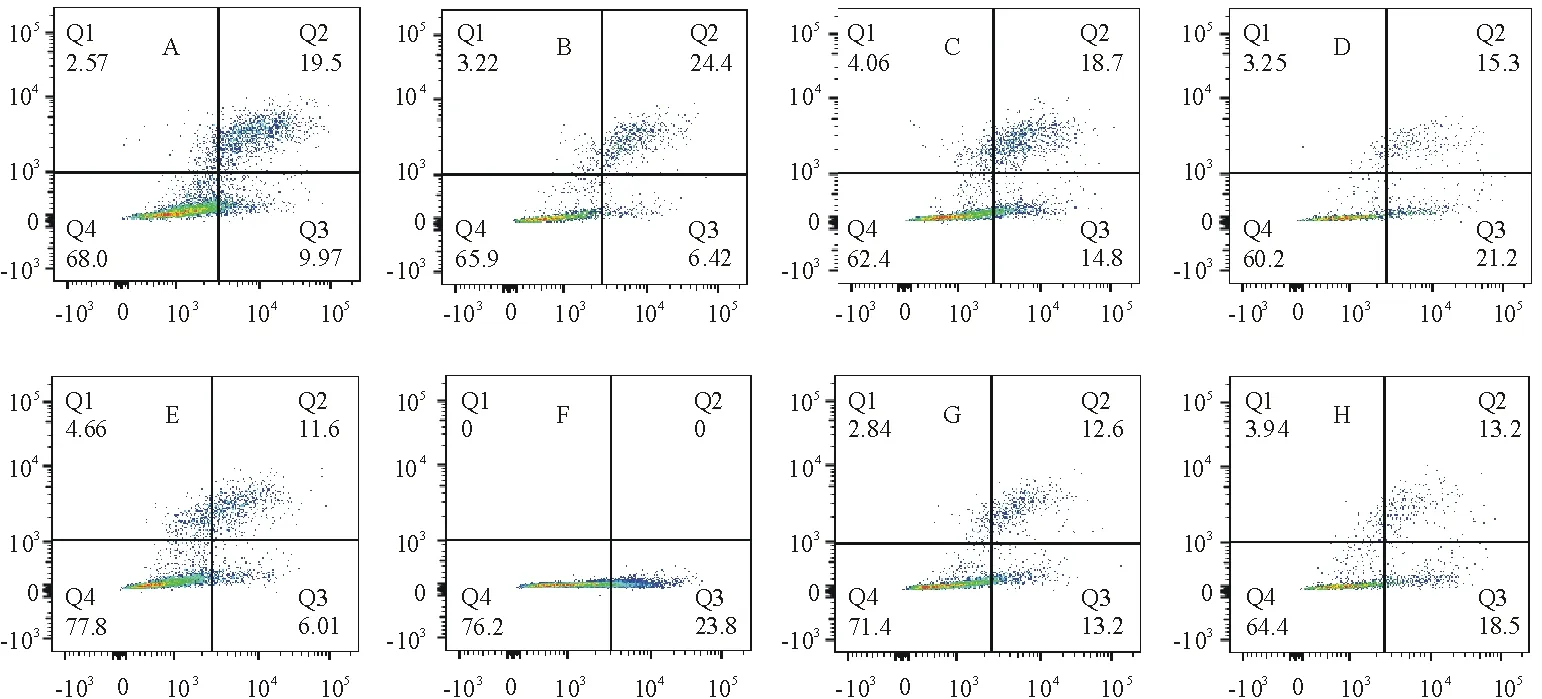
A.6 h,0 μg/mL;B.6 h,50 μg/mL;C.6 h,100 μg/mL;D.6 h,200 μg/mL;E.12 h,0 μg/mL;F.12 h,50 μg/mL;G.12 h,100 μg/mL;H.12 h,200 μg/mL

与各自空白对照组相比,*P<0.05,**P<0.01 *P<0.05,**P<0.01,compared to the control group
3 讨论
乌头碱可使中枢神经系统及周围神经先兴奋后麻痹,影响细胞内离子和神经递质的浓度,阻止冲动的发生和传导,从而损害细胞形态和功能[14],造成呼吸困难、全身麻木、意识模糊、反应迟钝、阵发性抽搐等症状[15]。乌头碱作用于心肌细胞,使心室内异位起博点的兴奋性增高和产生折返激动,形成单源或多源多形室性早搏、室性心动过速、心室颤动等[11,16]。 乌头碱也可引起细胞凋亡[17]。用乌头碱给大鼠灌胃后,大鼠心肌细胞、肝细胞、肾小管上皮细胞等均发生凋亡;细胞凋亡的典型变化包括细胞皱缩,DNA片段化,染色质高度浓缩,细胞核内缩、碎裂、形成新月形,细胞膜内陷和线粒体分解等[18]。Annexin V/PI双染法可用于检测凋亡的细胞,Annexin V是Ca2+依赖性的磷脂结合蛋白,能够与细胞凋亡时外翻至细胞膜外的磷脂酰丝氨酸(PS)结合,Annexin V标记上FITC,可用荧光显微镜进行观察;PI是一种依赖膜通透性的染料分子,通过FITC和PI的联合使用,可有效检测细胞凋亡的发生。
本研究用DNA特异性染料Hoechst 33258对HT22细胞进行染色,荧光显微镜观察HT22细胞核的形态学变化,结果显示各处理组细胞核均有不同程度的致密浓染,核固缩、核碎裂、部分呈颗粒状、碎块状、边集呈新月形等凋亡细胞特征,不同浓度乌头碱可引起HT22细胞发生凋亡。用Annexin V/PI处理HT22细胞不同时间后,用流式细胞仪检测发现,乌头碱致HT22细胞凋亡呈明显剂量-效应关系,随着处理时间的延长,HT22细胞的凋亡率呈下降趋势。乌头碱可通过清除线粒体活性氧达到保护细胞的目的[13],可能是乌头碱致HT22细胞损伤过程中触发了某种机制,如自噬、氧化应激等,对细胞凋亡起到拮抗作用,逆转了部分凋亡[19]。
乌头碱可以引起HT22细胞凋亡,在HT22细胞凋亡中是否有自噬、坏死等及乌头碱引起HT22细胞凋亡的信号转导通路还有待进一步研究。