去泛素化酶在肿瘤上皮间质转化中的作用
2022-09-06戴京,叶茂
戴 京, 叶 茂
(湖南大学生物学院分子科学与生物医学实验室,长沙 41000)
肿瘤的侵袭和转移是肿瘤的一大恶性特征,也是导致肿瘤治疗效果不佳,肿瘤患者死亡率居高不下的重要原因之一。大量的研究表明,肿瘤在转移过程中通常伴随着上皮间质转化(epithelial-mesenchymal transition, EMT)现象的发生,因此,有效抑制EMT的发生将为阻止肿瘤的转移提供的可能。EMT是指上皮细胞失去极性转为间质细胞的过程,而正是这种极性的丧失为肿瘤的转移和远端定植奠定了基础。大量蛋白质分子过表达和信号通路的过度活化通常会促进EMT的发生。去泛素化酶利用自身的酶活性以维持这些分子高表达,以及通路的活化进而促进EMT。以这些去泛素化酶作为可能的治疗靶点将为肿瘤的治疗提供可能性和有效的治疗手段。
1 泛素蛋白酶体系统
泛素是指一种具有76个氨基酸的小分子多肽,普遍存在于真核生物中,并具有高度的保守性。泛素化修饰是一种重要的蛋白质翻译后修饰。它是泛素分子在一系列的酶的作用下,与靶蛋白质共价结合的修饰过程。蛋白质的泛素化修饰主要有单泛素化修饰和多聚泛素化修饰两种形式,多聚泛素化修饰包括K6、K11、K27、K29、K33、K48和K63位的修饰,其中以K48、K63位多聚泛素化修饰研究居多,K48位的多聚泛素化修饰主要发挥降解和调控蛋白质稳定性的作用,K63位作用主要是介导信号转导、参与DNA修复和调控蛋白质的活性[1]。蛋白质泛素化修饰参与调控包括细胞周期、细胞凋亡、转录调控、DNA损伤修复以及免疫应答等在内的多种细胞活动[2]。蛋白质泛素化降解是泛素化修饰一种常见的作用结果。真核细胞内80%~85%的蛋白质都是通过泛素-蛋白酶体途径进行降解[3]。泛素蛋白酶体途径主要过程是由ATP供能。泛素活化酶E1将游离的泛素分子活化,即游离的泛素的C端甘氨酸与活化酶E1的半胱氨酸残基相连;泛素结合酶E2将活化的泛素分子通过硫酯键结合到其高度保守的泛素结合结构域(UBC)的半胱氨酸残基上,形成E2-泛素复合物;最后泛素连接E3将泛素分子特异性转移到靶蛋白质上,并被26S蛋白酶体识别和降解[4,5]。
与其他的翻译后修饰类似,在生物体内的泛素化修饰也是一个被严格调控的可逆过程。去泛素化酶(deubiquitinating enzymes, DUBs)能够移除底物蛋白质上的单泛素分子或多聚泛素链,逆转泛素化过程。人类基因组可编码100多种去泛素化酶,其主要可分为半胱氨酸蛋白酶和金属蛋白酶两大类,半胱氨酸蛋白酶可细分为ubiquitin-specific proteases(USPs)、ubiquitin carboxyl-terminal hydrolases(UCHs)、otubain/ovarian tumor-domain containing proteins(OTUs)、Machado-Joseph disease domain superfamily(MJDs)、motif interacting with Ub-containing novel DUB family(MINDYs)、zinc finger-containing ubiquitin peptidase 1(ZUP1)六大家族;金属蛋白酶因含有JAMMs结构域而又被称为JAMM蛋白质家族[6]。DUBs除了能够逆转底物蛋白质的泛素化修饰外,还参与泛素链的编辑,泛素分子的回收以及泛素前体的加工和成熟[7]。因此,去泛素化酶的异常表达或活化都会直接或间接影响相应的信号通路,进而导致肿瘤等多种人体疾病。
2 上皮间质转化与肿瘤
EMT是指在特定的生理和病理情况下,上皮细胞失去极性转变为具有一定的迁移能力间质细胞。在此过程中细胞表型相关的标志物也发生了改变,其主要表现为上皮标志物E-钙黏着蛋白(E-cadherin)和角蛋白(cytokeratin)表达下调,而间充质表型标志物波形蛋白(vimentin)和N-钙黏着蛋白(N-cadherin)表达增加,与此同时细胞的形态由圆形变为梭型,细胞间的连接松散,细胞的运动和迁移能力得到显著的增加。EMT在人体生理或病理条件下表现出重要的意义。根据EMT所发生的特定生物学环境,可将EMT分为3种亚型[8]。1型EMT与胚胎植入、发育和器官形成相关。通过这种转化,上皮细胞获得了能够在细胞外基质中迁移的表型,并迁移到特定的部位参与组织的形成;2型EMT与组织再生、损伤修复和器官纤维化相关。通过产生纤维细胞,从而修复由创伤和炎症反应造成的组织损伤。3型EMT是指恶性肿瘤发生时,上皮样细胞转化为间质样细胞的过程,与肿瘤相关的表型转化相关。这些细胞通常位于肿瘤周边,通过EMT获得局部和全身的侵袭能力,最终导致肿瘤的转移。
EMT与肿瘤的起始、肿瘤干性、肿瘤迁移和转移,以及耐药等多种恶性行为密切相关[9-11]。EMT作为肿瘤细胞发生转移的关键事件,绝大部分肿瘤的转移都伴随着EMT的发生。EMT过程涉及细胞极性的丧失,细胞间的黏附被破坏以及迁移能力的获得,这使得肿瘤细胞的侵袭能力增强,为细胞的转移创造了条件,从而促进细胞穿过基底膜进入全身循环系统[12]。上皮细胞间通过各种细胞黏附因子进行连接,形成具有极性的细胞层,并通过基底膜将细胞锚定在基质表面,使得细胞被固定[13]。在发生EMT时,细胞通常会高表达参与细胞外基质和基底膜降解的相关蛋白质,使得原有的组织学屏障被破坏,便于肿瘤细胞从原发灶脱落导致侵袭和转移的发生。EMT在维持肿瘤的干性中发挥重要的作用,是导致肿瘤干细胞和非肿瘤干细胞间的差异的重要原因[14,15]。在许多的肿瘤中,富含肿瘤干细胞的亚群常表现出更高的EMT活性,具有很强的成瘤能力,可以随着肿瘤细胞的转移而定植于其他的器官形成新的肿瘤灶[16]。EMT与肿瘤的耐药以及复发密切相关,这也是导致患者预后不良的一个重要原因。研究发现,在前列腺癌和胰腺癌等多种癌症,EMT能够明显降低药物的治疗功效,其主要原因是EMT与肿瘤耐药间的信号通路存在着相互间的串扰[17]。大部分的化疗药物都是通过诱导肿瘤细胞凋亡而发挥抗肿瘤作用,而EMT能够驱动肿瘤细胞抵抗凋亡,使肿瘤细胞产生耐药性[18]。
3 去泛素化酶与上皮间质转化
EMT是一个动态的细胞生物学过程,在该过程中涉及到EMT相关转录因子(Snail,Twist和ZEB等)和细胞表面的分子标志物以及相关信号通路中的多种蛋白质表达水平的变化,而在上皮细胞中这些蛋白质具有不稳定性,易被降解。要保证该生物过程的正常进行,去泛素化酶在调节这些蛋白质稳定中发挥着重要作用(Table 1)。
3.1 去泛素化酶与上皮间质转化分子标志物
在细胞发生EMT过程中,细胞表面多种蛋白质表达水平会出现显著变化,这些蛋白质被称为EMT分子标志物,主要的分子标志物有E-钙黏着蛋白(E-cadherin)、N-钙黏着蛋白(N-cadherin)和波形蛋白(vimentin)等。E-钙黏着蛋白是一种Ca2+依赖,与细胞间黏附密切相关的跨膜蛋白质,是典型上皮细胞标志物。作为肿瘤抑制者,E-钙黏着蛋白的表达缺失会导致细胞的去分化和增加肿瘤的侵袭性[19,20]。在上皮细胞中,Kruppel-like factor 3(KLF3)能够招募USP47到细胞连接处,通过抑制E-钙黏着蛋白的泛素化,增加其稳定性,使得细胞间连接得以加强[21]。E3泛素连接酶MARCH7能够调控E-钙黏着蛋白和β-联蛋白(β-catenin)的表达。在卵巢癌中,USP7通过逆转MARCH7自身的泛素化,并稳定MARCH7,从而介导E-钙黏着蛋白和β-联蛋白的表达[22]。波形蛋白是中间丝家族的主要组成部分,在正常的间质充细胞中广泛表达,而被认为是间质型细胞的主要分子标志物。波形蛋白在多种肿瘤中过度表达并与肿瘤生长,侵袭和预后不良相关。波形蛋白表达的增加已成为EMT发生的一个重要标志[23]。USP14能够去泛素化波形蛋白并使其稳定,进而促进胃癌细胞发生EMT[24]。在非小细胞肺癌中,Beclin 1(BECN1)能够与波形蛋白和USP14相互作用,从而介导USP14对波形蛋白的去泛素化作用[25]。
3.2 去泛素化酶与上皮间质转化调控因子
EMT分子标志物的表达受到不同转录因子的严格调控,这些转录因子统称为调节EMT的转录因子(EMT-TFs),其主要包括Snail、Slug、Twist1、Zinc finger E-box-binding homeobox 1 and 2(ZEB1/2)[26]。EMT-TFs是极不稳定的蛋白质,在蛋白质水平上受到泛素蛋白酶体系统的严格控制。Snail和Slug都是Snail家族的主要成员,他们能够识别并通过锌指结构与E-钙黏着蛋白的启动子的E-box区结合,并招募组蛋白去乙酰化酶和DNA甲基转移酶等,从而抑制E-钙黏着蛋白的表达[27,13]。在IL-6条件下,DUB3能够对Snail和Slug去泛素化,并使二者稳定进而诱导乳腺癌EMT以及肿瘤细胞的迁移、侵袭和转移[28,29]。除DUB3外,USP5和USP10、USP20也可以作为Slug的去泛素化酶,参与调节Slug稳定[30,31]。在不同的条件下,Snail的稳定性也受到PSMD14、OTUB1、USP47、USP27X[32]、USP11[33]、USP26[34]、USP37[35]、USP29[36]、USP3[37]和USP1[38]等多种去泛素化酶的调节。Twist1是Twist家族成员,具有典型的螺旋-环-螺旋结构,它能够与E-钙黏着蛋白的启动子区结合,并通过招募染色质修饰物来抑制其表达,进而促进EMT。DUB3除了作为Snail和Slug的去泛素化酶,DUB3也能够参与调节Twsit1的稳定,表明DUB3可能是EMT的关键调控者[29]。此外在三阴性乳腺癌中USP2也能够调节Twist的稳定进而促进乳腺癌EMT的发生与增加肿瘤干性[39]。ZEB1和ZEB2隶属于ZEB蛋白质家族,可通过其锌指结构与E-钙黏着蛋白、ZO-1等基因启动子元件近端的E-box区结合,调控靶基因的转录和表达,促进EMT的发生。此外,ZEB1和ZEB2还能够活化N-钙黏着蛋白、基质金属蛋白酶(MMPs)间质基因的表达[13]。研究发现,USP51与COPS5通过稳定ZEB1的表达促进EMT的发生,导致肿瘤侵袭和转移能力增加[40]。在DNA损伤时,ATM激酶可磷酸化ZEB1,促进ZEB1直接与USP7相互作用,增强其去泛素化和稳定CHK1的能力,调控DNA修复和抗辐射性,表明ZEB1可能是EMT和DNA损伤修复趋同调节者[41]。
3.3 去泛素化酶与上皮间质转化信号通路
EMT是一个极其复杂的过程,例如TGF-β、Wnt/β-catenin等众多细胞内信号转导途径参与EMT过程。大量研究显示,一些去泛素化酶通过靶向于这些信号转导途径的关键蛋白质,间接调控肿瘤细胞EMT发生。TGF-β是诱导EMT发生主要刺激因子之一,它能够通过SMAD或非SMAD依赖的信号通路,诱导Snail、ZEB1、Twist等E-钙黏着蛋白转录抑制因子的表达,进而诱导EMT的发生。当细胞受到TGF-β刺激后,会活化Smad2/3与Smad4形成三聚体复合物并发生核转位,启动下游Snail和其去泛素化酶USP27X等靶基因的转录[33]。在正常细胞中TGF-β信号也受到反馈机制调节,其靶基因Smad7是主要反馈调节者,其主要作用机制是干扰Smad2/3与TGF-βR1受体的结合,以及招募泛素化酶对受体进行泛素化降解,抑制通路的活化[42]。在肿瘤细胞中,USP11[43]、OTUD4[44]、USP15[45]、USP4[46]和UCH37[47]、能够逆转TGF-βR1受体的泛素化,促进EMT的发生和癌细胞的转移。此外,OTUD1和CYLD分别通过稳定TGF-β负向调控者Smad7或调节其活性,进而抑制TGF-β通路的活化,阻止乳腺癌的转移[48-50]。TGF-β通路主要功能行使者Smad2/3与Smad4三聚体复合物,也受到各种去泛素化酶的调控。OTUB1、USP15、USP9X和Proteasome 26 S Subunit, Non-ATPase 14(PSMD14)通过分别稳定Smad2/3、Smad4来调节该三聚体的表达水平,影响下游靶基因的转录[51-53]。
Wnt/β-catenin信号通路不仅在胚胎发育中发挥了一定的作用,而且与许多人类肿瘤的发生发展也有密切联系。在存在Wnt配体情况下,卷曲蛋白(frizzled,Frz)和low-density lipoprotein-related receptors 5 and 6(LRP5/6低密度脂蛋白质受体相关蛋白质)受体的共激活作用会阻止破坏复合物的形成,抑制GSK-3β的活性,从而稳定细胞内β-联蛋白并最终导致其向核内转位,核内的β-联蛋白作为共转录激活因子介导C-myc等下游靶基因的广泛表达,调节细胞干性、增殖以及EMT的发生等[54]。此外,GSK-3β的活性受到抑制时,其对转录因子Snail的磷酸化作用减弱,导致Snail的降解途径被阻断,在细胞核内的蓄积增加,进而抑制E-钙黏着蛋白的表达,促进EMT的发生和肿瘤转移[55]。研究发现,UCHL1能够依赖其去泛素化酶活性来抑制β-联蛋白的降解,诱导EMT,促进结肠癌的淋巴结转移[56,57]。除UCHL1外,UCH37也能够抑制β-联蛋白的降解增加细胞的运动能力,促进细胞的迁移[58]。在脊椎动物发育早期,UCH37通过介导Tcf7去泛素化作用,使得β-联蛋白能够与Tcf7结合,启动下游基因的转录,使Wnt信号得到激活[59]。
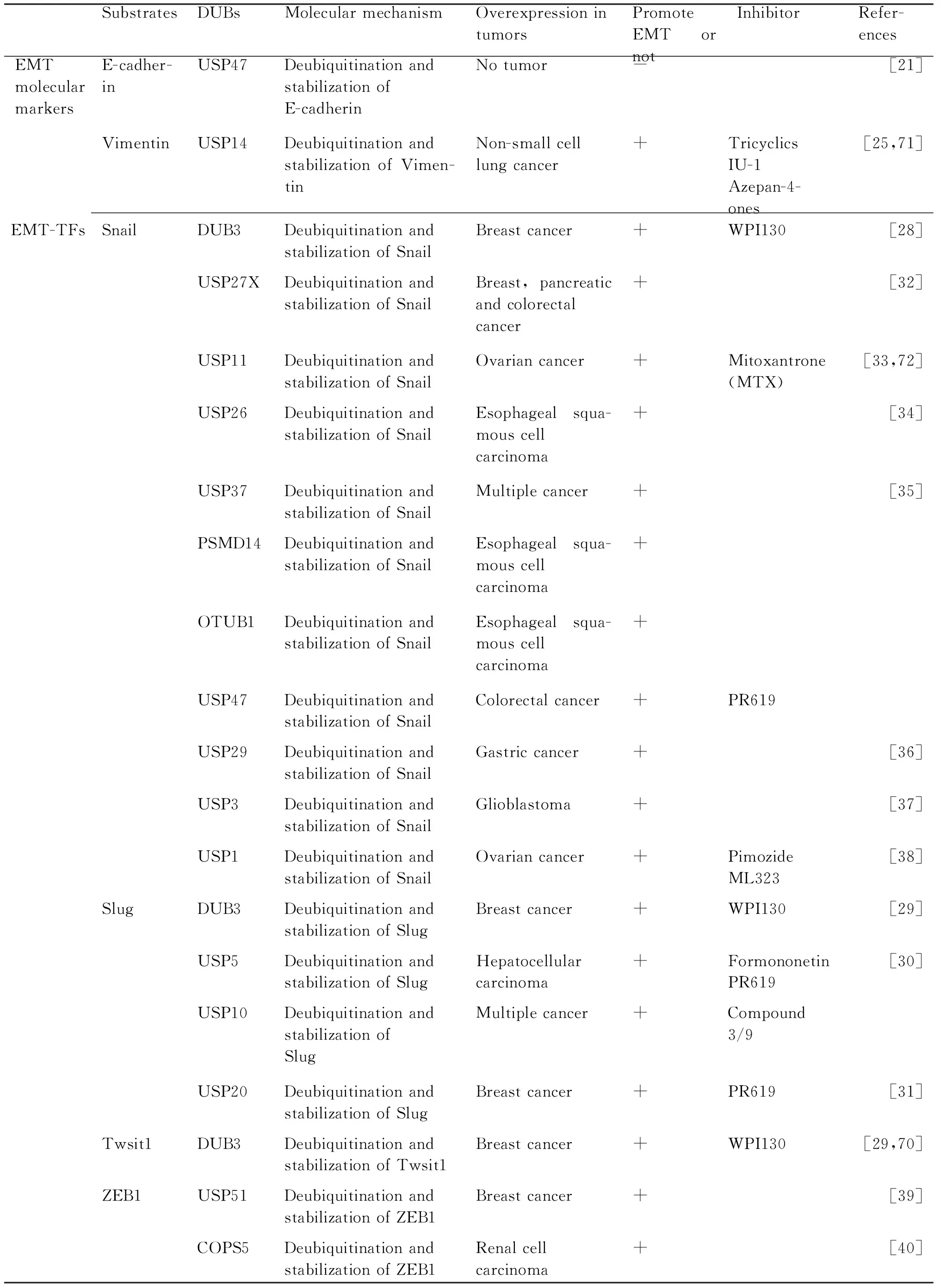
Table 1 DUBs and EMT
在USP家族中,USP4、USP20也能够通过稳定β-联蛋白,从而参与Wnt/β-catenin通路诱导EMT,促进肿瘤细胞的迁移和侵袭[60,61]。此外在肝癌中β-联蛋白的表达也受到USP9X的调控[62]。Axis inhibition protein (Axin)是β-联蛋白的降解复合体主要成分,其自身的降解也受到USP34的调控,表明USP34可以参与Wnt/β-catenin通路的调节,诱导EMT的发生[63]。此外在结肠癌中,USP44通过稳定Axin进而抑制Wnt/β-catenin通路的活化而发挥抑制抑癌的作用[64]。Axin也受到USP25的间接调控,USP25与鞣酸酶(tankyrases)存在直接的相互作用,促进其去泛素化和稳定,而鞣酸酶能够促进Axin的降解使得β-联蛋白免于泛素化的降解。因此USP25能够控制鞣酸酶稳定性来调控Wnt信号通路[65]。此外,USP7与Ring Finger Protein 220(RNF220)相互作用进而控制β-联蛋白的稳定,活化Wnt信号通路[66]。有趣的是,近期丛枫等人研究发现,USP7通过去泛素化并稳定Axin,从而抑制Wnt/β-catenin信号,形成这样悖论的潜在原因可能是由于敲低USP7的表达使得细胞内的Mouse double minute 2 homolog(MDM2)蛋白迅速降解,导致p53所诱导的细胞凋亡增加,大量基因异常表达,而产生USP7能够促进Wnt/β-catenin信号的活化假阳性结果;也可能是由于先前研究所利用的USP7的抑制剂缺乏精准的靶向性,造成早期的USP7小分子抑制剂可能存在脱靶风险,这种脱靶现象在利用相同浓度的USP7早期抑制剂不仅能够降低Wnt通路活性,而且也使得细胞增殖受到抑制的实验中得到了验证;表明早期的USP7的小分子抑制剂的脱靶也是一个潜在的因素[67]。

Fig.1 The role of deubiquitinating enzymes in TGF-β and Wnt signaling pathways The activation of TGFβ and Wnt pathways promotes EMT by promoting Smad2/3/4 and β-catenin to enter the nucleus to regulate the transcription of EMT-related genes. DUBs affect the activation of this pathway by regulating related molecules and EMT
4 问题与展望
去泛素化酶通过各种方式广泛参与EMT过程,介导肿瘤的侵袭和转移。大部分的DUBs都存在多底物的情况,因此研发靶向于特定DUBs的药物,能够达到类似于多靶点治疗的效果,这或许为肿瘤的治疗提供一个新的策略。目前通过靶向于DUBs来抑制EMT和肿瘤的迁移与转移的小分子抑制剂已经取得部分进展。例如芒柄花黄素(formononetin)能够与USP5结合,并抑制其对Slug去泛素化的活性,从而阻碍了EMT和肝细胞癌的恶性进展[30]。DUB3可能作为EMT的关键调控者之一,WPI130、Patrin-2、PD033299等多个抑制剂直接或间接作用于DUB3活性与表达,进而抑制EMT的发生[29,68,69]。除DUB3外,WPI130还可以作为USP5、USP9X、USP14、UCH37、UCHL1等多个去泛素化酶的靶向抑制剂[70]。USP14在肿瘤的发生发展以及转移过程中都发挥重要的作用,因此也已研发Tricyclics、Azepan-4-ones、IU-1和IU1-147等多个针对USP14的小分子抑制剂[71]。此外Mitoxantrone能够有效抑制USP11的活性,从而阻碍TGF-β诱导下EMT的发生[72]。由于DUBs存在着多底物的特征,因此对于靶向于DUBs小分子药物的研发,这意味着我们需要对于相应的DUBs作用机制以及作用的底物有足够认识。目前对于DUBs作用底物的筛选通常依赖于质谱技术,这可能存在一定程度的假阳性,增加筛选过程的复杂性,因此,提高质谱技术的精密度,能够有效的获取到相应的DUB作用的底物,或者对开发更为高效的底物筛选策略具有重要意义。虽然众多的DUBs的底物被发现,但是对于不同的DUB识别和作用底物是否依赖于特定的基序的机制或规律,并未像部分泛素连接酶或激酶那样得到系统性的解决。尽管对于DUBs的分子结构有较为清晰的认识,但DUBs在不同的条件下或者作用于不同底物通常存在着变构现象,这也为开发相应的靶向小分子药物提出了更大的挑战。此外,DUBs广泛参与肿瘤细胞的侵袭和迁移等各项生命活动,然而目前仅有一小部分的DUBs在其中得到较为广泛的研究,因此对于更多的DUBs进行更为广泛的研究显得十分有必要。泛素化修饰作为蛋白质一种重要的翻译后修饰,与其他的翻译后修饰存在着相互的串扰,而DUBs在不同的翻译后修饰之间的功能作用还依旧不清楚,其他的翻译后修饰对于DUBs活性的调节,以及底物的识别机制也认识不足。蛋白质的泛素化修饰、在调节蛋白质非稳定性方面也具有重要的作用,并且与肿瘤的发生发展密切相关,然而DUBs在调节蛋白质非稳定性方面的研究仍相对较少,因此增加该方面的研究,这将有利于全面认识DUBs的生物学功能。DUBs在肿瘤EMT过程发挥着重要的作用,靶向于DUBs抑制肿瘤的侵袭和转移将更为肿瘤治疗提供新的治疗手段和方案,从而有效的推动肿瘤的治疗。
