东太湖浮游植物与浮游动物群落的嵌套性及其互作网络的季节特征*
2022-09-05张亚洲姜星宇邵克强汤祥明
胡 洋,张亚洲,姜星宇,邵克强,汤祥明,高 光
(1:中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,南京210008) (2:江苏省太湖水利规划设计研究院有限公司,苏州215000)
浮游生物主要由浮游植物和浮游动物组成,是湖泊生态系统的重要组成部分. 湖泊富营养化导致了浮游植物生物量快速增加和蓝藻水华的频繁发生. 为了抑制浮游植物的过度增殖,湖泊生态系统进化出了一系列自组织和自适应机制以维持系统自身的稳定性. 其中之一便是浮游动物通过下行效应控制浮游植物,尤其是可食藻类的生物量. 因而浮游动物与浮游植物之间的关系不仅可以反映浮游生物的群落特征,还可表征湖泊生态系统的状态[1]. 因此,研究浮游植物和浮游动物群落的时空格局及其相互关系对于指示湖泊生态系统的特征和阐明湖泊生态系统的演化具有十分重要的意义.
群落的嵌套性分布影响着群落组成、多样性及生态功能特征. 然而到目前为止,浮游生物的嵌套性特征仍未受到关注. 作为生物分布格局的重要特征,嵌套性最早可追溯至鸟类岛屿生物地理学的研究,指的是物种较贫乏岛屿中的群落组成是物种较丰富岛屿中群落组成的子集[2],或指群落中特化种是泛化种的子集[3]. 这种分布现象在越来越多的生物群落中得到发现,如菌根微生物[4]、底栖生物[5]和鱼类肠道寄生生物[6]等. 那么,生物群落出现嵌套性格局的构建机制是什么呢?目前,学术界提供了4种假说:选择性灭绝假说、选择性迁入假说、生境异质性假说以及被动取样假说[7]. 相较而言,生境异质性假说得到了广泛认同,有力地解释和阐明了生物嵌套性格局的形成过程. 除此之外,嵌套性结构的生态学意义也成为生态学研究的中心任务:在物种水平,嵌套性有助于减小生物间的竞争,促进物种的共存,增加生物多样性[8]. 在群落水平,嵌套性则可以提高其稳定性,降低外界干扰对群落的胁迫[9]. 然而,对于浮游植物和浮游动物而言,它们的群落是否存在嵌套性分布?如果存在,这种嵌套性结构的时空格局有何特点?
以物种为节点,互作关系(主要包括协作和拮抗)为连接,生物群落形成了复杂的互作网络. 研究表明群落的互作网络具有十分重要的生态学意义,与物种的进化、群落的构建乃至生态系统功能都密切相关. 以植物-植食性昆虫的交互网络为例[10],在物种水平上,种子植物通过突变和基因重组产生一系列的次生物质,以降低植食性昆虫的嗜食过程;与此同时,植食性昆虫通过协同进化产生新的适应性继续嗜食过程. 在群落水平上,植物的防御性进化使得昆虫群落中特化种的增加和泛化种的减少,从而改变了群落的组成特征. 浮游植物和浮游动物通过牧食与被牧食的营养联系也构成了复杂的互作网络. 然而,浮游生物之间的互作关系受到群落多样性、可利用资源以及生境异质性等的影响,这使得构建生物间复杂的互作关系极具挑战性. 幸运的是,近年来网络科学的快速发展为建立复杂的生物关系提供了可能,譬如利用图论模型构建蜜蜂与花朵之间的授粉关系[11]、真菌与森林植物的感染关系[12]等. 因此,在湖泊生态系统中浮游生物之间的互作网络的特点、网络拓扑关系及其驱动机制有待研究.

图1 东太湖采样点位分布Fig.1 Sampling sites in East Lake Taihu
为此,本研究选择东太湖为研究区域,以浮游植物和浮游动物为研究对象,通过不同季节的观测调查,旨在研究其浮游生物群落的嵌套性结构及其互作网络特征,并揭示其驱动机制,以期为湖泊生态系统的研究提供新的视角.
1 材料与方法
1.1 采样点位布设及样品采集

浮游植物用采水器取表层水样1000 mL(距水面约0.5 m),立即加入鲁哥试剂固定(终浓度1%),自然沉降48 h后,利用虹吸法吸去上清液,将沉淀物浓缩定容至25 mL,其鉴定参照《中国淡水藻类——系统、分类及生态》[14]. 浮游动物利用25#浮游生物网过滤20 L水样,装入50 mL塑料瓶中,立即加入甲醛固定后带回实验室(终浓度5%)鉴定[15-16]. 其中,枝角类鉴定到种、部分种类鉴定到属;桡足类仅根据形态分为剑水蚤、哲水蚤和无节幼体3类. 桡足类无节幼体在生物学上并非分类群,但由于其数量较多,且分布、食性等与成体有较大差异,本文参照惯例将其作为一个分类群进行分析[17].
1.2 浮游生物二分网的构建及其分析
本研究以二分网的分布矩阵来研究浮游植物和浮游动物之间的关系[18]. 在前人的研究中,矩阵中的数值用1和0来表示浮游植物和浮游动物是否共同出现. 本研究定义二分网分布矩阵中的数值为浮游植物和浮游动物共同出现的频次. 另外,为了避免二分网过于复杂,本研究仅考虑出现频次大于采样点位一半的种对关系,即≥7. 同时,考虑到枝角类和桡足类对轮虫易形成捕食关系,因此,为了降低二分网络中浮游动物节点之间的联系,增加二分网络的鲁棒性,本研究仅考虑东太湖中浮游动物群落的主要组成,即枝角类和桡足类.
1.3 数据分析
本研究分析和数据可视化均在R(version 3.2.2, http://www.r-project.org)的vegan[19]、bipartite[18]和ggplot2[20]中完成. 为了综合评价湖泊水质,采用综合污染指数(CPI)指示东太湖营养盐水平[21]. 利用t.test函数比较水体理化性质、浮游生物群落多样性以及物种相对丰度的季节差异性;利用diversity函数计算浮游生物群落的多样性,包括丰富度、Shannon和Simpson指数;利用PCA函数对水质进行主成分分析;利用bipartite函数构建浮游植物和浮游动物的二分图;利用networklevel函数进行二分图网络拓扑关系的分析,包括非加权连接度、加权连接度、互作均匀度、生态位重叠度以及物种的脆弱度(与每个高营养级物种发生关系的低营养级物种平均数量)和一般性(与每个低营养级的物种发生关系的高营养级物种平均数量);并利用plotweb对二分图进行可视化;利用nestedtemp函数计算浮游生物群落的嵌套性(以矩阵温度为指示);利用nullmodel函数创建行限定的零和模型来进行嵌套性结构的显著性检验.
2 结果
2.1 水质时空特征

图2 东太湖理化指标时空特征(A:基于东太湖水质的排序图; B:东太湖的综合污染指数时空分布;C:不同水质参数的季节变化特征)Fig.2 Spatial-temporal physicochemical properties of the East Lake Taihu (A for the ordination plot for aquatic qualities; B for the spatial-temporal distribution plot for comprehensive pollutant index; C for the seasonal changes for different aquatic parameters)
2.2 浮游生物群落组成及多样性特征
东太湖浮游植物群落共检出88属,隶属于7门10纲,主要包括蓝藻门(56.62%)、绿藻门(29.17%)和硅藻门(11.20%). 浮游植物相对丰度的季节变化趋势不同(图3A):蓝藻门在夏季显著高于其它季节,而绿藻门在夏季显著低于其它季节;硅藻门在春、夏、秋季期间波动较小,而在冬季显著增加. 在属水平上(图3B),浮游植物丰度组成的季节变化明显:盘星藻属(Pediastrum)、颤藻属(Oscillatoria)和丝藻属(Ulothrix)均在春、秋、冬季显著高于夏季,且丝藻属在夏季未检出. 微囊藻属(Microcystis)和束丝藻属(Aphanizomenon)在冬季均未检出. 在多样性方面,丰富度、Shannon和Simpson指数均在春、夏、秋季之间无显著区别(P>0.05),到冬季显著下降(P<0.05).
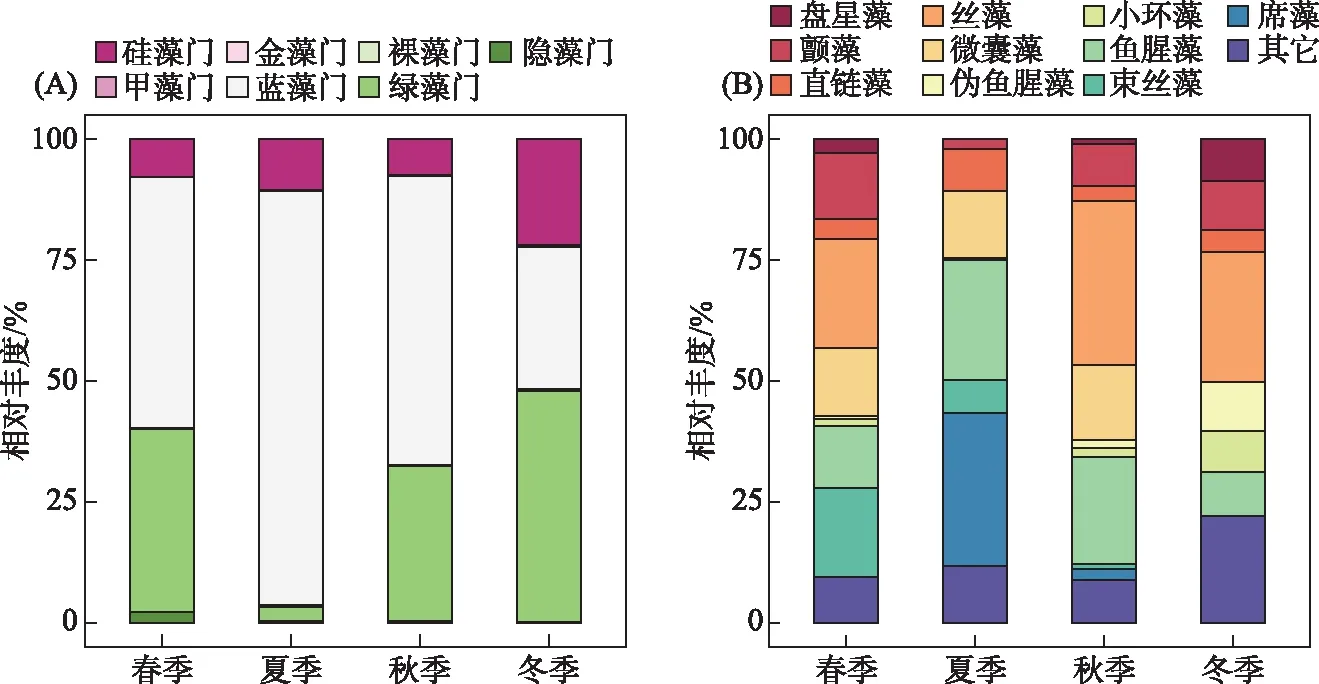
图3 东太湖浮游植物群落丰度组成的季节特征(A:门水平;B:属水平)Fig.3 Seasonal changes of the phytoplankton communities based on their densities (A for the class level; B for the genus level)
东太湖浮游动物共检出25种,其中桡足类5种,枝角类20种,其相对丰度季节变化显著(图4A). 在桡足类中(图4B),剑水蚤(Cyclops)的相对丰度在夏季(27.31%)显著高于春、秋、冬季(8.08%~14.84%);哲水蚤(Calanus)的相对丰度在夏季(3.65%)显著低于其它季节(23.11%~39.33%);无节幼体的相对丰度则在冬季(13.60%)显著高于其它季节(1.12%~4.01%). 在枝角类中(图4B),僧帽溞(Daphniacucullata)和长额象鼻溞(Bosminalongirostris)的相对丰度在春、冬季显著高于夏、秋季节. 网纹溞(Ceriodaphnia)、秀体溞(Diaphanosoma)和微型裸腹溞(Moinamicrura)在春、夏季的相对丰度较高,但在冬季均未检出. 在浮游动物群落的多样性方面,冬季Richness显著低于其它季节(P<0.01),而Shannon和Simpson指数的季节差异不显著(P>0.05).

图4 东太湖浮游动物群落丰度组成的季节特征 (A:桡足类和枝角类的相对丰度;B:不同类群的相对丰度)Fig.4 Seasonal changes of the zooplankton communities based on their densities (A for the copepoda and cladocerans; B for the genus level)
2.3 浮游生物的嵌套性格局及其相互关系
浮游植物群落在年度范围内的分布矩阵温度为11.92,零和模型的结果表明随机分布矩阵的温度为(38.45±5.23). T检验表明实际分布矩阵与随机分布矩阵之间具有显著性差异(P<0.01),说明东太湖的浮游植物群落具有明显的嵌套性结构,具有明显的时间格局,即秋、冬季群落是春、夏季群落的子集(图5A). 从分布矩阵中可以发现广泛种(出现频率排名前10%)分别为:直链藻属、针杆藻属、小环藻属、新月藻属、丝藻属、鱼腥藻属、裸藻属和布纹藻属. 浮游动物群落的分布矩阵温度为18.94(图5B),零和模型的随机分布矩阵温度为(20.54±4.34). T检验的结果显示二者之间差异不显著(P>0.05),这表明浮游动物群落无嵌套性结构.

图5 东太湖浮游生物的分布矩阵(A:浮游植物;B:浮游动物)Fig.5 Distribution matrix of plankton assemblies for the East Lake Taihu, with horizontal axis representing the sampling sites and vertical axis representing the composition (A for the phytoplankton community; B for the zooplankton community)
浮游植物和浮游动物的二分网络结构具有明显的季节差异(图6). 在春、夏、秋、冬季,二分网中浮游植物的物种数分别为16、21、13和3,浮游动物的物种数则分别为8、6、5和4,说明浮游生物二分网的物种数量在冬季最少、组成最简单. 浮游生物二分网的拓扑结构在春、夏、秋季与冬季有明显的区别. 如:无加权连接度、加权连接度和互作均匀度在春、夏、秋季分别为0.77、0.43和0.94,在冬季为1.00、0.50和0.99. 除此之外,浮游生物群落的生态位重叠度也表现出春、夏、秋季(0.84)小于冬季(1.00)的特点. 最后,物种的脆弱性和一般性则在春、夏、秋季(5.16和14.48)明显高于冬季(4.00和2.96).

图6 浮游植物和浮游动物群落之间互作网络的季节变化Fig.6 Seasonal changes of bipartite network between phytoplankton community and zooplankton community
3 讨论
3.1 浮游生物的嵌套性结构
嵌套性结构是生物群落重要的分布格局,无论是大型生物还是微生物集群中均有发现[22-23]. 对于浮游植物而言,其嵌套性分布格局近年来也有报道[24]. 与上述研究不同的是,本研究结果显示浮游植物在时间尺度上具有显著的嵌套性分布. 然而,浮游动物并未表现出明显的嵌套性. 通常来说,大部分浮游植物并不能主动进行迁移. 即使有部分能够主动迁移(如甲藻、隐藻和蓝藻等),也多在垂直方向进行运动[25]. 对于浮游动物而言,群落的多样性可能是影响其嵌套性分布的重要因素:较少的多样性可能会降低对嵌套性的估计. 本研究仅关注了浮游甲壳动物的桡足类和枝角类,并未考虑到原生动物和轮虫. 这使得在进行嵌套性分析时浮游动物群落的物种数量有所缺失. 因此,在未来的研究中,需全面考虑浮游动物的组成.
虽然有研究认为,嵌套性格局有可能是人为“被动抽样”造成的,即采样过程会低估稀有种的出现频率,而高估常见种的出现率[26]. 因此,这也是广泛种通常是优势种的原因. 然而,本研究的浮游植物群落最主要的广泛种共有8种,但仅有4种相对丰度较高,分别为直链藻属、小环藻属、丝藻属和鱼腥藻属. 因此,这否定了浮游植物群落的嵌套性结构是人为过程造成的. 事实上,环境变化引发的浮游植物休眠可能是形成其嵌套性结构的重要机制:在环境胁迫压力增加时,浮游藻类通过减小自身的体积而变得致密,继而沉降于水底或者在沉积物中形成孢囊度过休眠阶段[27]. 一方面,温度被认为是影响太湖浮游植物群落演替的关键因子[28]. 在本研究中,东太湖秋、冬季水温为11.17℃,春、夏季为26.21℃(图2),而大部分浮游藻类生长的适宜水温为14~28℃[27]. 因此,浮游植物群落中部分物种为了抵抗低温而在秋、冬季休眠,并在春、夏季复苏. 另一方面,水华暴发后的营养胁迫也易引发休眠孢囊的形成[27]. 研究表明浮游植物优先吸收氨氮为氮源[29-30],在本研究中,氨氮浓度在秋、冬季低于春、夏季,因而它有可能成为限制浮游植物生长的关键因子. 综上所述,相较于春、夏季,秋、冬季的低温和低氨氮可能是浮游植物在时间尺度上呈现出嵌套性结构的原因.
3.2 浮游植物与浮游动物之间的互作网络季节特征
以往对浮游生物的研究大多集中在群落的多样性、组成及其对外界扰动的响应[31-33]. 然而,关于浮游生物之间的互作关系及其对环境变化的响应特征尚不清楚. 为此,本研究首次利用二分网络对浮游生物的互作关系展开研究,描绘了其互作网络的基本结构. 二分网络的组成结果表明浮游植物和浮游动物的互作物种数在春、夏、秋季要远高于冬季. 事实上,研究发现群落的多样性对二分网络的构成影响极大[34-35],尤其是低营养级群落的多样性[36]:其较高的多样性有助于更多物种参与到二分网络中. 在本研究中,冬季的低温使得浮游植物的多样性显著低于春、夏、秋季. 因此,这使得冬季网络的互作物种数要比春、夏、秋季少. 传统的食性分析法和稳定同位素技术也表明浮游植物和浮游动物构成的食物网具有明显的时间动态变化特征[37-39]. 与此类似,本研究也表明浮游植物和浮游动物之间的互作关系具有显著的季节性特征. 首先,无论是浮游植物还是浮游动物,其生态位重叠度在春、夏、秋季小于冬季,说明浮游生物群落在春、夏、秋季的竞争强度弱于冬季. 其原因可能是冬季的资源不足(低温和弱光照等)使得浮游植物光合效率下降,导致物种间的生态位重叠加剧. 同时,浮游植物通过上行效应作用使得浮游动物之间的竞争激烈[40-41]. 其次,连接度是网络的重要特征,通常用来指示网络的泛化水平:连接度越高说明网络越泛化[42]. 无论是非加权连接度还是加权连接度,其数值在春、夏、秋季明显小于冬季,说明浮游生物之间的关系在春、夏、秋季比冬季更具有特异性. 春、夏、秋季可利用的资源总量多于冬季,因此,浮游生物可通过生态位分离减轻物种间的竞争,而不必集中于同一资源的争夺,最终表现出春、夏、秋季浮游生物的特异性关系更强. 最后,物种的脆弱性和一般性的季节变化则说明:相较冬季而言,浮游生物在春、夏、秋季有更多的联系者,即浮游生物网络在春、夏、秋季的冗余性更大. 在这种情况下,浮游生物在受到干扰时有更多的补偿机制,从而导致其群落更加稳定.
4 结论
1) 东太湖水质特征具有明显的时空特异性:春、秋、冬季水质特征较为相似,但它们与夏季的水质差异显著;同时西南部区域的综合污染指数高于东北部.
2) 浮游植物群落呈现出了明显的嵌套性分布,即秋、冬季群落的组成是春、夏季群落的组成的子集. 然而,浮游动物则并未呈现该分布特征.
3) 浮游生物网络的组成在冬季最简单;物种竞争在冬季最激烈;物种的特异性关系、脆弱性和一般性在冬季最小.
4) 综上所述,东太湖水环境的时空异质性造成的生态位分离可能是造成浮游生物嵌套性及其互作网络季节性变化的主要机制.
致谢:感谢薛静琛、刘颢、孙敦平、瞿猛和李冬等同志在野外采样及水化学分析过程中给予的莫大帮助.
