枸杞中黄酮类化合物降糖活性研究
2022-09-05张文艳林宇琪刘宏莹
张文艳,林宇琪,刘宏莹,张 伟
(吉林农业科技学院,吉林 吉林 132101)
0 引言
枸杞是茄科枸杞属植物,为明亮的橙红色椭球浆果,属传统名贵药材。中医认为它有补肾、明目、润肺的功效,用于肝肾不足所致的头晕目眩、视力减退、消渴等证,且疗效确切显著,故有“红宝”之称[1-2]。糖尿病发病率呈逐年上升趋势,目前临床上用来治疗糖尿病的药物主要有胰岛素及化学药物,但磺脲类药物容易发生低血糖及体重增加,个别病人会出现皮肤过敏反应、白细胞减少等;二甲双胍胃肠道反应多见,长期应用可能会影响维生素B12的吸收;胰岛素增敏剂起效较慢,可导致水钠潴留,引起水肿及体重稍增,增加心衰风险及心功能3级以上禁用等,都存在着副作用[3]。基于此,对于天然保健品的研究成为一种趋势。为开发药食同源的枸杞,探索了枸杞不同组分降糖活性,针对糖尿病进行安全有效的治疗,为枸杞资源的综合利用及开发治疗糖尿病的药物和功能性食品提供了参考依据。
1 材料与仪器
1.1 药材
枸杞为2018年9月份成熟的宁夏枸杞,为茄科(Solanaceae)枸杞属(Lycium)枸杞(Lyciumbarbarum)的果实。
1.2 动物
健康昆明种小鼠55只,雌雄各半,体重20±2 g,购于长生生物制品有限公司。动物分笼饲养,每笼10只,喂以普通饲料,自由饮水,饲养环境保持在室温20℃~25℃,相对湿度40%~60%。
1.3 仪器与试剂
UV759CRT型紫外分光光度计(上海佑科仪器仪表有限公司生产),血糖仪安稳免调码型(三诺生物传感股份有限公司生产),三诺安稳血糖试条(三诺生物传感股份有限公司生产),四氧嘧啶(美国Sigma公司生产,批号C10317497),盐酸二甲双胍肠溶片(贵州天安药业股份有限公司生产,批号20190420),芦丁对照品(中国药品生物制品检定所生产,批号100081-200406),其他所用试剂皆为分析纯。
2 方法
2.1 试验前处理
将枸杞放置于鼓风干燥箱中55℃下干燥。将烘干后的枸杞粉碎,过20目筛,装入密封袋中,放入冰箱备用。
2.2 枸杞有效成分的提取
精确称量枸杞1 000 g,加入适量体积为30%、60%、90%的乙醇,在超声功率100 W、提取温度为50℃的条件下超声辅助提取30 min,提取3次,合并滤液,将总提取液浓缩至无醇味。
2.3 枸杞黄酮类化合物的分离
取一定量的D101大孔树脂对有效成分进行分离纯化,枸杞总提取液通过大孔树脂吸附,依次使用蒸馏水、60%乙醇和80%的乙醇进行洗脱。60%的乙醇洗脱液浓缩至无醇味,定容至500 mL,置于冰箱备用。
2.4 枸杞黄酮含量测定方法
2.4.1 对照品溶液制备
称取10 mg芦丁标准品,用60%乙醇溶液溶解并定容至50 mL,配成浓度为0.2 mg/mL的标准液。
2.4.2 标准曲线绘制
分别吸取1.0、2.0、3.0、4.0、5.0和6.0 mL浓度0.2 mg/mL芦丁溶液置于10 mL容量瓶中,加入0.3 mL 5% NaNO2溶液,摇匀后静置6 min;再加入0.3 mL 10% Al(NO3)3溶液,摇匀后静置6 min;加4 mL 4% NaOH溶液,加60%乙醇稀释至刻度,摇匀,静置15 min,在波长510 nm处测定吸光度。以吸光度(A)为纵坐标,芦丁浓度(C)为横坐标,进行线性回归,计算回归方程[4]。
2.4.3 黄酮含量测定
精密吸取60%乙醇洗脱液1.0 mL于50 mL容量瓶中,加入60%乙醇稀释至刻度,摇匀。精确吸取稀释洗脱液1 mL,置于25 mL容量瓶中,按照上述方法在510 nm波长处测定吸光度平行3次,代入回归方程计算样品中黄酮含量。
2.5 降血糖动物试验
2.5.1 糖尿病小鼠模型的建立
本试验采用四氧嘧啶诱发糖尿病动物模型方法,用灭菌生理盐水将四氧嘧啶配制成10 mg/mL的溶液,正常小鼠购买后,所有动物自由饮水、食。适应性喂养一周后(测空腹血糖,作为该批小鼠的基础血糖值),除空白对照小组小鼠5只外,其余禁食不禁水15 h后,腹腔注射新鲜配制的四氧嘧啶160 mg/kg,72 h后对禁食不禁水4 h的小鼠尾静脉取血,使用血糖仪检测血糖浓度,选取血糖≥16.7 mmol/L者用于实验[5]。
2.5.2 实验小鼠的分组与给药
在未进行建模的正常空白对照组小鼠中随机选取5只作为空白组,并将建模成功的小鼠随机分为11组,每组5只,模型组、阳性对照组、药物A1、A2、A3(黄酮低、中、高剂量组)。各组给药剂量如下:空白组、模型组灌胃等剂量生理盐水,阳性对照组灌胃盐酸二甲双胍200 mg/kg,药物A1、A2、A3为灌胃黄酮25.8、51.6、103.2 mg/kg,连续灌胃20 d。
2.6 测定指标
2.6.1 体重
每天定时给药,共给20 d,间隔5 d称量每只小鼠的体重并记录(0 d、5 d、10 d、15 d、20 d),观察各组小鼠体重增减情况。
2.6.2 空腹血糖
每天定时给药,共给20 d,间隔5 d尾静脉取血一次,用血糖仪检测空腹血糖(0 d、5 d、10 d、15 d、20 d)。检测之前,小鼠更换垫料,称重并禁食不禁水12 h。在第20 d测完血糖后按下式计算降糖率:
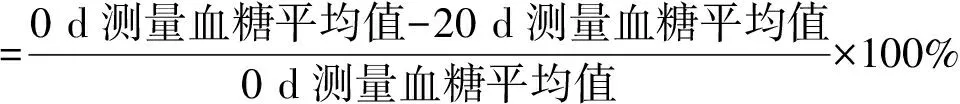
2.6.3 糖耐量
末次给药后,进行腹腔注射葡萄糖耐量实验,小鼠空腹6 h后,按小鼠体重腹腔注射新鲜配制的200 mg/mL葡萄糖溶液2 g/kg,尾静脉取血,用血糖仪测定注射葡萄糖后0、30、60和120 min时间点的血糖值。血糖值结果用 mmol/L表示,计算曲线下面积(AUC),比较各组的葡萄糖耐量水平。血糖曲线下面积S(mmol/L)=(a+2b+3c+4d)/4,其中a、b、c、d分别为灌胃葡萄糖溶液0、30、60、120 min后的血糖值[6]。
2.7 统计学方法
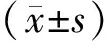
3 结果与分析
3.1 枸杞黄酮含量测定结果
按照枸杞黄酮含量测定方法得出芦丁标准曲线回归方程为y=8.858 6x+0.004 7,R2=0.999 2(y为吸光度,x为黄酮浓度)。以此测定黄酮的含量,得出枸杞黄酮的含量为1.72 mg/g。
3.2 枸杞中黄酮类化合物对糖尿病小鼠体重的影响
从表1可以看出,小鼠体重在22.19~41.14 g,空白组的小鼠在正常进食的情况下体重随着时间的变化呈现递增趋势,模型组小鼠因在高血糖的影响下进食、进水量增加,但体重随着时间变化体重呈现递减;阳性对照组在高血糖的影响下,但是在盐酸二甲双胍片的作用下体重变化不明显;A1组小鼠体重随着时间变化均呈下降趋势;A2、A3小鼠的体重在给药过程中体重先增加后减少,小鼠的体重有所下降或下降到正常值。
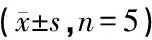
表1 枸杞不同组分对糖尿病小鼠体重的影响
3.3 枸杞中黄酮类化合物对糖尿病小鼠空腹血糖的影响
根据表2可以看出,空白组小鼠因未得糖尿病所以空腹血糖没有变化;模型组小鼠因没有对其进行治疗,其空腹血糖值持续增高;阳性对照组小鼠的血糖有着明显的降低糖尿病小鼠空腹血糖值,平均降糖率为47.17%;A1、A2、A3组小鼠均有降血糖的趋势,但随着浓度的增加小鼠降血糖效果越明显。
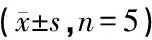
表2 枸杞不同组分对糖尿病小鼠空腹血糖的影响
3.4 枸杞中黄酮类化合物对糖尿病小鼠糖耐量的影响
由从表3可以看出,各组小鼠的血糖值均在30 min时达到最高峰,30 min后,黄酮类化合物能不同程度地降低葡萄糖负荷后糖尿病小鼠的血糖值。各组与空白组相比较而言,0 min时A1、A3组小鼠均呈极显著差异(P<0.01),30 min时药物组都呈极显著差异(P<0.01),60 min时阳性对照组、B3组与空白对照组成极显著差异,120 min时A3均成极显著差异(P<0.01);与模型组相比较,0 min时阳性对照、A2组呈显著差异(P<0.05),30 min时A2组成极显著差异(P<0.01),与阳性对照、A3组呈显著差异(P<0.05),60 min时阳性对照、A1、A2组呈极显著差异,120 min时阳性对照、A、A2呈极显著差异(P<0.01);从曲线下面积(AUC)来看阳性对照、A1均与空白组、模型组呈极显著差异(P<0.01),A3与空白组呈极显著差异,A3组与模型组呈显著差异(P<0.05)。
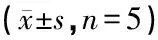
表3 枸杞不同组分对糖尿病小鼠糖耐量的影响
4 结论
四氧嘧啶是自由基激活剂,可使胰岛中超氧阴离子及过氧化氢等自由基浓度增高,致细胞损伤坏死,引起胰岛素的合成分泌障碍,进而引发糖尿病[11]。
采用四氧嘧啶造模方法,综合考察了枸杞多糖、黄酮、总生物碱的降糖效果并将其进行了对比,为枸杞资源的综合利用及开发治疗糖尿病药物和功能性食品提供了参考依据。但具体的降糖效果及枸杞降糖活性组分作用机理及有效成分有待进一步研究。
