不可切除的肝门部胆管癌的治疗进展
2022-09-05李豪李发钊张瑞之陈自然戴卫东
李豪,李发钊,张瑞之,陈自然,戴卫东
(中南大学湘雅二医院肝脏外科,湖南长沙410011)
胆管癌(cholangiocarcinoma,CCA) 是一种起源于胆管上皮细胞的恶性肿瘤,仅占消化道肿瘤的3%,占肝胆恶性肿瘤的10%~15%[1]。根据解剖学位置的不同,CCA 可分为肝内CCA(intrahepatic cholangiocarcinoma, iCCA)和肝外CCA(extrahepatic cholangiocarcinoma,eCCA),eCCA 又可分为肝门部胆管癌 (hilar cholangiocarcinoma,hCCA)及远端胆管癌(distal cholangiocarcinoma,dCCA)。hCCA 约占CCA 的60%~70%,在西方国家的发病率约为1.2/10 万,而在亚洲国家中的发病率更高,尤其是中国每年约有15 000例被诊断为hCCA[2-5]。外科手术是hCCA 唯一可能的根治方法。对于符合梅奥诊所标准的局部晚期的hCCA 在新辅助放化疗后行原位肝移植 (orthotopic liver transplantation,OLT)已被证实能获得可接受的5年生存(overall survival,OS)率,但由于肝源短缺和严格的纳入标准,25%~31%的患者在等待肝源时病情进展失去移植指征,注定了肝移植不能成为大多数hCCA 患者的治疗方式。切缘性质是hCCA患者获得术后长期生存的关键。郭敏等[6]Meta 分析显示R0切除组与R1切除组的5年OS 率具有显著差异(38.68%vs.12.84%,P=0.000 1);相较于R1切除,R0切除术后复发率也明显较低,Komaya 等[7]进行的队列研究分析了340例R0切除和62例R1切除的hCCA 患者的术后复发情况,在随访期间,R0组的复发率明显低于R1组(58.2%vs.80.6%,P=0.001),且R1组术后复发时间更早。鉴于hCCA 局部晚期的性质,R0切除率有限,仅为18%~42%[8]。国际上对hCCA 不可切除的评估多采用Burke 标准[9-10]:⑴一侧肝叶萎缩伴对侧胆管、肝动脉或门静脉广泛受累;⑵双侧2 级胆管汇合部同时受累(肿瘤累及U 点和P 点);⑶门静脉主干受累>3 cm;⑷双侧肝动脉及门静脉均受累;⑸肿瘤转移;⑹全身情况差和(或)肝功能储备不足,难以耐受手术。参考《肝癌转化治疗中国专家共识(2021 版)》[11]中肝癌不可切除的定义,可将该标准中前5 类视为肿瘤学不可切除的范畴,认为肿瘤局部晚期(图1)、远处转移、主动脉旁及腹外淋巴结转移的患者不能通过手术获益。第6 类属于外科学不可切除的范畴,即患者因一般情况较差、剩余肝体积不足等原因无法耐受手术。对于肿瘤局部侵犯脉管系统,有研究[6, 12]认为,即使门静脉、肝动脉广泛受累,术中联合血管切除重建能够实现R0切除,患者可从中获益,但该技术要求较高,应经充分评估后在有条件的情况下进行此类手术。传统的放疗、化疗虽在一定程度上延长了hCCA 的生存时间,但效果不显著。在新辅助治疗方面,虽然有多个研究表明放化疗能够将不可切除的hCCA 成功降期,并实现R0切除,但大多试验数据陈旧,缺乏大型前瞻性研究的证实。随着光动力疗法(Photodynamic therapy,PDT)、立体定向放疗、125I 粒子条、靶向治疗、免疫治疗等在内的新型治疗方式在胆道恶性肿瘤的治疗中取得了一定进展,为不可切除的hCCA 的治疗提供了更多的可能性。
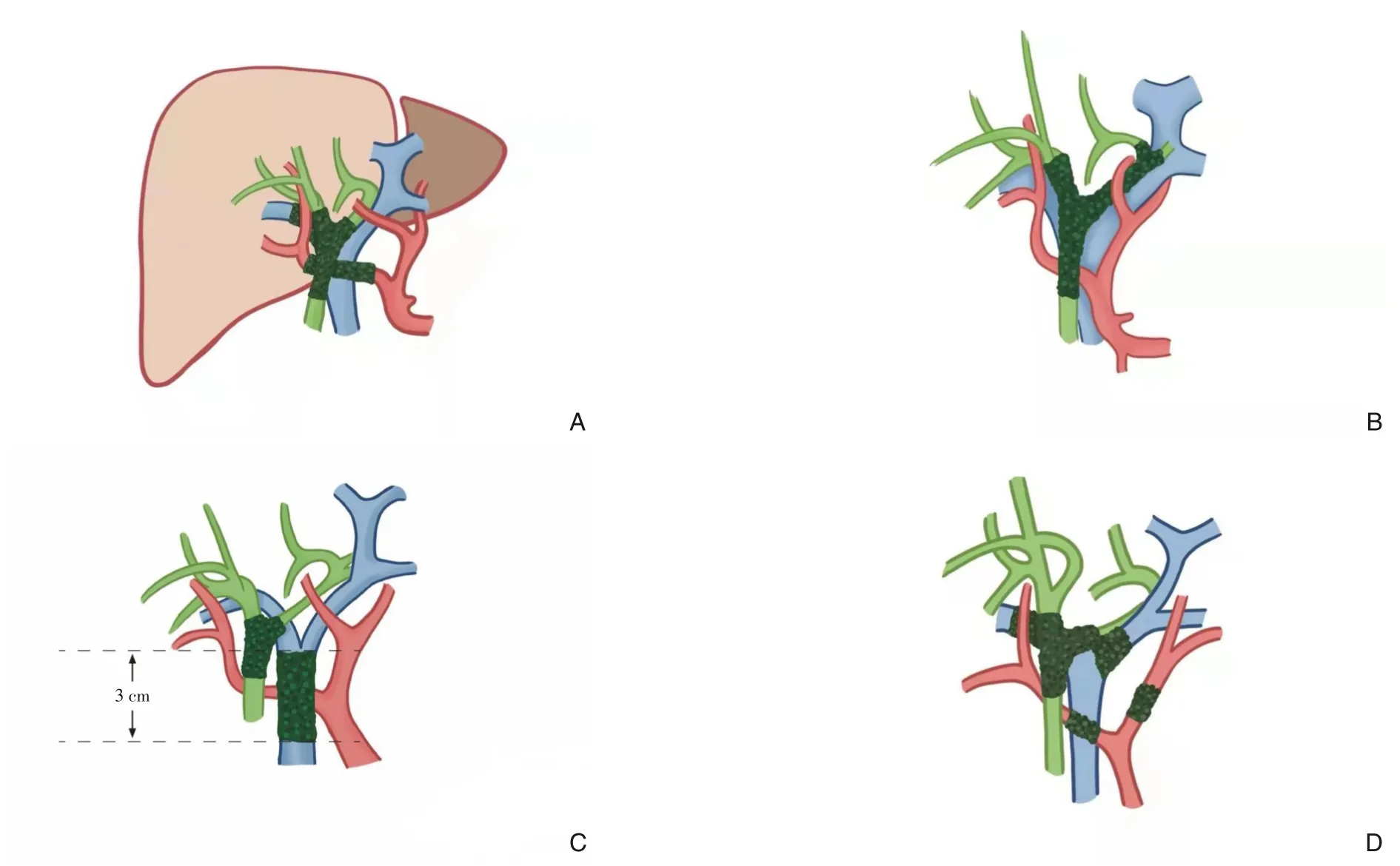
图1 局部晚期hCCA A:一侧肝叶萎缩伴对侧胆管、肝动脉或门静脉广泛受累;B:双侧2 级胆管汇合部同时受累;C:门静脉主干受累>3 cm;D:双侧肝动脉及门静脉均受累Figure 1 Locally advanced hCCA A: Atrophy of one hepatic lobe with extensive involvement of the contralateral bile duct,hepatic artery or portal vein; B: Involvement of bilateral grade 2 bile duct confluence; C: Portal vein trunk involvement >3 cm;D:Involvement of bilateral hepatic arteries and portal veins
1 外科学不可切除的治疗
外科学不可切除主要是指患者因全身情况较差、肝功能严重不全、剩余肝体积不足等情况无法耐受手术。对于外科学不可切除,肿瘤学可切除的患者,经过外科学转化治疗达到手术条件后,再行R0切除,可大大提高该部分患者的生存时间。近年来,hCCA 的发病趋势日益年轻化,除了因其他重要脏器严重疾病无法耐受手术外,肝功能不全、剩余肝体积不足是外科学不可切除的主要原因。
1.1 剩余肝体积(future liver remnant,FLR)
剩余肝体积/标准肝体积(future liver remnant/standard liver volume,FLR/SLV) <30% 被认为是术后发生肝功能衰竭的高危因素[13]。对于慢性肝病、肝硬化、吲哚菁绿15 min 滞留率>10%的患者,则要求FLR/SLV>40%,否则应暂缓手术。门静脉栓塞术(portal vein embolization,PVE)广泛用于术前FLR 不足的肝胆疾病患者。PVE 术后FLR 增长速度较慢,耗时较长,通常需要4~6 周才能达到安全手术的阈值,一篇Meta 分析[14]报道了PVE 术后FLR平均可增加8%~27%。因此PVE 期间肿瘤存在进展的可能,对于这部分患者可联合经皮肝动脉化疗栓塞、肝静脉栓塞、肝动脉结扎等措施控制肿瘤进展并进一步促进FLR 增加,但围手术期出现肝功能衰竭等并发症的概率也随之增加。联合肝分割和门静脉结扎(associating liver partition and portal vein ligation for staged hepatectomy,ALPPS) 可通 过分期肝切除诱导FLR 快速增大,ALPPS 可在1~2 周左右诱导47%~192%的剩余肝脏增生率,远高于PVE,因两期手术间隔短,能最大程度减少肿瘤进展风险[11]。早期报道[15-16]中ALPPS 术后胆汁漏、腹腔感染、肝功能衰竭、脓毒血症等并发症发生率及病死率达68%和12%,虽然随着术式的不断改进,并发症率及病死率均较前改善,但在hCCA 的应用中仍保持较高的比例(尤其是胆道重建者)。国际ALPPS 协作组在2017年对数据库中29例行ALPPS 和257例直接手术的hCCA 患者进行比较,ALPPS 组90 d 病死率是非ALPPS 组的2 倍(48%vs.24%),且中位OS 不 足非ALPPS 组的1/4 (6个月vs.29个月,P=0.048)[17-19]。因 此PVE目前仍是hCCA 增加FLR 的首选方法,ALPPS 在hCCA 的应用价值有限,仅为PVE 失败的补充方案。
1.2 胆道引流
hCCA 位置特殊,往往合并有梗阻性黄疸。术前胆道引流不仅可减轻胆道梗阻,缓解症状,提高术后肝脏再生能力,改善肝功能,降低术后肝衰风险,还能增加患者对药物治疗的耐受性,有利于术前化疗等全身药物治疗的顺利进行。目前,有关胆道引流的指征尚未达成共识,比较公认的是:⑴血清总胆红素(total bilirubin,TBIL)>200 μ mol/L;⑵黄疸持续时间较长;⑶术后FLR<40%;⑷合并胆道感染、凝血功能障碍、低蛋白血症和高龄[20-21]。化疗及其他全身治疗药物会进一步加重肝功能不全,往往要求总胆红素水平<正常总胆红素水平的1.5 倍,因此TBIL>200 μmol/L不能作为新辅助治疗前胆道引流的指征,笔者认为潜在可接受新辅助治疗的患者应尽早行胆道引流,短期内将总胆红素水平降至34.2 μmol/L 以下。胆道引流的方式主要有经皮经肝穿刺胆管引流(percutaneous transhepatic billiary drainage, PTBD)、内镜下鼻胆管引流(endoscopic nasobiliary drainage,ENBD)、胆道支架引流。2015年中国抗癌协会hCCA 规范化诊治专家共识及美国肝胆胰学会hCCA专家共识均认为,PTBD 可降低操作风险与再介入风险,且PTBD 的成功率更高、减黄效果更好,推荐PTBD 作为hCCA 术前胆道引流的首选方式[22]。来自日本的两项研究[23-24]比较了术前PTBD 和ENBD引流方式对hCCA 预后的影响,结果提示PTBD 是低生存期和肿瘤播散转移的独立危险因子,建议将ENBD 作为术前胆道引流的最佳方法。胆道支架引流包括内镜下逆行胆管支架引流(endoscopic retrograde biliary stent drainage,ERBD)及PTBD 引导下胆道支架引流。胆道支架有塑料支架和自膨胀金属支架(self-expandable metallic stent,SEMS),SEMS 的通畅时间优于塑料支架,如支架放入超过3个月,推荐使用SEMS[25-26]。2017年欧洲胃肠内镜学会临床指南[27]以中等质量的证据强烈推荐在内镜下放置直径10 mm 的SEMS 用于肝外恶性胆道梗阻的术前胆道引流。但有学者[28-29]认为术前使用胆道支架引流受纤维化反应限制,尤其是SEMS,术中评估肿瘤的范围可能更困难,增加R0切除难度。hCCA 胆道梗阻位置较高,ENBD 及ERBD 放置困难,且受限于术后易发生胆管炎及胰腺炎等并发症,故PTBD 及其介导的胆道支架引流可能是更好的选择,对于切除手术前行胆道支架置入是否增加手术难度仍需进一步探索[30]。
2 肿瘤学不可切除的治疗
对于肿瘤学不可切除的hCCA,除了上文提及的胆道引流,全身及局部的抗肿瘤治疗是该类患者的治疗关键。除了传统的放化疗外,以立体定向放疗、三维适行放疗、125I 粒子条为代表的新型放疗、PDT、靶向、免疫等治疗方式的出现,为不可切除的hCCA 的治疗提供了新的方向。对于部分符合梅奥诊所标准的局部晚期不可切除的hCCA 患者,经过新辅助放化疗后原位肝移植已被证实是可行的方案,能够获得相当不错的5年OS 率,但由于肝源短缺、严格的纳入标准及经济条件的限制,仅少数患者能够接受OLT。新辅助治疗后行根治性切除手术是不可切除hCCA 的潜在治愈方式,但从目前的研究来看,降期成功率低,且相关数据陈旧,缺乏大型前瞻性研究的支持。
2.1 放疗
传统放疗在晚期hCCA 的治疗中价值有限,随着精准医学的发展,包括立体定向放疗、三维适行放疗、放射粒子植入等在内的精准放疗技术在hCCA 中的应用越来越受重视。有研究[31-32]表明,大分割放疗方式如立体定向放疗能给病变局限的hCCA 带来明显的局部控制和生存获益。放疗在hCCA 的治疗中极少单独出现,往往需要联合以氟尿嘧啶或吉西他滨为基础的化疗。孟三彦等[33]对30例局部晚期不可切除的hCCA 患者行立体定向放疗联合吉西他滨化疗,半年后复查仅1例患者疾病进展,余患者中有16例达到完全缓解,中位无病生存期(disease-free survival,DFS) 为18个月,中位OS 为24个月,该研究所展现出来的高缓解率,令人对精准放疗的发展前景无比期待。近年来,125I 粒子条是胆道恶性肿瘤的研究热点,其辐射能低,辐射半径小,对正常组织损伤小,联合胆道支架置入在hCCA 的治疗中具有光明前景[34]。125I 粒子可持续杀伤肿瘤组织,抑制内皮细胞增生,能够显著延长支架通畅时间[35]。符誉等[36]将68例不可切除性hCCA 患者分为观察组(38例)和对照组(30例),其中观察组行经皮胆道支架置入联合125I 粒子腔内照射治疗,对照组单纯给予经皮胆道支架置入,研究显示观察组术后6个月支架通畅率明显高于对照组(94.80%vs.76.67%,P=0.03),且观察组中位OS 也明显优于对照组(20个月vs.13个月,P<0.05)。尽管一项Meta 分析[37]指出胆道支架联合125I 粒子条置入后总并发症率与对照组之间的差异无统计学意义,但术后胆道出血、胆道穿孔、胆管炎、胰腺炎、粒子脱落游走等并发症仍不可忽视。以上研究表明精准放疗技术在不可切除性hCCA 的治疗中效果显著,对比于传统外照射放疗,精准放疗治疗部位高度集中,对肝门部其他组织损伤小,耐受良好。虽然目前对于精准放疗在hCCA 新辅助治疗中应用的报道较少,但其在新辅助治疗方面的前景仍令人期待。
2.2 化疗
化疗是不可切除的hCCA 的经典治疗方式。Valle 等[38]进行的III 期随机对照试验结果显示,吉西他滨联合顺铂的治疗方案可延长包括hCCA 在内的胆道系统肿瘤(biliary tract carcinoma,BTC) 的OS(11.7个月vs.8.1个月,P<0.001)。同为铂类化疗药物的奥沙利铂,因其药物毒性明显更低,可作为不能耐受顺铂患者的替代治疗。Mizusawa 等[39]的一项III 期临床试验表明吉西他滨联合替吉奥(S-1)的化疗效果不差于吉西他滨/顺铂方案。因此《CSCO 胆道系统肿瘤诊断治疗专家共识(2019年版)》[40]推荐吉西他滨/顺铂、吉西他滨/替吉奥(证据等级1A)作为晚期BTC 的一线治疗,肾功能不全者可选择奥沙利铂作为顺铂的替代药物联合吉西他滨化疗(证据等级2A);同时该指南也指出吉西他滨/卡培他滨、顺铂/卡培他滨、奥沙利铂/卡培他滨等两药联合化疗也可作为晚期BTC的一线选择(证据等级2B)。奥沙利铂联合5-FU(mFOLFOX)方案及伊立替康联合卡培他滨方案虽耐受良好,但在目前的研究中取得的效果有限,仅短暂延长患者的无进展生存期(progression free survival,PFS)和OS,因此仅作为晚期BTC 的二线治疗方案[41-42]。三药联合化疗可明显延长晚期BTC的PFS 和OS,如Shroff 等[43]的一项二期临床试验表明吉西他滨/顺铂/白蛋白紫杉醇方案的PFS 和OS 明显优于吉西他滨/顺铂方案(11.8个月vs.8.0个月,19.2个月vs.11.7个月)。但三药联合化疗药物毒性更高,安全性及有效性仍需进一步证实,指南[40]推荐三药联合化疗应在经过严格筛选后在有经验的中心进行。
新辅助化疗在hCCA 治疗中的作用尚缺乏高质量临床研究结果支持,在翻阅了相关文献发现,绝大多数报告了新辅助化疗能够提高hCCA 的R0切除率的研究中,多是通过化疗联合局部外照射放疗(external beam radiation therapy,EBRT)实现的。新辅助放化疗在hCCA 最初的应用中多采用5-FU,并在多个回顾性研究中证实5-FU+EBRT 的新辅助治疗方案可提高R0切除率。McMasters 等[44]的一项回顾性研究中,5例hCCA 患者接受了5-FU+EBRT方案的新辅助治疗,术后证实5例患者均达到了R0切除,R0切除率达100%,并有2例达到完全缓解,但该研究样本量过于局限。Nelson 等[45]的研究中,对45例接受放化疗的eCCA 患者进行了回顾性分析,12例患者(其中10例为不可切除) 行术前5-FU+EBRT 方案治疗,R0切除率达91%,并有3例患者获得了完全缓解,另未经新辅助治疗的33例患者的R0切除率为76%,低于新辅助组。吉西他滨联合EBRT 用作hCCA 的新辅助治疗同样取得了一定成效,在一定程度上提高了R0切除率。Katayose 等[46]正在进行的一项II 期临床试验中,24例eCCA 患者接受了吉西他滨联合外照射的新辅助方案,其中19例完成切除手术,17例实现R0切除,R0切除率为89.6%,且患者耐受良好。Jung 等[47]的一项回顾性研究中,将57例hCCA 患者分为新辅助治疗组(12例)和非新辅助治疗组(45例),且两组患者拥有相似的Bismuth 分型及TNM 分期,新辅助治疗组中5例行5-FU+亚叶酸钙+EBRT、5例行吉西他滨+EBRT、1例行吉西他滨+顺铂+EBRT、1例行尿嘧啶替加氟+EBRT,研究结果显示新辅助治疗组R0切除率并未对非新辅助治疗组展现出优势(83.3%vs.66.7%,P=0.32)。Sumiyoshi 等[48]在一项回顾性研究中纳入了8例不可切除的局部晚期hCCA 患者,予口服S-1 化疗联合放疗的新辅助方案。其中6例患者在新辅助治疗后成功降期,术后病理证实5例患者达到R0切除,1例患者为R1切除,R0切除率为83.3%,而成功转化并实现R0切除的概率达62.5%,其中3例复发(复发率50%)。以上多个研究虽表明新辅助放化疗可提高不可切除的hCCA 的R0切除率,都局限于样本量较小,没有大型的前瞻性随机对照试验的证实,缺乏可信度,关于新辅助放化疗的方案仍需要进一步探索并加以证实。
2.3 射频消融(radiofrequency ablation,RFA)
RFA 目前广泛应用于多种实体瘤的局部治疗中,对于直径较小的早期恶性肿瘤,RFA 的DFS 和OS 与手术切除无明显差异[49]。RFA 除在早期直径较小的恶性肿瘤中能够达到根治的目的外,在无法切除的肿瘤及肿瘤术后复发的局部治疗中同样可发挥重要作用。hCCA 的RFA 主要分为经皮胆道RFA 和内镜下胆道RFA,通过高频放电产热使肿瘤组织坏死脱落,但坏死组织脱落后可能加重胆道梗阻,因此RFA 需联合胆道支架以达到治疗目的。有多项研究表明,RFA 联合胆道支架可显著提高胆道通畅率,延长患者生存时间。Wang 等[50]对9例III 型和IV 型不可切除的hCCA 患者行经皮胆道内RFA,中位胆道支架通畅时间为100 d,中位OS 为5.3个月,认为RFA 在不可切除性hCCA 患者的治疗中是安全可行的,但Wang 等[50]研究缺乏对照组,且病例数有限。除了Wang 等[50]外,Mizandar等[51-52]也表明RFA 可以延长胆道梗阻的复发时间。Pereira 等[53]报告了3例不可切除的hCCA 患者行化疗联合RFA 治疗,认为RFA 在不可切除性hCCA 的治疗中是安全且有前景的。而Strand 等[54]回顾分析了48例无法切除的CCA 患者,16例行RFA,32例行PDT,然后行胆道支架置入,结果显示两组的中位生存期无明显统计学差异,但RFA 组再次梗阻及胆管炎发生率明显更高。RFA 作为hCCA 的一种治疗方式,其有效性已被多篇文献报道,鉴于肝门部解剖结构的复杂性,肝门部血管损伤、胆瘘等并发症不可忽视,需要在有经验的大型医院进行。虽然RFA 在不可切除性hCCA 的治疗中表现出了很大的潜力,但在RFA 治疗期间疾病可能进展,操作过程中有种植转移的风险,因此RFA 在不可切除的hCCA 新辅助治疗中的可行性仍需多中心前瞻性研究进一步证实。
2.4 PDT
PDT 是晚期CCA 的一种新型治疗方法,其原理是经静脉注射或介入等方式将光敏剂送达肿瘤组织并聚集,用特定波长的光照射时,在光化学反应的诱导下产生氧自由基引起细胞坏死,破坏肿瘤血管内皮细胞,并激活免疫应答,以达到抑制肿瘤生长的目的,而周围正常组织因聚集的光敏剂较少,因此正常组织几乎不受损伤,可重复性高[55-56]。PDT 作为CCA 的局部治疗方法,很少单独使用,常需联合其他治疗方式,并可在一定程度上提高其他治疗的疗效。目前已有多篇文献[57-59]报道了在不可切除的hCCA 的治疗中,PDT 联合胆道支架能够显著延长支架的通畅时间,改善患者的生存预后。CCA 容易对化疗产生耐受,PDT 能够改变肿瘤微环境进而提高化疗的敏感性。Hong等[60]的研究中纳入了74例不可切除的CCA 患者,其中16例行PDT 联合吉西他滨化疗,58例行单纯PDT 治疗,PDT 联合化疗组的OS 为17.9个月,高于单纯PDT 组的11.1个月,经多因素分析后认为化疗及PDT 均为CCA 预后的独立影响因素;Park 等[61]进行的II 期临床试验,将43例晚期hCCA 患者分为PDT 联合S-1 化疗组(21例)与单纯PDT 组(22例),前者的1年OS 率明显优于后者(76.2%vs.32%,P=0.003), 中 位OS 更长(17个月vs.8个月,P=0.005),且PDT 联合S-1 化疗耐受性良好,整体不良事件发生率与单纯PDT相比无明显差异;Wentrup 等[62]的回顾性研究也得到了相似的结论。除化疗外,PDT 联合靶向、免疫治疗同样备受关注。PDT 联合靶向治疗具有一定的协同作用,Kim 等[63]在体外细胞迁移实验中发现靶向药物联合PDT 治疗较单一治疗细胞迁移时间明显延长,且体内实验发现PDT 联合表皮生长因子受体抑制剂西妥昔单抗比单一治疗能更好地抑制肿瘤生长。PDT 联合免疫检查点抑制剂可能也存在协同作用。有研究[64]显示PDT 可能会通过对肿瘤微环境的改变,上调PD-L1 在肿瘤中的表达,为PD-L1 抗体提供靶点,同时PDT 还可能提高肿瘤对免疫检查点抑制剂敏感性,从而进一步提高治疗效果。在一项关于结肠癌的双肿瘤模型的研究[65]中发现PDT 联合CTLA4 免疫检查点抑制剂可降低肿瘤负荷。虽然以上研究表明PDT 联合靶向或免疫治疗可能存在协同作用,为CCA 的治疗提供可能性,但几乎没有相关临床数据支持。在新辅助PDT 治疗方面,研究数据匮乏,Wagner 等[66]在一项II 期临床试验中,报告了7例在术前评估为不可切除的hCCA 患者在经6 周的PDT 治疗后成功降期,除1例患者因肝纤维化行OLT 外,余6例患者均实现了R0切除,中位OS 为3.2年,5年OS 率为43%,其中位OS 及5年OS 率与直接行R0切除的患者未表现出明显差异。尽管有证据[67-68]表明新辅助PDT 可以安全地进行,并且可以在选定的患者队列中实现R0切除,但仍缺少相关的临床数据支持,其作用仍需在设计合理的临床试验中进行探索[69]。
2.5 靶向治疗
CCA 具有很高的异质性,不同的解剖亚型拥有不同的基因组变化。随着下一代基因测序的不断发展,更多的治疗靶点被不断发现,靶向治疗已逐渐成为治疗hCCA 的研究热点。培米替尼是成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR) 抑制剂,可选择性强效抑制FGFR1~3, 在关键性的多中心II 期临床试验(NCT02924376)[70]中招募了146例晚期CCA 患者进行培米替尼治疗,107例FGFR2 融合或重排的患者中有38例达到客观缓解,客观缓解率(objective remission rate, ORR) 达 到35.5%,疾病控制率(disease control rate,DCR) 高达82.2%,中位PFS为6.9个月,OS 达21.1个月。培米替尼已于2020年4月在美国上市被批准用于治疗含有FGFR2 融合或重排的成人晚期CCA,成为目前全球首款也是唯一获FDA 批准的CCA 靶向药物。FGFR 的融合/突变多发生在iCCA,而在eCCA 患者中几乎不出现,这也就限制了培米替尼在hCCA 患者中的应用价值。在肿瘤生长过程中,血管生成是重要一环,抗血管生成的靶向药物已被广泛应用于多种恶性肿瘤,仑伐替尼和阿帕替尼可分别阻断血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)1~3 和VEGFR-2 介导的信号通路从而抑制肿瘤细胞的生长,但VEGFR 基因突变主要见iCCA,是iCCA 的潜在靶向药物[71],能否在hCCA 的治疗中发挥作用仍处于探索阶段。ERBB受体酪氨酸激酶家族中的4 种细胞表面受体的突变多见于hCCA,其中表皮生长因子受体(epidermal growth factor receptor, EGFR)/ERBB1、 HER2/ERBB2 的激活突变更为重要。曲妥珠单抗、帕妥珠单抗作为HER2 靶点的抑制剂,可抑制肿瘤细胞的增殖活性,但目前在hCCA 的治疗中尚无临床数据支持。EGFR 靶点的抑制剂是治疗hCCA 的重点研究方向,在2012年的一项III 期随机对照试验中,Lee 等[72]评估了EGFR 的抑制剂埃罗替尼联合吉西他滨/顺铂治疗晚期CCA 的效果,对比于单纯使用吉西他滨/顺铂,ORR 更高(31%vs.14%,P=0.004),PFS 更长(5.9个月vs.3.0个月,P=0.049)。虽然埃罗替尼在试验中仅取得了有限的疗效,但仍为hCCA 的靶向治疗带来了新的可能与方向。neratinib 作为一种不可逆的EGFR 和HER2 双重抑制剂,可能会是hCCA 的潜在有效药物[73]。丝裂原活化的细胞外信号调节激酶(MEK)同样在eCCA 中高表达,其作为细胞信号通路中的关键物质,参与肿瘤细胞生长。MEK1/2 的抑制剂司美替尼及贝美替尼联合化疗联合化疗治疗晚期CCA 分别在两个Ib临床试验(NCT01242605、NCT02773459) 中取得了一定成效,证实了针对MEK 靶点的药物在hCCA 的治疗中拥有光明的前景[74-76]。除ERBB、VEGF、MEK 外,PKA、P53、异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH) 1/2 等都是hCCA 的潜在靶点,IDH1 靶向药依维替尼也取得了令人可喜的疗效,但目前仍无研究表明其他相关靶向药物能在hCCA 的治疗中取得显著效果。尽管靶向治疗在晚期CCA 中的作用不断被证实,但多是针对iCCA,目前尚无任何研究表明靶向治疗能够延长晚期不可切除性hCCA 患者的生存时间,相信随着靶向药物的不断革新及在临床试验的不断佐证中,靶向治疗在hCCA 治疗中的作用能够得到充分的证实。
2.6 免疫治疗
目前免疫检查点的主要研究靶点是PD1/PDL1、CTLA4,通过阻断免疫检查点重建正常抗肿瘤免疫,避免肿瘤细胞逃避免疫监视,是近年来抗肿瘤治疗最热门、最有前景的研究方向。在一项II期研究(KEYNOTE-158)[77]中,104例晚期胆道恶性肿瘤患者行帕博利珠单抗单药治疗,ORR 仅为5.8%,提示单药免疫治疗对于胆道恶性肿瘤的效果不佳。目前胆道恶性肿瘤的免疫治疗重点在于免疫联合治疗,一项I 期临床试验[78]中,纳武利尤单抗联合吉西他滨/顺铂,有效率达36.7%,中位OS 为15.4个月,其疗效优于纳武利尤单抗单药和单纯吉西他滨/顺铂化疗,纳武利尤单抗联合化疗也因此被纳入《CSCO 胆道系统肿瘤诊断治疗专家共识(2019 版)》的一线治疗选择[79]。而在另一项二期临床试验[80]中,免疫联合靶向、化疗获得了目前报道的最好疗效,这为CCA 的新辅助治疗提供了新的方向。一项正在进行的II 期DEBATE 试验(NCT04308174)[81]将招募的45例不可切除的CCA 患者随机分配到度伐利尤单抗联合吉西他滨-顺铂治疗和单独行吉西他滨-顺铂治疗的2个新辅助治疗组,研究2 组的R0切除率,该研究尚未完成。同样,一项旨在评估PD-1 抗体特瑞普利单抗联合GEMOX 化疗作为新辅助治疗方案在具有复发高危因素的可切除iCCA 中作用的II 期临床研究(NCT04506281)[81]也正在进行中。免疫检查点抑制剂旨在增强对肿瘤抗原的自身免疫力,目前无任何研究报道免疫单药能够给晚期CCA 患者带来生存获益,这可能于肿瘤组织对PD-1、PD-L1 抗体的耐药性有关。近年来关于CCA 双免疫治疗的研究正在火热进行中,但根据相关报道来看,双免疫治疗在CCA 的治疗中并未取得实质性进展。研究[82]纳入了39例复发性胆道恶性肿瘤患者,行纳武利尤单抗联合伊匹木单抗(CTLA4 单抗)治疗,结果显示总体ORR 为23%,中位PFS 为2.9个月,中位OS 为5.7个月。而另一项II 期临床研究[83]对双免疫治疗和免疫联合化疗在胆管恶性肿瘤疗效方面进行了对比,结果显示双免治疗组(纳武利尤单抗联合伊匹木单抗)的中位OS 仅为8.3个月,低于免疫联合化疗组(吉西他滨/顺铂联合纳武利尤单抗)的10.6个月,提示免疫联合化疗的疗效可能优于双免疫治疗。抗血管生成药物可改变肿瘤微环境,增强T 淋巴细胞的抗肿瘤活性,并提高肿瘤细胞对免疫检查点抑制剂的敏感性。前临床研究[84-85]表明,仑伐替尼可以通过抗血管生成增强肿瘤微环境中T 淋巴细胞的抗肿瘤活性,从而增强抗PD-1/PD-L1 抗体的抗肿瘤作用。Zhang 等[86]的II 期临床研究入组38例初诊为不可切除的胆道癌患者(iCCA 20例,eCCA 5例,GBC 13例),每天口服仑伐替尼(体质量≥60 kg,12 mg;体质量<60 kg,8 mg) 并每3 周接受1 次PD-1 抑制剂(帕博利珠单抗/替雷利珠单抗/信迪利单抗/卡瑞利珠单抗200 mg 或特瑞普利单抗240 mg),研究结果显示DCR 为76.3%,ORR 为42.1%,中位无事件生存期为8.0个月,中位OS 为17.7个月,13例患者成功转化行手术治疗,12例患者实现R0切除,手术转化率达到34.2%,R0切除成功率为31.6%。但5例eCCA 患者均未达到客观缓解(ORR=0%),且无1例降期成功。Zhang 的研究纳入的eCCA 患者病例数过少,可能存在选择偏倚,未证实仑伐替尼联合PD-1 抑制剂对不可切除的hCCA 有治疗价值,因此仍需要大样本前瞻性研究来证实其有效性。
3 小 结
hCCA 是最常见的CCA 亚型,根治性切除是目前hCCA 患者获得长期预后的主要手段。放疗联合化疗的新辅助治疗方案已被多个研究证实可提高R0切除率,但放化疗转化率有限。立体定向放疗、三维适行放疗等精准放疗技术在晚期CCA 中的作用不断被证实,为不可切除性hCCA 的转化治疗提供了一个可靠的备选方案。PDT 作为CCA 新型的治疗方式,已有多项研究证实该治疗方式安全有效,PDT 不仅能抑制肿瘤细胞生长,还能在联合胆道支架治疗时延长再次梗阻的时间。PDT 对患者生存时间的影响与RFA 相当,但PDT 操作简单,可重复强,在hCCA 中的应用可能优于RFA。随着首款CCA 靶向治疗药物培米替尼的上市,CCA 的治疗也正式进入靶向治疗的时代。但CCA 异质性强,大部分证实靶向治疗有效的研究都是针对iCCA 患者。随着免疫检查点抑制剂在治疗晚期原发性肝癌患者的有效性不断被证实,PD-1、PD-L1 抗体在CCA 中的应用备受重视,但由于肿瘤细胞对免疫制剂的耐药性,有文献报道单药免疫治疗对于胆道恶性肿瘤的效果不佳。最近的研究表明,包括仑伐替尼在内的抗血管生成药物可增强免疫检查点抑制剂的抗肿瘤作用,仑伐替尼联合PD-1 抗体能够提高iCCA 的R0切除率,但并未显示能够对hCCA 患者发挥同样效果,可能与该研究样本量小、存在选择偏倚有关,需要进一步的大型前瞻性研究予以证实。
利益冲突:所有作者均声明不存在利益冲突。
