FSH诱导Hippo信号通路激素代谢相关基因表达的研究
2022-09-05林丹换李仕芬王伟洪覃春容
夏 燕, 练 冰, 孟 夏, 林丹换, 李仕芬, 王伟洪, 覃春容
(1. 南方医科大学附属深圳市妇幼保健院生殖医学科,广东 深圳 518000; 2. 南方医科大学附属深圳市妇幼保健院妇科,广东 深圳 518000; 3. 深圳大学总医院中医科,广东 深圳 518000)
Hippo信号通路是参与哺乳动物器官发生[1-3]、细胞分化及血管生成[4-8]的重要信号转导通路。目前研究表明,Hippo信号通路也参与胚胎发育及卵泡发育,与生殖内分泌代谢异常关系密切[9-13]。Yes相关蛋白(Yes associated protein, YAP)基因作为Hippo信号通路中的重要核转录因子,可能也参与卵巢局部重要的生理及病理过程。YAP基因通常以失活状态存在于细胞浆,其上游激酶Lats1/2通过磷酸化YAP的丝氨酸位点而抑制YAP活性,磷酸化YAP在细胞浆经过泛素-蛋白水解系统被降解[14],而未被磷酸化的YAP进入细胞核内通过结合其下游的核转录因子TEAD完成后续的转录调控。由于YAP基因自身缺少DNA结合结构域,因此必须依赖下游的转录因子TEAD与目标基因结合完成转录。TEAD家族作为YAP基因下游重要的核内转录因子,该家族成员的转录活化水平直接影响YAP基因对其下游靶基因的调控及一系列功能行使[15]。除TEAD家族外,Hippo信号通路下游基因RUNX-2、ErbB4、CTGF、Smads,p73等在卵巢局部颗粒细胞及卵泡发育中的作用研究甚少。有研究发现核内YAP及下游结缔组织生长因子(conne-ctive tissue growth factor, CTGF)的表达增加,小鼠窦卵泡及次级卵泡数目明显增加[16]。小鼠体内YAP磷酸化水平与原始卵泡活化程度有关,YAP磷酸化程度降低,原始卵泡活性增加[17]。YAP作为Hippo信号通路中的核转录共激活物,可能也参与卵巢早衰及多囊卵巢综合征等生殖内分泌异常疾病的发生。YAP基因上游的负调控激酶Lats1,通过调节FOXL2基因,参与卵巢早衰的发生[18]。另有研究发现,卵巢颗粒细胞瘤中YAP表达水平的下调能够降低FSH诱导的芳香化酶基因Cyp19a1的表达[19],前列腺素E2增强YAP基因的转录活性,使前列腺素内过氧化物酶2(Ptgs2)基因表达水平升高[20]。
作为卵巢局部激素代谢的主要分子,卵泡刺激素(follicle-stimulating hormone, FSH)和黄体生成素(luteinizing hormone, LH)是调节卵泡发育和卵巢内分泌功能的重要信号分子,二者在卵巢组织中引发的一系列复杂生理变化的分子路径尚未阐明,这也是目前国际生殖生物学界的一个研究热点。本研究拟通过FSH诱导人原代卵巢颗粒细胞,明确卵巢颗粒细胞中Hippo信号通路的哪些激素代谢相关基因诱导后出现差异表达,以此初步确定卵巢局部Hippo信号通路的重要效应分子中哪些参与FSH诱导的激素代谢调控,为揭示女性卵巢功能异常以及生殖内分泌异常疾病的发病机制提供理论基础。
1 材料与方法
1.1 试剂及仪器
细胞培养液DMEM-F12购自美国Gibico公司;青链霉素试剂购自美国Sigma公司;胎牛血清购自Hyclone公司;细胞培养板及细胞培养皿购自美国Costar公司;FSH购自瑞士默克雪兰诺公司;所有引物均由TakaRa公司合成,引物序列见表3。RNA提取试剂盒购自德国QIAGEN公司;RNase Inhibitor、M-MLV反转录酶均购自Invitrogen公司;SYBR Green Ⅰ Mix购自Roche公司;anti-YAP/pYAP(1∶1 000)、anti-CTGF、anti-β-actin抗体均购自Cell Signaling公司。抗Cyp19抗体(ab35604)、RUNX2抗体(ab114133)、抗TEAD1(ab133533)抗体购自Abcam公司。抗TEAD2(LS-C119063)抗体和抗TEAD3抗体(LS-30406)购自Lifespan Biosciences公司。抗TEAD4(ab97460)抗体购自Abcam公司。PCR仪购自Eppendorf公司;Real-time PCR仪购自Bio-Rad公司。
PCR仪购自Eppendorf公司;Real-time PCR仪购自Bio-Rad公司。
1.2 颗粒细胞样本收集
本研究所用的人原代卵巢颗粒细胞来源于深圳市妇幼保健院生殖中心行ICSI助孕的不孕患者废弃卵泡液收集。纳入标准: (1) 因男方因素行ICSI助孕的不孕患者;(2) 女方年龄<36岁。排除标准: 慢性基础疾病,肝、肾功能不全;子宫畸形、宫腔粘连、卵巢手术史、夫妻任何一方内分泌代谢异常。本研究通过南方医科大学附属深圳市妇幼保健院伦理委员会批准并获得患者知情同意(FSYLS[2020]069)。
1.3 颗粒细胞体外分离培养
取卵手术日收集ICSI助孕患者的卵泡液进行无菌分离。显微镜下从卵泡液中找到卵冠丘复合物,用巴斯德管机械分离卵母细胞及卵丘颗粒细胞,将卵丘颗粒细胞用PBS洗2次,用透明质酸酶消化成单细胞,离心用PBS洗2次,转移至培养皿中培养,根据各自浓度计算加到培养皿中的细胞细胞悬液量,保证初始加入培养皿的细胞数均为1×106。12 h贴壁后计数,培养36 h后再次计数。
1.4 RT-PCR检测

1.4.2 总RNA反转录 冰上配制gDNA Eraser反应混合液。按照反转录试剂盒说明书操作步骤进行。引物序列见表1。RNA反转录混合液42 ℃水浴中放置15 min,再于85 ℃水浴中放置5 s后立即置于冰上,获得反转录产物(cDNA)。cDNA可立即用于qPCR检测,反应条件如下: 预变性95 ℃,30 s;变性95 ℃,30 s;退火及延伸63 ℃,30 s;共30个循环,产物经2%琼脂糖凝胶电泳进行鉴定。检测样本均重复至少3次。

表1 目的引物序列
1.5 Western印迹法检测
通过含有1%蛋白酶抑制剂混合液的RIPA裂解液提取卵泡颗粒细胞总蛋白,使用BCA试剂测定蛋白浓度后确定上样量。配制SDS-PAGE凝胶,通过PAGE凝胶转运蛋白至膜上。上样后进行电泳(80 V 20 min,然后切换成120 V 70 min),切去浓缩胶后放入转膜槽中进行转膜(300 mA 90 min)。转膜结束后,室温下5%脱脂奶粉在TBST中封闭2 h,洗膜液清洗1次,一抗4 ℃冰箱孵育过夜。将孵育过夜的膜用洗膜液洗涤3次(每次10 min),二抗室温孵育1 h,再用洗膜液洗涤4次(每次10 min),最后使用凝胶成像仪(Bio-RAD)采集图像。YAP/pYAP抗体(1∶1 000)、CTGF抗体(1∶500)、Cyp19抗体(1∶500)、TEAD1抗体(1∶1 000)、TEAD2抗体(1∶1 000)、TEAD3抗体(1∶500)、TEAD4抗体(1∶1 000)。所有Western印迹法相关实验均重复至少3次。
1.6 统计学处理
2 结 果
2.1 人原代卵巢颗粒细胞培养

图1 人的原代卵巢颗粒细胞培养(左: ×100,右: ×200)
2.2 FSH诱导Hippo信号通路相关基因的RNA表达情况
将25 U FSH诱导剂加入原代卵巢颗粒细胞培养液中继续培养,按照不同的时间收集细胞样品进行qPCR检测。检测结果显示,YAP基因的上游调控基因Lats1/2基因在FSH不同的诱导时间均无明显的表达差异,MST1/2基因的PCR检测结果提示随着FSH诱导时间的延长,MST基因有表达增强的趋势,但差异无统计学意义(P>0.05)。对于激素代谢重要的调控因素,FSH受体和LH受体在FSH诱导后差异均无统计学意义(P>0.05),见图2。

图2 YAP上游基因及颗粒细胞受体表达的情况
2.3 FSH诱导YAP及其下游基因TEAD家族的RNA水平表达
在不同剂量的FSH诱导下,Hippo信号通路关键的核转录因子YAP基因表达均有明显升高,以12.5 U 组最明显,差异无统计学意义(P>0.05)。YAP基因下游的TEAD家族基因在不同剂量FSH诱导下均未出现显著性变化。除此之外,本研究还检测了YAP下游重要的细胞代谢增殖调控基因CTGF基因的表达,通过检测结果可以看到,CTGF基因在FSH诱导后明显下降,与对照组相比差异有统计学意义(P<0.05);两种不同诱导剂量之下CTGF基因的表达下调程度相似,差异有统计学意义(P<0.05),见图3。
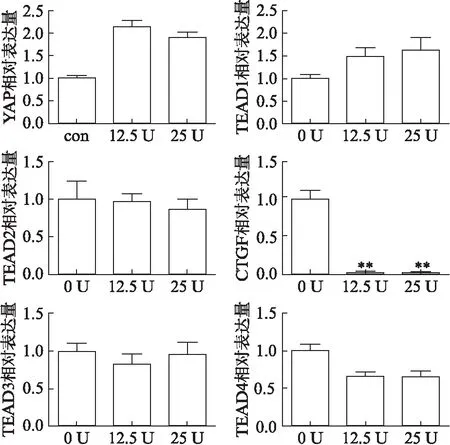
图3 Hippo信号通路基因及其下游靶基因的表达情况
2.4 FSH诱导YAP下游相关激素代谢靶基因的RNA表达情况
除了上述Hippo信号通路相关基因,本研究检测了与Hippo信号通路相关的激素代谢相关基因的表达情况。Cyp19基因在FSH诱导后的表达水平均明显升高,不管FSH剂量12.5 U还是25 U处理,Cyp19基因的表达水平较无FSH处理细胞组升高近70倍,差异均有统计学意义(P<0.05)。对于Ptgs2基因的表达情况,Ptgs2基因在FSH诱导后的表达水平也明显升高,12.5 U处理组表达水平较不用FSH处理细胞组升高近200倍,25 U处理组表达水平较FSH未处理组升高近150倍,差异均有统计学意义(P<0.05)。Errb4基因在对FSH诱导后也出现表达上调,差异有统计学意义(P<0.05),但是与其他几个相关基因表达水平相比,其上调程度较小。Hippo信号通路的另一个重要基因RUNX2基因,12.5 U处理组的表达水平较FSH未处理组升高数倍,25 U处理组表达水平较FSH未处理组也略有升高,差异具有统计学意义(P<0.05)。对于Has2基因和Itgb2基因,FSH处理前后的表达均无显著性差异,见图4。

图4 与Hippo信号通路相关的其他基因及激素代谢相关基因在不同FSH诱导剂量的表达情况
2.5 FSH诱导YAP下游相关激素代谢靶基因的蛋白表达情况
用FSH体外处理卵巢颗粒细胞,48 h后收集卵巢颗粒细胞行Western印迹法检测。如图5A所示: 在使用不同剂量的FSH处理细胞48 h后YAP基因的表达无明显差异,磷酸化YAP的表达在25 U明显低于12.5 U处理组。CTGF的蛋白表达和RNA水平的表达情况相似,分别出现了表达下降,且在25 U 的表达明显下降,见图5A。虽然YAP磷酸化水平有所下降,但是YAP下游的重要基因家族TEAD家族的4种亚型的表达无明显差异,见图5B。与激素代谢相关的基因表达情况,RUNX-2的表达差异无统计学意义,但是Cyp19的表达在25 U 水平出现明显表达降低,差异有统计学意义,见图5C。
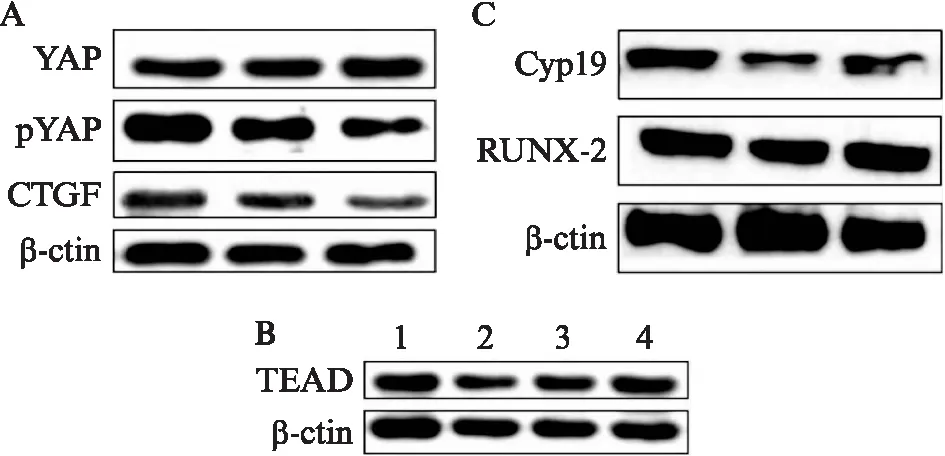
图5 Hippo信号通路关键基因及其下游靶基因的蛋白表达情况
3 讨 论
FSH作为下丘脑-垂体-性腺轴的主要激素之一,促进女性卵巢局部卵泡发育及排卵,颗粒细胞的增殖分化以及性激素的合成[21-23]。窦前卵泡期的颗粒细胞开始表达卵泡刺激素受体(follicle stimu-lating hormone receptor, FSHR)。在FSH的刺激下,排卵前成熟卵泡的颗粒细胞和黄体细胞能合成大量性激素[24]。FSH通过体内多条信号转导途径促进分化相关基因的表达,诱导颗粒细胞分化。FSH能促进血清糖皮质激素酶、抑制素α、原癌基因c-fos、黄体生成激素受体、芳香酶、3β-羟化类固醇脱氢酶(3β-HSD)等的基因表达。上述这些基因的表达标志着颗粒细胞已分化。FSH激活FSHR后的多条信号转导通路和多种信号分子相互作用,在颗粒细胞增殖分化中发挥重要作用[25]。Hippo信号通路是近年研究较多的参与哺乳动物器官发育大小的调节的重要细胞内信号通路。YAP作为该信号通路中的重要转录共激活因子,可能参与了卵巢局部激素代谢调控[19]。但目前卵巢局部Hippo信号通路与FSH以及相关激素代谢调控基因之间的表达关联如何尚不明确。
EGF家族受体属酪氨酸激酶家族,主要包括ErbB-1、ErbB-2、ErbB-3和ErbB-4。EGF家族因子中EGF、HB-EGF、TGF-α、EREG、BTC和双调蛋白均可与其结合。EGFR不仅表达于排卵前卵泡的颗粒细胞内,在卵丘颗粒细胞及黄体内也均有表达。本研究中检测了人颗粒细胞EGF家族受体因子ErbB-4的表达情况,发现其在外源性FSH诱导下表达上调,提示在排卵前后FSH可能诱导EGF表达增强,参与介导细胞增殖分化等功能。人芳香化酶基因位于15号染色体长臂,虽然不同组织表达的芳香化酶蛋白结构相似,但其转录情况和蛋白结构存在组织差异。本研究证实了卵巢颗粒细胞局部外源性FSH能够诱导芳香化酶蛋白Cyp19的表达,并且两种不同诱导剂量下的表达水平均相似。CTGF作为参与增殖与凋亡调控的YAP基因下游重要靶基因,它与卵巢局部生理过程的作用已有研究。近年的研究表明,CTGF通过直接结合microRNA促进卵巢颗粒细胞增殖抑制调亡的机制,参与卵巢局部的生理病理过程的调节[26]。本研究发现,经过FSH诱导后的卵巢颗粒细胞中CTGF的表达明显下调,但不同FSH诱导剂量之间并无差异。这个结果提示FSH可能诱导激素代谢相关基因高表达的同时,触发颗粒细胞局部的调亡调控机制,CTGF明显表达明显下调。本研究也发现,卵巢颗粒细胞中激素代谢相关基因RUNX-2、ITGB2在FSH诱导后也出现非常显著的差异性表达,激素代谢基因Ptgs2的表达均明显上调。上述结果提示,外源性给予适量的FSH可能增加Cyp19和Ptgs2等激素代谢相关基因的合成和表达,可能通过YAP的调节参与颗粒细胞激素调控,影响颗粒细胞增殖和凋亡影响局部激素合成释放。
本研究利用人原代卵巢颗粒细胞,初步探索了Hippo信号通路在卵巢颗粒细胞局部的激素代谢调节。由于本研究进行Hippo通路相关基因以及颗粒细胞激素代谢相关基因的表达检测,存在一定的局限性,仅仅报道卵巢颗粒细胞中FSH可诱导Hippo信号通路激素代谢相关基因的表达改变,得到了初步结论,但本研究并未涉及机制的深入探讨。因此,下一步将围绕卵巢局部颗粒细胞的增殖与调亡调控机制的探讨,进一步通过细胞水平以及在体相关研究,进行Hippo信号通路的激素调控机制的深入探讨,重点围绕Hippo通路中的关键分子与上述激素代谢相关基因在增殖与凋亡相互作用的关系,找到Hippo通路参与卵巢局部激素代谢调控的关键环节。
