富马酸二甲酯通过NF-κB通路抑制IL-1β诱导的小鼠软骨细胞炎症
2022-09-05李仪杰梁家榕
杨 焕, 李仪杰, 梁家榕, 赵 杰, 马 辉, 叶 斌
(1. 云南中医药大学,昆明 650500; 2. 上海市骨科内植物重点实验室,上海交通大学医学院附属第九人民医院骨科,上海 200011)
骨关节炎(osteoarthritis, OA)是一种退行性关节疾病,易导致老年人膝关节功能障碍,严重影响患者的生活质量,预计到2030年,中国约有4亿人可能受到影响,其造成了沉重的社会经济负担[1]。OA主要表现为软骨退变、关节内炎症和软骨下骨重塑,其病因尚不清楚。研究表明,促炎细胞因子白细胞介素-1β(interleukin-1β, IL-1β)可诱导软骨细胞中细胞外基质(extracellular matrix, ECM)的代谢失衡[2],基质金属蛋白酶(matrix meta-lloproteinase proteins, MMPs)等降解酶的激活,将导致骨关节炎患者关节软骨细胞外基质中蛋白多糖和Ⅱ型胶原(Collagen Ⅱ)的丢失和降解[3-4],同时IL-1β可诱导软骨细胞释放炎症介质NO和PGE2[5]。IL-1β与骨关节炎进展密切相关,参与整个OA炎症反应与软骨细胞凋亡的过程,在OA发病过程中起到关键作用,可促进其分泌一系列炎症因子,提高ECM降解酶表达水平,抑制合成蛋白多糖和Collagen Ⅱ,激活炎症反应等[4,6]。因此,本研究中采用IL-1β诱导炎性软骨细胞,模拟真实OA炎症内坏境。从OA进展的潜在分子机制来看,抑制炎症途径(如NF-κB通路),干扰MMPs或促炎细胞因子活性,可能有助于缓解关节软骨退变的进展。富马酸二甲酯(dimethyl fumarate, DMF)(C6H8O4)是Nrf2途径的激活剂,在人类内皮细胞[7]中显示出抗氧化和抗炎作用。然而,对软骨细胞的抗炎作用很少有相关研究报道。本研究探讨DMF在IL-1β诱导的小鼠ATDC5软骨细胞中的抗炎作用及潜在机制。
1 材料与方法
1.1 ATDC5细胞及培养
小鼠ATDC5细胞由中国科学院细胞库提供。细胞在添加10%胎牛血清和1%青霉素-链霉素的高糖培养基(DMEM)中培养(Gibco公司)。
1.2 主要试剂和耗材
用于体外细胞研究,富马酸二甲酯(DMF)(货号: S2586,Selleck公司)。将其作为50 mg原溶液溶解在DMSO中,并保存在-20 ℃下。为降低细胞毒性,DMSO的最终浓度小于0.1%。IKKα(D3W6N)、p-IKKα/β(Ser176/180,16A6)、p65(D14E12)、p-p65(Ser536,93H1)、IκBα(L35A5)、p-IκBα(Ser32)、β-actin(D6A8)和二抗(抗兔和抗鼠)购自Cell Signaling Technology公司。抗Col2a1(ab34712)、MMP9(ab5-8803)和MMP13(ab219620)均购自Abcam公司。CCK-8试剂盒购自上海生工生物技术有限公司;TRIzol试剂、BCA蛋白定量试剂盒和PVDF膜购自Thermo Fisher Scientific公司;TB Green Premix Ex Taq试剂盒购自TaKaRa公司;RIPA裂解缓冲液购自Roche公司;DAPI溶液购自Sigma公司。细胞培养耗材: 10 mL离心管、50 mL离心管、T25和T75细胞培养瓶、10 cm细胞培养皿、6孔板、12孔板、24孔板和96孔板等。
1.3 细胞计数试剂盒-8(CCK-8)检测细胞毒性和增殖
为了确定富马酸二甲酯对ATDC5细胞毒性和增殖的影响以及体外细胞干预的无毒性浓度,使用CCK-8试剂盒检测细胞毒性和增殖。为了确定毒性,将ATDC5细胞以2×104个/孔的密度接种在96孔板中,在浓度为0、3.12、6.25、12.5、25、50、100和200 μmol/L的富马酸二甲酯溶于10%胎牛血清和1%青霉素-链霉素的DMEM中培养24 h。为了确定其增殖情况,将ATDC5细胞以2×103个/孔的密度接种于96孔板中,分别培养24、48、72和96 h。24 h后加入DMF,浓度为0、3.12、6.25、12.5、25、50、100和200 μmol/L。在每个实验期结束时,在含10%的CCK-8试剂的培养基中37 ℃下孵育2 h,在酶联免疫检测仪(Tecan Life Sciences公司)上检测450 nm处的光密度值(D450)。
1.4 细胞高密度培养及阿利新蓝染色
为了评估软骨细胞的分化状况,细胞高密度培养[8],将15×106个ATDC5细胞重新悬浮在1 mL的培养基中,并在24孔板的中间接种为10 μL小液滴,随后将细胞在37 ℃培养箱中附着1.5 h,然后在小液滴周围加入1 mL DMEM培养基(含有10 ng/mL ITS和2% FBS)培养[9]。每隔2天更新一次培养基,9 d后进行阿利新蓝染色。阿利新蓝染色前先用1% PBS清洗细胞后用4%多聚甲醛固定15 min,用1% PBS清洗两遍后,在24孔板的中加入阿利新蓝染液300 μL/孔,放置室温染色24 h后去除染液即可。软骨ECM的化学组成主要为大分子的蛋白聚糖,其主要成分是酸性糖胺多糖(glycosamino-glycan, GAG)[10]。阿利新蓝染色可以通过和带有羧基的酸性黏液物质结合呈现淡蓝色,因此软骨组织中的酸性糖胺多糖可以与染料相结合从而显色[11]。图像是在X7.8 magnification(Leica DM4000 B型号;Leica Microsystems公司)。采用ImageJ软件分析阿利新蓝染色强度,以评估光密度值。
1.5 RT-PCR检测相关mRNA表达
根据说明书,使用TRIzol试剂从细胞中分离出总RNA。利用cDNA合成试剂盒从提取的RNA中反转录第一链互补DNA(cDNA)。使用TB Green Premix Ex Taq试剂盒在Applied Biosystems Quant-Studio 6 Flex实时PCR系统上进行实时定量qPCR。使用NCBI BLAST和表1中列出的序列设计特定引物对。以GAPDH基因表达作为内参对照,用2-ΔΔCt法计算出各个mRNA的相对表达量。

表1 小鼠MMP3、MMP9、MM13、SOX9、GAPDH引物序列
1.6 Western印迹法检测相关蛋白表达
使用添加磷酸酶和蛋白酶抑制剂的RIPA裂解缓冲液从培养细胞中提取细胞总蛋白。使用BCA蛋白定量试剂盒对蛋白浓度进行定量。用10%或12.5%的SDS-PAGE凝胶对提取的蛋白质进行等量(20 μg)分离,并用0.22 μm PVDF膜电印迹分离蛋白质。在室温下用5% BSA-PBS封闭膜1 h,然后在4 ℃下与一抗(在5% BSA-PBS中按1∶1 000稀释)孵育过夜(至少14 h)。然后在TBST中洗涤膜,随后与抗兔IgG(H+L)(DyLight)TM二级抗体(1∶5 000 稀释度)在室温黑暗下孵育1 h。再次在TBST中洗膜3次,并在LI-COR Odyssey荧光成像系统(LI-COR Biosciences公司)上检测到蛋白质免疫反应性。采用ImageJ软件对蛋白免疫反应条带强度进行半定量分析,并将其与内参β-actin对照。
1.7 免疫荧光染色
对于免疫荧光,ATDC5细胞以5×104/孔的密度接种在6孔板的载玻片上8 h。8 h后,ATDC5细胞在37 ℃下进行DMF(12.5 μmol/L和25 μmol/L)预处理或不进行预处理2 h,随后用IL-1β在37 ℃ 下刺激细胞10 min,然后在RT下用4%多聚甲醛固定载玻片48 h,浸入PBS中,并洗涤3次,每次5 min。在切片中加入自荧光猝灭剂5 min,并在室温下用封闭缓冲液封闭30 min。随后将载玻片与抗p-p65一级抗体(1∶100稀释度)在4 ℃的湿盒中孵育过夜。第二天,用PBS清洗载玻片,并用N-Alexa Fluor 488-结合二级抗体(抗兔;1∶500)在黑暗中室温下放置50 min。随后,用PBS清洗载玻片,然后在黑暗中用DAPI溶液在RT下培养10 min,以染色细胞核。载玻片用PBS清洗3次后,浸泡于PBS中进行拍摄。数字荧光图像是在Leica dm4000 B荧光显微镜下拍摄。
1.8 统计学分析

2 结 果
2.1 富马酸二甲酯对ATDC5细胞毒性及增殖的影响


图1 不同浓度的富马酸二甲酯对ATDC5细胞毒性和增殖的影响
2.2 富马酸二甲酯逆转IL-1β诱导的ATDC5细胞炎症所致的ECM分解下降
使用细胞高密度培养ATDC5细胞,进行阿利新蓝染色分析细胞分解代谢的情况,并检测了不同DMF浓度作用条件下软骨ECM的分泌情况。在DMF处理软骨细胞9 d后,与对照组相比,IL-1β刺激减弱了ECM阿利新蓝的染色程度且面积显著减少,差异有统计学意义(P<0.000 1)(图2)。经12.5 μmol/L和25 μmol/L浓度的DMF治疗后可以观察25 μmol/L时软骨ECM染色最深且面积最大,差异有统计学意义(P<0.001)。说明DMF能有效挽救IL-1β刺激导致软骨细胞分泌ECM丢失。与对照组相比,单独用DMF 25 μmol/L浓度处理细胞,ECM染色程度和面积差异无统计学意义(P>0.05)。

图2 富马酸二甲酯对IL-1β诱导的ATDC5细胞ECM的影响
2.3 富马酸二甲酯抑制IL-1β诱导的ATDC5细胞中MMP家族上调和SOX9下调


图3 富马酸二甲酯干预IL-1β诱导ATDC5细胞的mRNA相对表达情况
通过Western印迹法检测DMF对ATDC5软骨细胞相关蛋白质表达水平的影响。用IL-1β刺激后,ATDC5细胞MMP9和MMP13表达增加,使用12.5 μmol/L和25 μmol/L DMF有效地抑制了MMP13和MMP9蛋白的上调,差异有统计学意义(P<0.05)(图4)。此外,炎症诱导后Col2a1表达降低,DMF治疗后Col2a1表达增加,差异有统计学意义(P<0.05)。DMF治疗后明显抑制了IL-1β诱导ATDC5细胞中的MMP9和MMP13蛋白上调,以及抑制了Col2a1蛋白的下调。

图4 富马酸二甲酯干预IL-1β诱导ATDC5细胞蛋白表达水平情况
2.4 富马酸二甲酯抑制NF-κB通路激活减轻ATDC5细胞损伤


图5 富马酸二甲酯对IL-1β诱导ATDC5细胞NF-κB通路磷酸化的影响
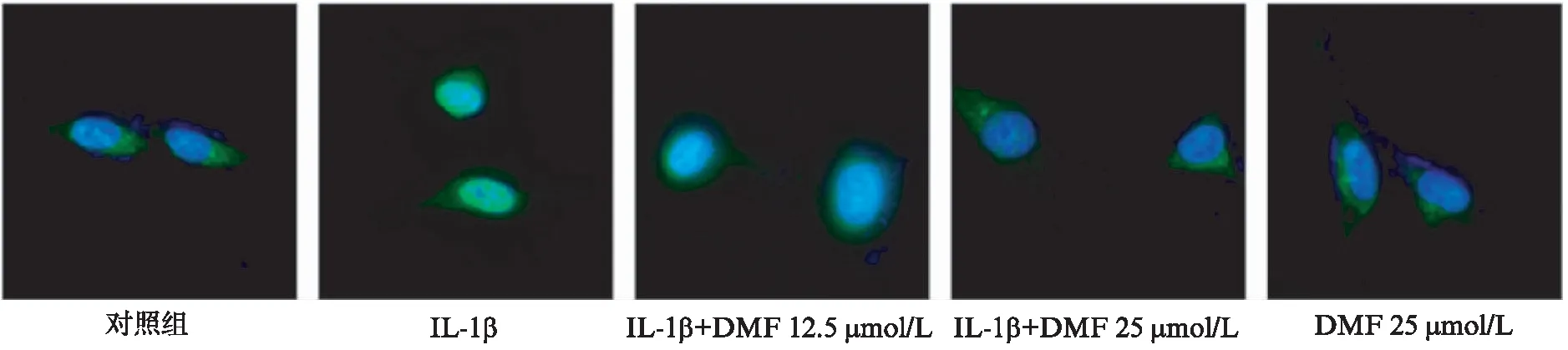
图6 DMF对p65磷酸化入核的影响
3 讨 论
OA是与年龄相关的退行性变,影响着全世界越来越多的人[12]。目前,OA的主要治疗方法是手术干预,其目的是实现症状缓解,提高运动功能,虽然这种治疗方法作为终末期选择是有效的,但也可能是创伤性的,并且有许多副作用[13]。因此,OA缺乏早期和中期治疗方案来改善和治疗这种慢性病。有研究报道,DMF对Col2a1具有保护作用[14]。本研究通过选取DMF,一种用于治疗多发性硬化和银屑病的免疫调节药物[15],探讨其是否可以改善OA的症状或减缓OA的进展,并对其分子机制进一步研究。
在关节退行性变过程中,尤其是在软骨退行性变过程中,促炎细胞因子IL-1β的水平升高,将导致进行性细胞介导的分子和结构恶化[4,16]。IL-1β通过多种重要的细胞内级联作用发挥其有害功能,如NF-κB通路,是OA治疗潜在的重要靶点,NF-κB信号通路异常活化在OA的发生、发展和进展中发挥着重要作用,参与OA滑膜炎症和关节软骨损伤[17-18]。目前相关研究表明,IL-1β刺激软骨细胞后,NF-κB通路被激活,IL-1β通过其受体传递炎症信号并激活IKK复合物的磷酸化[19],然后磷酸化IκBα[20],磷酸化的IκBα进一步泛素化降解,使得与之结合的NF-κB在胞质中转变为游离态,进而p65磷酸化并转运到细胞核中,启动了炎症产物、分解代谢酶和凋亡介质等相关调控基因的转录[21-23],细胞出现凋亡,增殖受到抑制,MMPs的表达水平增加,蛋白多糖和Collagen Ⅱ降解逐渐减少,从而导致ECM转变为分解代谢和降解状态[24-25],这种不平衡导致软骨细胞衰老,随后软骨ECM丢失[26-27]。
在本研究中,用IL-1β诱导ATDC5软骨细胞,采用qRT-PCR、Western印迹法及免疫荧光染色方法的检测了MMPs、SOX9和Collagen Ⅱ在软骨细胞中的表达,与对照组相比,IL-1β刺激ATDC5细胞后NF-κB通路被激活,表现为IκBα磷酸化并迅速降解,IκBα蛋白表达下降,而p-IKKα、p-IκBα和p-p65 蛋白表达增加,活化的NF-κB p65进入细胞核中,导致促炎产物和分解代谢酶的产生,使MMP3、MMP9、MMP13的表达上调,Collagen Ⅱ和SOX9的表达下调。这些说明IL-1β诱导软骨细胞通过激活NF-κB通路p-p65的入核高表达MMPs导致软骨ECM降解。Collagen Ⅱ是软骨ECM的主要组成成分,IL-1β具有抑制软骨细胞中Collagen Ⅱ蛋白表达能力[28],而SOX9是细胞内的重要转录因子,其在软骨ECM代谢方面起着重要的调节作用,SOX9不仅能够促进软骨标志物Collagen Ⅱ基因转录,增加Collagen Ⅱ的表达,而且能够抑制MMPs的表达,减少ECM的丢失,从而维持软骨细胞表型[29]。在本研究中,与IL-1β组比较,DMF治疗IL-1β诱导ATDC5细胞后通过抑制IκBα、IKKα、p65亚基的磷酸化,从而阻断了p-p65的入核,降低了炎症状态下MMP3、MMP9、MMP13的表达,抑制ATDC5细胞中分解代谢酶和炎症介质的产生,促进蛋白多糖、SOX9及Collagen Ⅱ(Col2a1)代谢合成增加,从而挽救了ATDC5软骨细胞。
目前的研究证实了DMF的有效性和安全性,但本研究仍存在一些问题和局限性。未能在体内动物实验中进一步验证评估DMF的治疗效果,因此缺乏体内证据支持DMF的有效性和安全性。DMF是Nrf2激活剂,最近有研究表明Nrf2在体内骨细胞和成骨细胞中的具有特殊作用,骨细胞中的Nrf2功能是骨稳态所必需的,并驱动骨细胞基因表达[30]。在本研究中DMF治疗后并未使表达水平回到对照组基线,间接意味着有NF-κB非依赖途径,还需要更深入的分子机制研究。本研究表明DMF可能通过抑制NF-κB通路激活来发挥对软骨细胞的保护作用,以改善软骨细胞ECM的合成代谢和分解代谢状态,这可能是OA潜在的治疗策略。
