半滑舌鳎颗粒酶B基因的克隆和表达分析*
2022-09-05扶晓琴王佳林陈松林赵法箴
扶晓琴 王 娜 王佳林 陈松林 赵法箴
半滑舌鳎颗粒酶B基因的克隆和表达分析*
扶晓琴1,2王 娜2王佳林2陈松林1,2赵法箴1,2①
(1. 南京农业大学无锡渔业学院 江苏 无锡 214081;2. 中国水产科学研究院黄海水产研究所 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东 青岛 266071)
颗粒酶(granzyme, Gzm) B是免疫炎症反应必不可少的介质,可激活半胱天冬酶3,进而诱导靶细胞的凋亡。本研究通过PCR扩增和RACE技术获得了半滑舌鳎()颗粒酶B基因()的全长cDNA序列,并对其序列特征和表达水平进行了分析。结果显示,cDNA全长为923 bp,开放阅读框长度为780 bp,编码259个氨基酸(前19个氨基酸残基为信号肽序列),5′非编码区为49 bp,3′非编码区为94 bp。的基因组结构比较保守,由5个外显子和4个内含子组成。CsGzmBl蛋白包含2个N端糖基化位点、1个催化三联体“His63Asp112Ser207”、1个“PHSRPYMA”结构域及6个保守的半胱氨酸。荧光定量PCR结果显示,在半滑舌鳎健康成鱼不同组织中均有表达,其中,在脾脏中表达量最高,头肾、中肾、肝脏和鳃中表达量次之,在肌肉中表达量最低。与对照组0 h相比,在哈维氏弧菌()感染后的不同时间点的脾脏、肠、肝脏、皮肤、鳃和肾脏中的表达水平均有不同程度的上调。研究表明,基因在半滑舌鳎抵御哈维氏弧菌感染过程中发挥重要作用。
半滑舌鳎;哈维氏弧菌;颗粒酶B基因;表达分析


半滑舌鳎()是我国重要的海水养殖经济鱼类之一,主要分布在我国沿海地区,其肉质鲜美、营养丰富,深受广大消费者喜爱,具有良好的市场需求和养殖开发潜力。然而,高密度集约化养殖以及环境污染等导致半滑舌鳎多种疾病频繁暴发。其中,最严重的是由哈维氏弧菌()引起的细菌性疾病,严重制约了半滑舌鳎养殖业的健康发展(陈政强等, 2012; 于孟君等, 2017; 王双艳等, 2019)。近年来,以提高鱼体抗病力为目标的良种选育,被认为是当下解决半滑舌鳎病害的一种行之有效的方法(Zhou, 2019)。长期以来,鱼类免疫机制及抗病分子机制的基础研究比较薄弱,严重阻碍了鱼类抗病育种的发展(陈松林, 2004; 周欣等, 2021)。因此,对半滑舌鳎抗病分子机制的研究迫在眉睫,这将为其病害防治提供重要的理论依据。目前,关于基因在半滑舌鳎中的研究尚未见报道。因此,本研究对半滑舌鳎基因()的全长cDNA序列进行克隆,采用实时荧光定量PCR技术(qRT-PCR)检测了该基因在健康半滑舌鳎不同组织中的表达模式,以及哈维氏弧菌感染后不同组织的表达水平,旨在为进一步研究该基因在半滑舌鳎免疫应答中的作用机制奠定基础。
1 材料与方法
1.1 样品采集
1.1.1 正常组织样品采集 本实验所用半滑舌鳎均购自山东省海阳市黄海水产公司,在22℃循环海水中养殖。选取5尾健康、体重为(104.9±4.6) g的半滑舌鳎个体,分别收集鳃、头肾、肝脏、肠、皮肤、脑、中肾、肌肉和脾脏共9个组织,立即置于液氮中冷冻,然后转入–80℃保存。
1.1.2 哈维氏弧菌感染与样品采集 采用Wei等(2018)的方法,对10月龄健康半滑舌鳎进行哈维氏弧菌感染实验。首先定量培养哈维氏弧菌(Wang, 2017),然后用无菌PBS将哈维氏弧菌稀释至终浓度为1.0×104CFU/mL,用于半滑舌鳎腹腔注射实验,对照组注射等体积的无菌PBS。分别在感染前0 h与感染后12、24、48、72及96 h共6个时间点取样,每个时间点分别取3尾半滑舌鳎,取其肝脏、脾脏、肾脏,肠、鳃和皮肤共6个组织,放入液氮中速冻,随后转入–80℃保存。
1.2 RNA提取与cDNA合成
使用RNA提取试剂盒(Invitrogen, 美国)提取各组织的总RNA,用1%的琼脂糖凝胶电泳检测RNA的完整性,用分光光度计检测RNA的浓度和纯度。RNA质量鉴定合格后,使用Prime ScriptRTreagent kit with gDNA eraser试剂盒(TaKaRa, 日本)合成cDNA。使用SmartTMRACE cDNA amplification kit (TaKaRa, 日本)合成RACE-Ready cDNA。
1.3 CsGzmBl基因全长cDNA的克隆
根据半滑舌鳎全基因组测序结果(Chen, 2014),获得基因的预测序列(登录号:XM_008328902.3),以该序列片段设计引物(表1),先进行普通PCR扩增,验证其ORF区。普通PCR扩增体系:2×ExMix(TaKaRa, 日本) 25 µL,CsPRF1l- ORF-F/R引物各1 µL,cDNA模板2 µL,ddH2O补至50 µL。PCR扩增条件:94℃ 4 min;35个循环(94℃ 30 s,58℃ 30 s,72℃ 1 min 45 s);72℃ 10 min。将PCR产物进行琼脂糖凝胶电泳检测,并使用DNA胶回收试剂盒(天根,中国)进行纯化回收。将纯化的片段连接到pEasy-T1载体(全式金,中国),通过42℃热激法转入到Trans-T1感受态细胞中(全式金,中国),最后挑取单克隆,送华大基因进行测序,成功获得的ORF区序列。
以得到的ORF区序列设计RACE引物(表1),以合成的RACE-Ready-cDNA为模板,通过降落PCR进行5′-RACE和3′-RACE PCR扩增。第1轮反应体系为10 μL,按照TMhot start (TaKaRa, 日本)说明书加样。PCR程序:94℃ 30 s;72℃ 3 min,5个循环;94℃ 30 s,70℃ 30 s,72℃ 5 min,5个循环;94℃ 30 s,70℃ 30 s,72℃ 3 min,25个循环;72℃延伸10 min。将第1轮的PCR反应产物稀释50倍后作为第2轮普通PCR的模板,普通PCR体系和程序均同上所述。扩增完成后,进行分子克隆实验,并挑取单克隆送测序。成功获得5′和3′端序列,然后,通过DNAstar软件进行拼接,最终获得的cDNA全长序列。
1.4 序列分析
利用在线程序ORFinder (https://www.ncbi.nlm.nih. gov/orffinder/)推导基因的氨基酸序列。使用BLAST程序(http://www.ncbi.nlm.nih.gov/BLAST/)对不同物种GzmB的氨基酸序列进行同源性搜索。使用ExPASy在线软件的ProtParam程序(http://au.expasy. org/tools/protparam.html)计算CsGzmB的相对分子质量和理论等电点等理化参数。基于SMART 4.0程序(http://smart.embl-heidelberg.de/)预测该蛋白的信号肽序列及功能结构域。使用在线程序SoftBerry-Psite (http://linux1.softberry.com/berry.phtml?topic=psite&group=programs&subgroup=proloc)预测该蛋白的功能位点。使用Predict Protein (https://www.predictprotein.org/)预测该蛋白的二级结构。使用在线软件GSDS 2.0 (http://gsds.gao-lab.org/index.php)比较不同物种的基因组结构。使用BioEdit软件进行脊椎动物GzmB的氨基酸序列比对。使用MEGA 7.0软件通过NJ法–邻位相连法构建GzmB的系统进化树。
1.5 检测CsGzmBl基因的表达模式
应用实时荧光定量PCR(qRT-PCR)检测基因在半滑舌鳎健康成鱼不同组织以及哈维氏弧菌刺激后免疫相关组织中的表达水平。选用作为内参基因,用于qRT-PCR的引物均列在表1中。使用SYBR®Premix ExTM(TaKaRa, 日本)试剂盒,按照说明书在ABI 7500 Fast Real-time (Applied Biosystems, 美国)仪器上进行基因的定量分析。每个样品设置3个平行,使用2–ΔΔCt方法(Livak, 2001)计算目的基因的相对表达量。所有实验数据以平均值±标准误(Mean±SE)表示,使用SPSS 16.0软件进行单因素方差分析(one-way ANOVA)和Duncan多重比较。当<0.05时为差异显著(<0.05);当<0.01时为差异极显著(<0.01)。
表1 本研究所用的引物

Tab.1 Primers used in this study
2 结果
2.1 CsGzmBl基因的cDNA序列分析
基因的cDNA全长为923 bp,其开放阅读框(ORF)为780 bp,5′非编码区(UTR)为49 bp,3′UTR为94 bp (在polyA尾部上游5 bp处存在一个多聚腺苷酸加尾信号(AATAAA))。ORF编码一个由259个氨基酸残基组成的蛋白,分子量为29.06 kDa,理论等电点为9.23,总平均疏水系数为–0.353,脂肪系数为77.53,不稳定指数(Ⅱ)为42.36,表明该蛋白不稳定。信号肽预测显示,该蛋白的N端存在一个由19个氨基酸残基组成的信号肽。功能位点预测发现,该蛋白包含2个N端糖基化位点(分别为NSSH和NNSK)以及5个二硫键。亚细胞定位预测发现,CsGzmBl属于胞外分泌蛋白(图1)。
图1基因的核苷酸与氨基酸序列
Fig.1 Nucleotide and deduced amino acid sequence of
非编码区用小写字母表示,编码区用大写字母表示。2个预测的N端糖基化位点(NSSH和NNSK)用灰色阴影标注。起始密码子和终止密码子用红色加粗字母表示。聚腺苷酸化信号和多聚腺昔氨酸加尾信号分别用方框和下划线标出。
UTR is in lowercase, and ORF is in uppercase. Two predicted N-glycosylation sites (NSSH and NNSK) are shaded in greys. The start codon and stop codon are red in bold. The polyadenylation signal and polyadenylation tail are boxed and underlined, respectively.
2.2 多氨基酸序列比对和进化分析
对不同物种的GzmB氨基酸序列进行比对发现,在脊椎动物GzmB中比较保守的一些功能域及位点也同样存在于CsGzmBl中。CsGzmBl具有一个典型的丝氨酸蛋白酶家族所特有的“催化三联体His63Asp112Ser207”,一个保守的蛋白活性中心,一个保守的前导肽(ED),一个保守的“PHSRPYMA”序列以及6个保守的半胱氨酸(Cys)(图2)。保守的Cys分别为Cys 48、Cys 64、Cys 146、Cys 177、Cys 192和Cys 213,其中,Cys 48与Cys 64,Cys 146与Cys 213,Cys 177与Cys 192分别各自形成了二硫键。此外,CsGzmBl的Cys 5与Cys 13,Cys 203与Cys 229也分别各自形成了二硫键。CsGzmBl 5个二硫键位置如图2所示。

为更明确CsGzmBl的进化地位,选用CsGzmBl与其他物种的GzmB、GzmA及GzmM的氨基酸序列,构建系统发育树。如图3所示,所有物种的GzmA聚为一大支;CsGzmBl与其他物种的GzmB聚为另一大支,其中,部分物种的GzmM与GzmB聚在一起。在GzmB这一支中,发现有2个主要的不同分支,其中,所有硬骨鱼类的GzmB聚为一支,其他脊椎动物的GzmB聚为一支,这2大支最终汇聚在一起。因此,脊椎动物Gzm氨基酸的同源性符合进化规则。

图2 CsGzmBl基因与其他脊椎动物GzmB基因的多氨基酸序列比对
相同氨基酸和相似氨基酸分别用黑色和浅灰色阴影表示。星号表示6个保守的半胱氨酸的位置,三角形表示保守的催化三联体,黑色长方形表示保守的蛋白活性中心。不同物种信号肽的位置用白色框标注。CsGzmBl蛋白的二硫键由双箭头表示,其前导肽由双线表示。
Identical and similar amino acids are shaded in black and light gray, respectively. Asterisks indicate 6 conserved cysteines, black triangles indicate conserved catalytic triads, and black rectangles indicate conserved protein active centers. The positions of signal peptides of different species are marked with white boxes. The disulfide bond of the CsGzmBl protein is represented by a double arrow, and its activation di-peptide peptide is represented by a double line.

图3 GzmB、GzmA以及GzmM氨基酸序列的系统发育树
CsGzmBl用黑色五角星表示。
CsGzmBl was marked with a black five-pointed star.

2.3 GzmB的基因组结构
以基因的全长cDNA序列与半滑舌鳎全基因组序列进行比对,获得的基因组DNA序列,将之与的ORF序列进行比较分析,得到的基因结构。基因由1890个碱基组成,包括5个外显子与4个内含子。外显子–内含子边界均符合AG/GT拼接规则,所有的3′末端受体位点具有共同的AG序列,所有的5′末端供体位点部位都有共同的GT序列。将半滑舌鳎与其他物种的基因组结构进行比较,发现的基因组结构比较保守,均是由5个外显子和4个内含子组成(图4)。
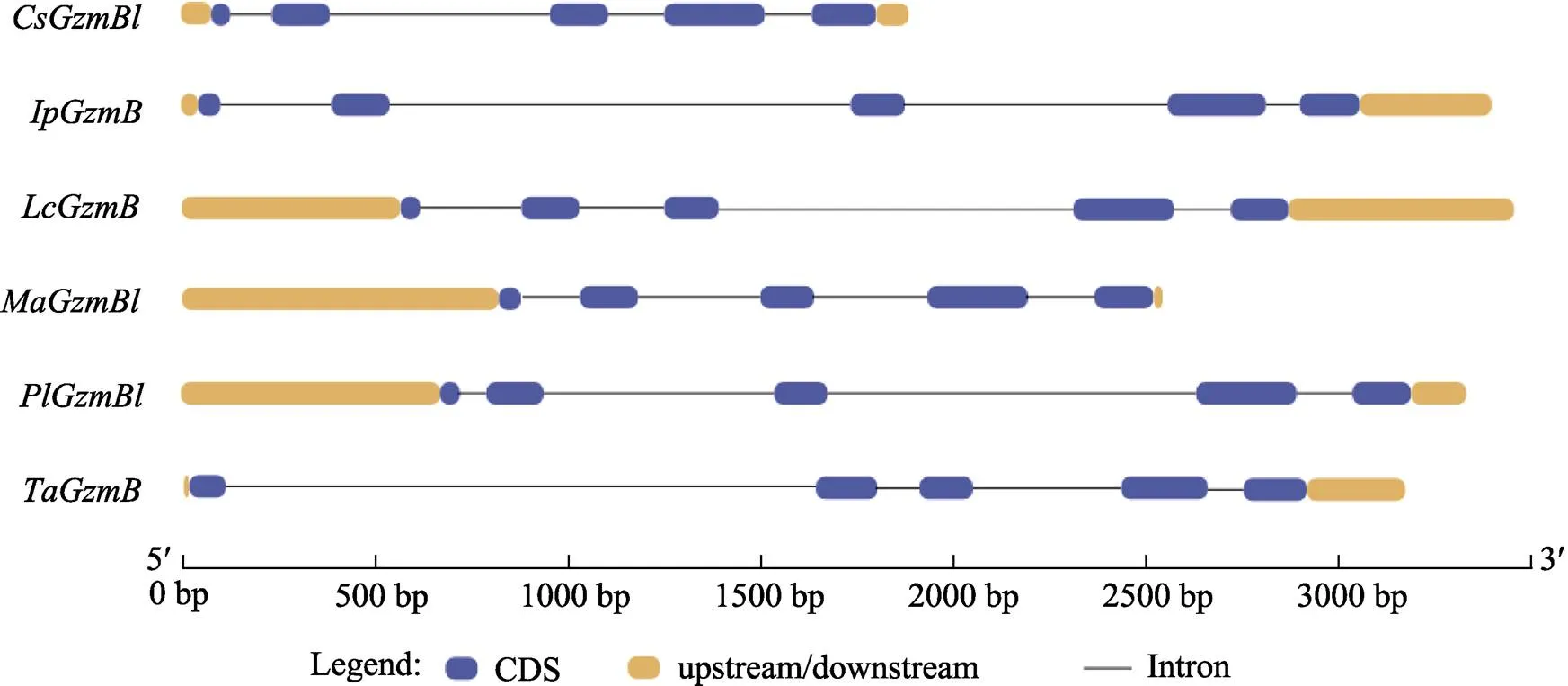
图4 CsGzmBl和其他物种GzmB基因的外显子–内含子结构比较

Exons are in blue rounded rectangles; 5′UTR and 3′UTR are in orange rounded rectangles. Lines indicate the introns. The mRNA and gene accession numbers of different speciesare as follows:: XM_008328902.3, NC_024322.1;(): XM_017478999.1, NC_030425.1;): XM_019268918.2, NC_040028.1;(): XM_020594827.1, NW_018127904.1;(): XM_015052332.1, NW_015113718.1;(): XM_034180280.1, NC_047112.1
2.4 CsGzmBl在不同组织中的表达模式
半滑舌鳎健康成鱼鳃、头肾、肝脏、肠、皮肤、脑、中肾、肌肉、脾脏共9个组织中的表达情况如图5所示。从图5可以看出,在这些组织中呈现出不同的表达情况,其中,在脾脏中表达量最高,在头肾、中肾、肝脏和鳃中表达量次之,在其他组织中表达量较低,在肌肉中表达量最低。
2.5 哈维氏弧菌刺激后CsGzmBl基因的表达变化
哈维氏弧菌刺激后,与对照组0 h相比,mRNA的表达水平在脾脏、肠、肝脏、皮肤、鳃和肾脏中均有不同程度的上调。如图6所示,在脾脏、肠和鳃中,的表达水平仅在细菌感染48 h后有明显的上调趋势(0.05或0.01),在其他时间点无明显变化。在皮肤中,mRNA的表达量在细菌感染72 h后显著增加(<0.05),在其余时间点与对照组相比无显著差异(>0.05)。在肝脏和肾脏中,细菌感染后96 h,的表达水平显著上升(<0.05),其余时间点与对照组相比也无显著差异(>0.05)。
3 讨论
本研究通过RACE方法获得了基因的cDNA全长,并对其序列进行分析,发现基因具有一些保守的功能域或功能位点。CsGzmBl具有一个序列为“His63Asp112Ser207”的催化三联体,催化三联体是肤凝乳蛋白酶的典型特征,是形成可实现精确三维定向的支架所必需的部分(Branden, 1991),在Gzm蛋白家族成员中高度保守(Smyth, 1996),如大西洋鳕GzmA/K、尼罗罗非鱼Gzm及银鲫Gzm中均具有催化三联体“His57Asp102Ser195”(Matsuura, 2014; Praveen, 2006; Wernersson, 2006)。此外,CsGzmBl蛋白还具有一个保守的前导肽ED(GluAsp),在携带翻译信息的酶转移到粗面内质网和胞外颗粒过程中起不可或缺的作用(Praveen, 2004)。大多数哺乳动物,如马、人、大鼠及小鼠的GzmB蛋白的N末端都具有一个高度保守的序列“GlyGlu(EG)或Glu-Glu(GG)”的前导肽(Caputo, 1993)。研究表明,Gzm氨基酸激活的前肽后面1~4位(IIGG)与9~16位(PHSRPYMA)高度保守(Trapani, 2001; Piuko, 2007; Pham, 1999)。哺乳动物,如人、大鼠,小鼠及马Gzm蛋白中均具有这2个保守结构域,其中,IIGG结构域是前肽裂解激活蛋白酶所必需的(Smyth, 1995)。本研究中,CsGzmBl前导肽后1~4位为“IVNG”,类似于哺乳动物Gzm蛋白的“IIGG”,第10~16位是保守的“PHSRPYMA”结构域。
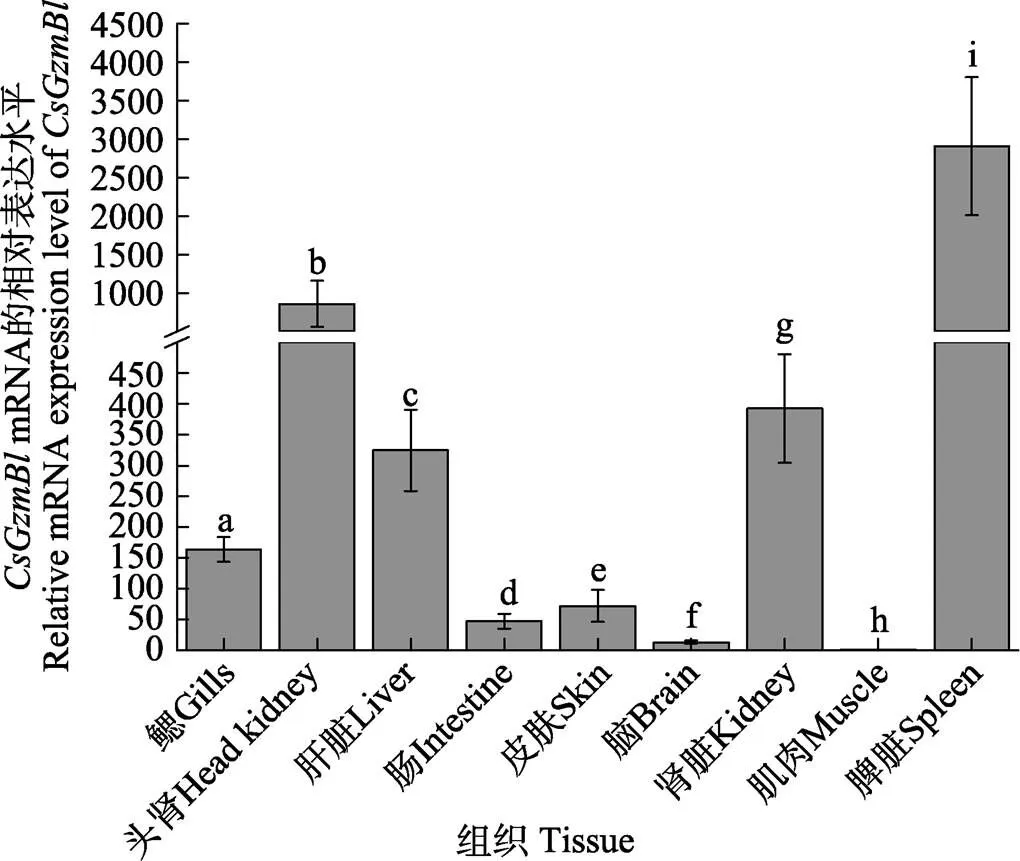
图5 CsGzmBl mRNA在健康半滑舌鳎成鱼不同组织中的表达水平
数据均以平均值±标准误表示(=3)。柱状图上方的不同字母表示各个组织之间存在显著性差异(<0.05)。
All data are shown as Mean±SE (=3). Different letters above the bars indicate significant difference at the level of<0.05.

Huang等(2010)报道称,鱼类Gzms与哺乳动物的GzmA/B/K关系更近,可能是因为GzmA/B是更古老的祖先基因。因此,推测GzmB在进化上处于更高地位,而GzmM可能由GzmB进化而来。本研究选择A和M作为进化分析的组成部分,而最终的进化分析发现,鱼类的GzmM与GzmB聚在一起,证实了此推测。本研究还发现,所有物种的GzmB始终聚在一起,符合GzmB的同源进化规则。基因结构比较发现,与其他鱼类基因均由5个外显子与4个内含子组成。据报道,家族所有成员的基因结构极其保守,如鲤、斑马鱼()、尼罗罗非鱼及人与基因均由5个外显子和4个内含子组成(Huang, 2010; Praveen, 2006)。本研究中,的基因结构符合外显子和内含子法则(Mount, 1982),但与其他鱼类基因相比,基因的长度明显较短。以上结果表明,既具备Gzm家族的典型特征,也具有GzmB的特点,进化上与Gzms家族其他成员有明确区别,因此,该基因属于硬骨鱼类同源基因。
关于鱼类基因组织表达模式的研究十分有限,仅在几种鱼中有报道鲤中基因在脾脏、鳃及头肾中高表达(肾脏中最高),其次是肾脏和肠,在肝脏和皮肤及肌肉中表达量最低(Huang, 2010)。尼罗罗非鱼的仅在肾脏和血液中被检测到,在肝脏、脾脏、鳃及肌肉中均未发现表达(Praveen, 2006)。在银鲫中,mRNA在鳃和脾脏中表达量最高,在肝脏中表达量最低(Matsuura, 2014)。虽然鱼类基因呈现出不同的组织表达模式,但它总能在免疫相关组织中被检测到。本研究发现,mRNA在半滑舌鳎健康成鱼9个组织中呈现不同的表达水平,其中,在脾脏中表达量最高,头肾、中肾、肝脏和鳃中表达量次之,肌肉中表达量最低。综合表明,基因可能在半滑舌鳎先天性免疫中具有重要作用。
许多研究表明,基因在病毒和细菌感染过程中发挥重要作用,相关研究在哺乳动物中有大量报道。然而,关于鱼类基因在细菌感染后的表达研究十分有限在鲤中发现GzmA/K可以被SVCV病毒所诱导(Huang, 2010)。鲫鱼的基因可以被迟缓爱德华氏菌()所调节。本研究发现,哈维氏弧菌感染后,基因在肝脏、肾脏、脾脏、肠、鳃及皮肤6个组织中均显著上调,说明参与半滑舌鳎的免疫防御作用,但其具体的功能和作用机制尚不清楚,还需进一步研究。
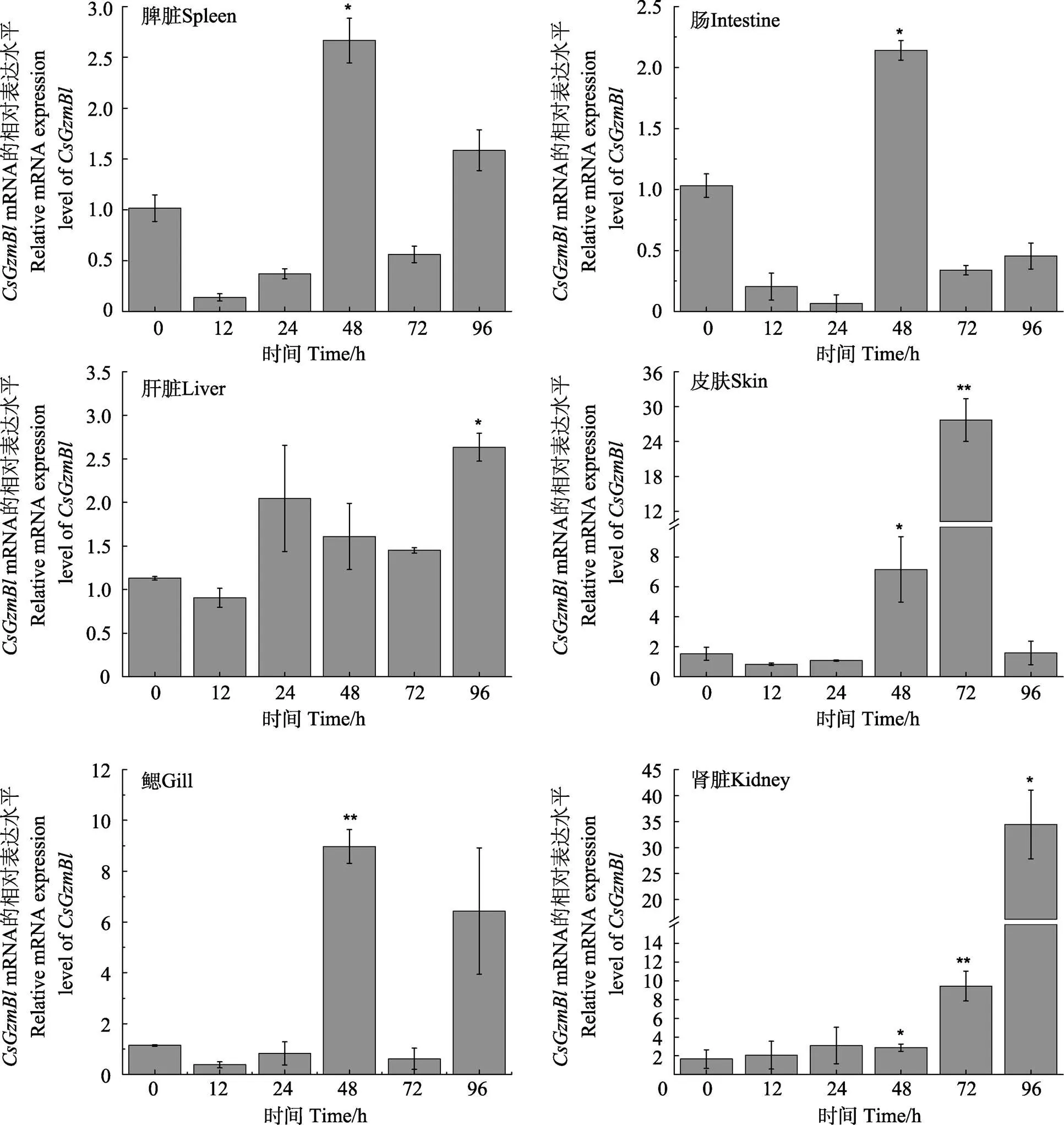
图6 哈氏弧菌感染后脾脏、肠、肝脏、皮肤、鳃和肾脏中CsGzmBl mRNA的表达情况
样品取自感染后0、12、24、48、72及96 h。数值以平均值±标准误表示(=3)。星号表示显著性差异(**<0.01,*<0.05)。
The samples are tested at 0, 12, 24, 48, 72 and 96 h after infection. All the data are shown as Mean±SE (=3). The asterisk indicates a significant difference (**<0.01, *<0.05).
综上所述,本研究通过对基因的克隆、序列特征描述以及表达模型分析,初步表明参与半滑舌鳎免疫应答过程,为进一步研究在半滑舌鳎抗病免疫中的作用机制奠定了基础。
BOIVIN W A, COOPER D M, HIEBERT P R,. Intracellular versus extracellular granzyme B in immunity and disease: Challenging the dogma. Laboratory Investigation, 2009, 89(11): 1195–1220
BOLITHO P, VOSKOBOINIK I, TRAPANI J A,. Apoptosis induced by the lymphocyte effector molecule perforin. Current Opinion in Immunology, 2007, 19(3): 339–347
BOTS M, MEDEMA J P. Granzymes at a glance. Journal of Cell Science, 2006, 119(24): 5011–5014
BRANDEN C, TOOZE J. Introduction to protein structure. New York: Garland Publishing, 1991
CAPUTO A, GARNER R S, WINKLER U,. Activation of recombinant murine cytotoxic cell proteinase-1 requires deletion of an amino-terminal dipeptide. Journal of Biological Chemistry, 1993, 268(24): 17672–17675
CHAVES-POZO E, VALERO Y, LOZANO M T,. Fish granzyme A shows a greater role than granzyme B in fish innate cell-mediated cytotoxicity. Frontiers in Immunology, 2019, 10: 2579
CHEN S L, ZHANG G J, SHAO C W,. Whole-genome sequence of a flatfish provides insights into ZW sex chromosome evolution and adaptation to a benthic lifestyle. Nature Genetics, 2014, 46(46): 253–260
CHEN S L. Progress in molecular breeding for disease-resistant marine fishes and its prospects. Science and Technology Review, 2004(9): 10–13 [陈松林. 海水养殖鱼类抗病分子育种研究进展及前景展望. 科技导报, 2004(9): 10–13]
CHEN Z Q, YAO Z X, LIN M. Study on pathogen of skin ulcer disease of half-smooth tongue sole (). Journal of Fisheries of China, 2012, 36(5): 764-771 [陈政强, 姚志贤, 林茂, 等. 半滑舌鳎皮肤溃疡病病原研究. 水产学报, 2012, 36(5): 764–771]
DARMON A J, LEY T J, NICHOLSON D W,. Cleavage of CPP32 by granzyme B represents a critical role for granzyme B in the induction of target cell DNA fragmentation. Journal of Biological Chemistry, 1996, 271(36): 21709–21712
ESTÉBANEZ-PERPIÑÁ E, FUENTES-PRIOR P, BELORGEY D,. Crystal structure of the caspase activator human granzyme B, a proteinase highly specific for an Asp-P1 residue. Biological Chemistry, 2000, 381(12): 1203–1214
HUANG R, ZHONG S, LIU H,. Identification and characterization of common carp (L.) granzyme A/K, a cytotoxic cell granule-associated serine protease. Fish and Shellfish Immunology, 2010, 29(3): 388– 398
KLEIN J L, SHOWS T B, DUPONT B,. Genomic organization and chromosomal assignment for a serine protease gene (CSPB) expressed by human cytotoxic lymphocytes. Genomics, 1989, 5(1): 110–117
LARIMER B M, WEHRENBERG-KLEE E, DUBOIS F,. Granzyme B PET imaging as a predictive biomarker of immunotherapy response. Cancer Research, 2017, 77(9): 2318–2327
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods, 2001, 25: 402–408
MATSUURA Y, YABU T, SHIBA H,. Identification of a novel fish granzyme involved in cell-mediated immunity. Developmental and Comparative Immunology, 2014, 46(2): 499–507
MOUNT S M. A catalogue of splice junction sequences. Nucleic Acids Research, 1982, 10(2): 459–472
NANEH O, AVČIN T, ZAVEC A B. Perforin and human diseases. Sub-Cellular Biochemistry, 2014, 80: 221–239
PHAM C T N, LEY T J. Dipeptidyl peptidase I is required for the processing and activation of granzymes A and B. Proceedings of the National Academy of Sciences, 1999, 96(15): 8627–8632
PIUKO K, BRAVO I G, MÜLLER M. Identification and characterization of equine granzyme B. Veterinary Immunology and Immunopathology, 2007, 118(3/4): 239–251
PRAVEEN K, EVANS D L, JASO-FRIEDMANN L. Evidence for the existence of granzyme-like serine proteases in teleost cytotoxic cells. Journal of Molecular Evolution, 2004, 58(4): 449–459
PRAVEEN K, LEARY J H, EVANS D L,. Molecular characterization and expression of a granzyme of an ectothermic vertebrate with chymase-like activity expressed in the cytotoxic cells of Nile tilapia (). Immunogenetics, 2006, 58(1): 41–55
SMYTH M J, MCGUIRE M J, THIA K Y T. Expression of recombinant human granzyme B. A processing and activation role for dipeptidyl peptidase I. 1995, 154(12): 6299–6305
SMYTH M J, O'CONNOR M D, TRAPANI J A. Granzymes: A variety of serine protease specificities encoded by genetically distinct subfamilies. Journal of Leukocyte Biology, 1996, 60(5): 555–562
SUTTON V R, BRENNAN A J, ELLIS S,. Serglycin determines secretory granule repertoire and regulates natural killer cell and cytotoxic T lymphocyte cytotoxicity. FEBS Journal, 2016, 283(5): 947–961
TRAPANI J A. Granzymes: A family of lymphocyte granule serine proteases. Genome Biology, 2001, 2(12): 1–7
TURNER C T, HIROYASU S, GRANVILLE D J. Granzyme B as a therapeutic target for wound healing. Expert Opinion on Therapeutic Targets, 2019b, 23(9): 745–754
TURNER C T, LIM D, GRANVILLE D J. Granzyme B in skin inflammation and disease. Matrix Biology, 2019a, 75/76: 126–140
WANG L, FAN C, XU W,. Characterization and functional analysis of a novel C1q-domain-containing protein in Japanese flounder (). Developmental and Comparative Immunology, 2017, 67: 322–332
WANG S Y, WANG L, CHEN Z F,. Cloning and expression analysis of the polymeric immunoglobulin receptor (pIgR) in half smooth tongue sole (). Progress in Fishery Sciences, 2019, 40(2): 51–57 [王双艳, 王磊, 陈张帆, 等. 半滑舌鳎多聚免疫球蛋白受体(pIgR)基因的克隆和表达分析. 渔业科学进展, 2019, 40(2): 51–57]
WEI M, XU W T, LI K M,. Cloning, characterization and functional analysis of dctn5 in immune response of Chinese tongue sole (). Fish and Shellfish Immunology, 2018, 77: 392–401
WERNERSSON S, REIMER J, POORAFSHAR M,. Granzyme-like sequences in bony fish shed light on the emergence of hematopoietic serine proteases during vertebrate evolution. Developmental and Comparative Immunology, 2006, 30(10): 901–918
YU M J, SUN L M, CHEN Y D,. Cloning and expression of the c-Jun gene in immune response to pathogen challenge in half-smooth tongue sole (). Progress in Fishery Sciences, 2017, 38(2): 31–39 [于孟君, 孙璐明, 陈亚东, 等. 半滑舌鳎() c-Jun基因的克隆及免疫应答分析. 渔业科学进展, 2017, 38(2): 31– 39]
ZHOU Q, SU Z, LI Y,. Genome-wide association mapping and gene expression analyses reveal genetic mechanisms of disease resistance variations in. Frontiers in Genetics, 2019, 10: 1167
ZHOU X, GAO F Y, LU M X. The progress of fish disease resistance breeding. Journal of Dalian Ocean University, 2021, 36(3): 510–523 [周欣, 高风英, 卢迈新. 鱼类抗病性育种研究进展. 大连海洋大学学报, 2021, 36(3): 510–523]
Characterization and Expression Analysis ofGene in Half Smooth Tongue Sole ()
FU Xiaoqin1,2, WANG Na2, WANG Jialin2, CHEN Songlin1,2, ZHAO Fazhen1,2①
(1. Wuxi Fisheries College, Nanjing Agricultural University, Wuxi, Jiangsu 214081, China; 2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Pilot National Laboratory for Marine Science and Technology (Qingdao), Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao, Shandong 266071, China)
B is an indispensable mediator of the immune inflammatory response, which can induce apoptosis of target cells by activating caspase 3. In this study, we cloned the full-length cDNA oflike gene () and analyzed its sequence characteristics and expression levels. The full-length cDNA ofwas 923 bp, containing a 49 bp 5ʹUTR, 94 bp 3ʹUTR, and 780 bp ORF regions encoding 259 amino acid proteins with 19 amino acid signal peptides. The genome structure ofis highly conserved and consists of five exons and four introns. The CsGzmBl protein possesses two N-terminal glycosylation sites, a catalytic triad “His63Asp112Ser207,” a “PHSRPYMA” domain, and six conserved cysteines. qRT-PCR indicated thatwas expressed in different tissues of healthyadults, with the highest expression in the spleen, followed by that in the head kidney, kidney, liver, and gills, with the lowest expression in muscle. After infection with,was up-regulated to varying degrees in six immune-related tissues (spleen, intestine, liver, skin, gills, and kidneys) at different time points compared to the control group at 0 h. These results indicate thatplays an important role in the immune response ofagainstinfection.
;;; Expression analysis
ZHAO Fazhen, Email: zhaofz@ysfri.ac.cn
10.19663/j.issn2095-9869.20210518002
*国家自然科学基金(31530078; 31973006)和中国水产科学研究院基本科研业务费(2020TD20)共同资助[This work was supported by National Natural Science Foundation of China (31530078; 31973006), and Central Public-Interest Scientific Institution Basal Research Fund, CAFS (2020TD20)]. 扶晓琴,E-mail: qinxiaoqinxiao@163.com
赵法箴,E-mail: zhaofz@ysfri.ac.cn
2021-05-18,
2021-06-08
Q522
A
2095-9869(2022)04-0136-11
http://www.yykxjz.cn/
扶晓琴, 王娜, 王佳林, 陈松林, 赵法箴. 半滑舌鳎颗粒酶B基因的克隆和表达分析. 渔业科学进展, 2022, 43(4): 136–146
FU X Q, WANG N, WANG J L, CHEN S L, ZHAO F Z. Characterization and expression analysis ofgene in half smooth tongue sole (). Progress in Fishery Sciences, 2022, 43(4): 136–146
(编辑 冯小花)
