艾滋病合并空洞性肺病变患者的临床和影像学特征
2022-09-05许飞龙郭朋乐谢志伟邓西子江松峰丁岩李青青李凌华蔡卫平陈谐捷
许飞龙 郭朋乐 谢志伟 邓西子 江松峰 丁岩 李青青 李凌华 蔡卫平 陈谐捷
广州医科大学附属市八医院感染病中心 510060
艾滋病患者出现空洞性肺病变在临床实践中很常见,部分病例通过临床表现、影像学检查、痰菌检查、纤维支气管镜检查等可确诊,但部分病例诊断困难,病理诊断是肺部病变诊断的金标准。 CT 引导下经皮肺穿刺活检术(CT-PTLB)因其准确率高、安全性好而应用于艾滋病合并肺部病变的临床诊断[1]。本研究回顾性分析接受CT-PTLB 的艾滋病合并空洞性肺病变患者的临床资料,探讨其临床特征,为治疗提供可靠证据,现报告如下。
对象与方法
一、研究对象
收集2015年1月至2021年1月广州医科大学附属市八医院治疗的52例艾滋病患者临床资料,其中男 44例,女 8例,年龄为(34.5±7.3)岁,范围 27~65岁。 所有纳入患者均符合《中国艾滋病诊疗指南(2021 版)》的诊断标准[2],且经 CT 检查提示肺部组织出现空洞性病变。 本研究通过广州医科大学附属市八医院伦理委员会审核批准(审批号:市八伦字号科201816107)。
二、活检组织检查
病理学检查: 采用肺部CT-PTLB 取肺活检组织,常规4%甲醛固定,石蜡包埋,4 μm 厚切片,HE染色。 由两位高年资病理医师阅片, 采用特殊染色及免疫组化染色进行病理学检查。 特殊染色: 切片脱蜡至水, 按病理技术标准操作规范进行六胺银染色、糖原染色及抗酸染色。免疫组化:切片脱蜡至水,采用丹麦DAKO 全自动免疫组化系统,操作步骤按两步法试剂盒说明书进行。
三、统计学分析
采用描述性流行病学方法对患者临床特征、实验室检查及影像学表现进行描述, 计数资料采用例数和率表示。
结 果
一、一般情况
52例患者中,13例确证 HIV 感染 2~9年,入院院时已接受抗反转录病毒治疗(ART)2~8年;39例确证 HIV 感染 1~12 个月,入院时未接受 ART。 52例患者中 28例(53.8%)吸烟史>5年。
二、肺组织病理结果
52例患者肺活组织病理检查结果显示感染性病变43例, 其中分枝杆菌感染8例; 真菌感染35例,包括新型隐球菌感染13例,马尔尼菲篮状菌感染19例,未分型真菌感染3例;肿瘤病变9例,其中非小细胞肺癌5例(腺癌4例,鳞状细胞癌1例),小细胞肺癌4例。1例34岁男性艾滋病合并分枝杆菌感染患者、1例56岁男性艾滋病合并肺腺癌患者、1例31岁男性艾滋病合并马尔尼菲篮状菌感染患者的胸部计算机断层成像和肺组织在光学显微镜下的表现见图1~3。

图1 艾滋病合并分枝杆菌感染患者的胸部计算机断层成像()和肺组织在光学显微镜下的表现 ()

图2 艾滋病合并肺腺癌患者的胸部计算机断层成像()和肺组织在光学显微镜下的表现()

图3 艾滋病合并马尔尼菲篮状菌感染患者的胸部计算机断层成像()和肺组织在光学显微镜下的表现()
三、感染组和肿瘤组患者的临床特征比较
根据肺活组织病理检查结果, 将患者分为感染组(43例)和肿瘤组(9例)。 感染组患者男性 38例,以<40岁患者为主,共27例;肿瘤组患者男性6例,以>50岁患者为主, 共 8例。 52例患者中有 42例(80.8%)CD4+T 淋巴细胞计数<200 个/μL,其中感染组 41例,肿瘤组 1例。 52例患者中接受 ART 的患者仅占 25.0%(13例), 其中感染组 5例, 肿瘤组 8例。 两组患者中乏力(44例)、浅表淋巴结肿大(30例)均较明显,且感染组患者发热也较明显(39例)。两组患者实验室检查结果都主要表现为白细胞计数、 血红蛋白、 血小板计数的下降, 而肝肾功能(ALT、肌酐)基本处于正常范围。 预后转归方面,感染组治愈或好转高达42例,而肿瘤组仅2例。 具体结果见表1。
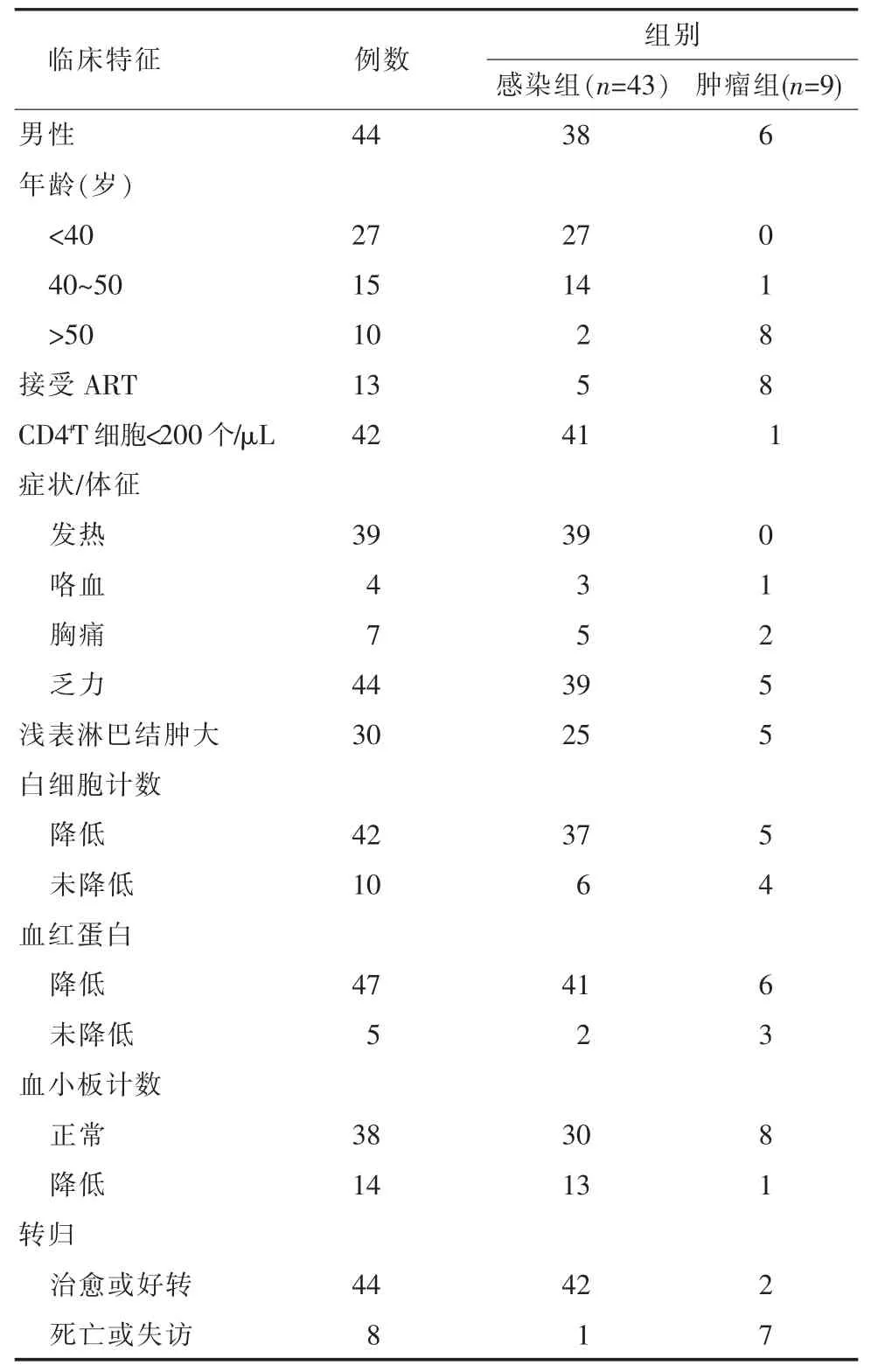
表1 艾滋病合并空洞性肺病变感染组和肿瘤组患者的临床特征比较(例)
四、感染组和肿瘤组患者胸部CT 检查的影像学特征比较
胸部计算机断层成像检查的影像学表现方面,感染组和肿瘤组的病变位置均为双肺上、下叶;感染组中58.1%患者(25例)病变直径≥2 cm,肿瘤组为7例;病变表现方面,感染组和肿瘤组患者均主要表现为厚壁空洞(27例和6例),且伴随有纵隔/肺门淋巴结肿大(33例和4例);感染组患者多见内壁光滑(37例),病变边缘可见卫星灶(18例),而肿瘤组多见外壁毛糙(8例),病变可见边缘分叶及毛刺(8例和 9例)。 具体结果见表 2。

表2 艾滋病合并空洞性肺病变感染组和肿瘤组患者胸部计算机断层成像检查的影像学特征(例)
讨 论
空洞性肺病变是一种非特异性的影像学表现,诸多良恶性病变均可出现空洞[3]。 在艾滋病患者中,空洞性肺病变不仅见于肺结核、 非结核分枝杆菌性肺病、肺脓肿、肺真菌病等诸多良性病变,也可见肺肿瘤、 肿瘤肺转移等恶性病变。 不同疾病的空洞呈现的影像学特征、临床表征有相似性,鉴别诊断存在一定困难,应用CT-PTLB 对空洞性肺病变良恶性的诊断具有十分重要的临床意义, 为目标治疗提供有力的依据。
一、 感染和肿瘤是造艾滋病合并空洞性肺病变的主要病因
本研究中艾滋病合并空洞性肺病变主要病因为感染(分枝杆菌与真菌)和肿瘤,与江松峰等[4]和Canan 等[5]的报道一致。分枝杆菌感染的临床表现受免疫缺陷程度的影响[6-7],当分枝杆菌量多、毒力强时,可出现以坏死为主的病理变化,坏死灶亦可出现液化,液化物质促使分枝杆菌大量繁殖,液化坏死物质可经肺支气管排出,形成了空洞性病变[8]。 真菌主要侵袭肺血管,病灶周围组织水肿、出血和坏死,形成单个或多个实性肺结节, 病灶中的坏死物通过肺支气管排出后,残存真菌菌丝,进而形成了空洞性肺病变[9]。 肺肿瘤的空洞性病变是肿瘤组织液化坏死后发展而来。
二、感染组和肿瘤组的临床表现、影像学表现各有不同
艾滋病患者实验室检查结果常见白细胞下降、贫血与血小板下降,这与多因素有关,包括HIV 感染、机会性感染(分枝杆菌、真菌与寄生虫等)、肿瘤、营养不良及ART 等[10]。 本研究发现感染组(分枝杆菌感染与真菌感染)与肿瘤组的临床表现各有异同:两组均表现有咳痰、乏力、浅表淋巴结肿大及体重下降, 感染组更常见发热症状。 临床表现可能有助于肺部空洞性病变的鉴别诊断,急性发作的发热、咳嗽提示感染,而慢性咳嗽、体重下降往往提示恶性肿瘤[5]。
两组肺部空洞CT 检查的影像学表现显示,感染组与肿瘤组的肺部空洞都可以发生于双肺上、下叶,病灶大小不一,厚壁空洞、内壁光滑,且伴随有纵隔/肺门淋巴结肿大。 两组不同之处在于:感染组多数患者病变边缘可见卫星灶,肿瘤组空洞偏大,病灶边缘多见分叶、毛刺,肿瘤空洞内壁由于含有不同大小的坏死性结节突入到空洞内而表现为偏大空洞。病原体感染病灶边缘毛刺征是肿瘤组织沿支气管、血管或小叶间隔浸润生长, 伴明显纤维结缔组织增生牵拉周围的小叶间隔所致, 适用于良恶性空洞病灶的鉴别; 合并肿瘤患者分叶毛糙可能与肿瘤内组织的分化程度、 肺内小叶及血管支气管阻挡引起肿瘤受限有关,也可能与肿瘤边缘呈实体向外生长,且生长速度不一致以及肿瘤内纤维组织增生收缩有关[11-12]。金艳凤等[13]研究认为影像学特征与病理学存在一定相关性:空洞越大、外形不规则,伴空泡征、支气管充气征、分叶或毛刺,多提示浸润性或微浸润腺癌。
三、不同水平CD4+T 淋巴细胞计数患者合并疾病类型有差异
本研究结果显示,接受ART 且CD4+T 淋巴细胞计数>200 个/μL 的患者出现空洞性肺病变,以肿瘤居多; 而 CD4+T 淋巴细胞计数<200 个/μL 的患者(包括接受ART 和未接受ART),肺空洞性病变以感染居多。 有报道显示, 结核分枝杆菌感染可出现在任何CD4+T 淋巴细胞计数水平的HIV/AIDS 患者中,但病理结果受免疫缺陷程度影响;免疫功能相对完整的结核病患者表现出肉芽肿性或坏死性炎症,可出现空洞性肺病变,随着免疫缺陷程度加剧,肉芽肿逐渐减小、消失,空洞性病变少见[14]。 非结核分枝杆菌感染在CD4+T 淋巴细胞计数<50个/μL 的患者中较为常见,可出现空洞性肺病变[7]。
综上所述, 艾滋病患者合并空洞性肺病变的主要病因有感染(分枝杆菌感染与真菌感染)与肿瘤。二者的CT 检查影像学特征有部分差异,临床症状、是否接受ART 与基线CD4+T 淋巴细胞计数水平对判断病因有一定意义。采用CT-PTLB 进行活组织检查对病因诊断有极大帮助, 为个性化精准治疗提供依据,提高疾病诊治的效益。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明许飞龙:数据收集、论文撰写;郭朋乐、谢志伟、邓西子:数据分析、统计学处理;江松峰、丁岩、李青青:数据采集;李凌华、蔡卫平:对文章的知识性内容作批判性审阅;陈谐捷:研究指导
