邻二氮菲合铁(II)组成及稳定常数测定实验的改进与优化
2022-09-03张斌刘爽朱艳艳张家源伍敏刘春梅
张斌,刘爽,朱艳艳,张家源,伍敏,刘春梅
郑州大学化学学院,郑州 450001
紫外分光光度法测定配合物组成和稳定常数的实验涉及到配位反应理论、光分析法基础,对学生深入理解配位化学、仪器分析和理论化学的相关内容颇有启发[1,2]。此外,配合物配位数和稳定性为推断配合物的性质提供了重要信息,具有重要的理论及实践意义。在pH为2-9的溶液中,1,10-邻二氮杂菲(Phen)可与Fe2+生成配离子[Fe(Phen)3]2+,其在可见光区最大吸收波长λmax= 510 nm,摩尔吸收系数为1.1 × 104L·mol−1·cm−1,溶液呈现显著的橙红色[3]。由于螯合配位及反馈π键的存在,[Fe(Phen)3]2+稳定常数较高为lgK稳= 21.3[4]。显著的显色反应和较高的稳定常数,使得紫外-可见分光光度法测定Fe(II)-Phen配合物组成具有操作简便、数据准确、重现性好等优点;此外,不超过铁含量5倍的Sn2+、Al3+、Ca2+、Mg2+、Zn2+、Cr3+、Mn2+、V5+、Co2+、Cu2+等均不干扰光度法测定,是工业用化工产品铁含量测定(GB/T 3049-2006)的方法基础。
以往由于实验条件的限制,教学中通常采用指定检测波长,由学生配制溶液,测定吸光度,之后手绘作图进行数据处理分析。教学活动只是达到熟悉等摩尔连续变化法测定配合物组成和稳定常数流程之目的,而对于研究体系则做不到完整、系统、深入理解。我们结合目前各校普遍具备的基本实验条件,对本实验项目进行了更新设计和优化。通过测定紫外-可见吸收曲线,确定工作波长,结合前线轨道理论,诠释配合物颜色;数据处理中利用软件,避免人为因素造成的误差。优化改造后的实验项目,体现了教学科研的深度融合,对于培养学生知识综合运用能力大有帮助,对于学生科学研究素质的提高具有积极意义。
1 实验部分
1.1 实验原理
1.1.1 等摩尔连续变化法(Job法)测定原理
根据朗伯比尔(Lambert-Beer)定律,平行单色光通过比色皿中均匀、非散射的稀溶液时,溶液的吸光度A与溶液中吸光物质的浓度c成正比。

其中,ε为摩尔吸收系数,b为吸收池厚度。
金属离子Fe2+和1,10-邻二氮菲有如下反应:
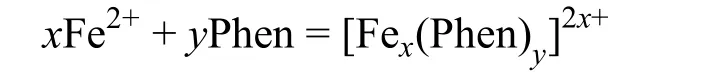
此配离子在pH = 2-9范围内,对波长为510 nm的光具有明显吸收而显示橙红色[3]。亚铁离子和配位体在此波长下无明显吸收。因此,以510 nm为检测波长,吸光度与溶液中配离子的浓度成正比。

将Fe2+与配体Phen配制成一系列浓度比(c(Fe2+) : c(Phen))变化,总浓度相等的溶液。以510 nm为工作波长,利用紫外-可见分光光度计得到系列溶液的吸光度。以吸光度为纵坐标,以连续变化的n(Fe2+)/[n(Fe2+) + n(Phen)]为横坐标作图(图1)可获得以下信息[5]:(1) 吸光度最高点对应的c(Fe2+) : c(Phen)为配离子组成比;(2) 吸光度最高点A1两边由于存在金属离子或者配体过量,配合物的解离度很小,吸光度与配合物的浓度成线性关系(图1中红色线和黑色散点图连线重合部分);(3) 吸光度最高点时,配合物的解离度会略有增大,即最大吸收处的尖锐转折会趋于平滑(图1中A2)。
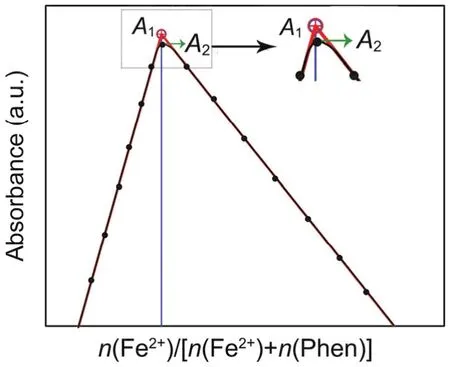
图1 吸光度与n(Fe2+)/[n(Fe2+) + n(Phen)]的关系示意图
图1中A2为配合物的实验测定最大吸光度,两侧数据线直线部分延长后的交点A1则为配合物的理论最大吸光度;由于吸光度与配合物的浓度成正比,所以配合物的解离度α可由下式进行计算得到:

进而可以计算络合物的稳定常数:

式中c0为配合物的理论浓度,可由加入铁离子的量进行计算。
显然,如已知配合物的组成比,则可对稳定常数计算公式进一步变形。例如,假定邻二氮菲合铁(II)配离子组成比为1 : 3,即x = 1,y = 3。上式可简化为:

1.1.2 溶液配制原理
Fe2+标准溶液中会有少量Fe3+存在,其也能与1,10-邻二氮菲生成组成比为1 : 3的配离子,lgK稳= 14.1,可见光区最大吸收波长λmax为610 nm,呈淡蓝色[6]。Fe3+离子的存在,使实验测试偏差较大。在加入显色剂之前,需要加入还原剂把Fe3+还原为Fe2+。常用的还原剂有:盐酸羟胺(NH2OH·HCl),其在pH = 3-4的介质中,几分钟内将Fe3+还原为Fe2+离子[7];抗坏血酸在pH = 0-1的较强酸介质中,也能够很快把Fe3+还原为Fe2+离子[8]。
考虑到1,10-邻二氮菲的pKa= 4.84[9,10],具有较强的加质子能力,在强酸介质中,[Fe(Phen)3]2+的解离程度会增大[11,12];而在pH > 5.50的溶液中铁离子易水解,生成氢化物沉淀,造成吸光度下降[8]。
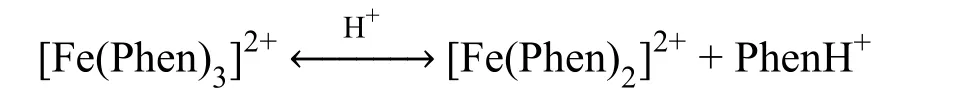
因此,本项目宜选用盐酸羟胺为还原剂,采用乙酸-乙酸钠缓冲溶液(pH = 4.50)来控制溶液的酸度。
1.2 仪器与试剂
TU-1900紫外-可见分光光度计(北京普析通用仪器有限责任公司),容量瓶等常规容量分析玻璃仪器,Fe2+标准溶液(1.00 × 10-2mol·L−1)、Phen标准溶液(1.00 × 10-2mol·L−1),HAc-NaAc缓冲溶液(pH = 4.50),盐酸羟胺(2%),去离子水。
1.3 实验步骤
(1) 根据文献报道的单晶结构计算配合物前线轨道(由教师指导学生在预习阶段完成)。
(2) 配制5.00 × 10−4mol·L−1的Fe2+溶液及Phen溶液;
移取Fe2+标准液和盐酸羟胺5.00 mL至100 mL容量瓶中,定容;
移取Phen标准液5.00 mL至100 mL容量瓶中,定容。
(3) 向具有序列编号的25.00 mL容量瓶中移取10.00 mL HAc-NaAc缓冲溶液,并加入所需体积(V)的Phen和Fe2+溶液。
(4) 测试配离子以及Phen溶液的紫外-可见吸收曲线,确定配合物在可见区最大吸收波长λmax作为工作波长。
(5) 利用工作波长测定配制的系列溶液的吸光度。
(6) 对数据进行分析,得到配离子的组成比,进而求出配离子的稳定常数。
2 结果讨论
2.1 溶液配制
在配制系列溶液方面,借鉴已有文献资料,设计系列溶液中Fe2+与Phen比例,使最大吸光度两侧数据均衡分布,从而提高配合物解离度计算的准确度[13]。
2.2 工作波长的确定
从配体Phen和配离子[Fe(Phen)3]2+的紫外-可见吸收光谱图(图2a)可以看出,在200-350 nm的紫外区,[Fe(Phen)3]2+和Phen表现出相似的强吸收,可归属为Phen的π-π*的电子跃迁[14]。而在配体几乎无吸收的区间(400-525 nm),配合物有较明显的吸收:最大吸收波长为510 nm,摩尔吸收系数为1.1 × 104L·mol−1·cm−1[15],这也是配离子显色的原因。通过图2b可以看出,加入盐酸羟胺以后的铁离子溶液与盐酸羟胺溶液的紫外-可见吸收光谱峰型相似,且均在400-525 nm之间未检测到吸收。显然,[Fe(Phen)3]2+在510 nm附近的吸收不是Fe2+的d → d禁阻跃迁[14]。此外,仔细观察可以发现,400-525 nm处的吸收并不是一个宽大的吸收峰,而是有一些平滑的峰包,为芳香环常有的精细结构,说明此处配离子的吸收是中心Fe(II)离子和配体Phen作用后的共同贡献。

图2 紫外-可见吸收光谱
2.3 邻二氮菲合铁(II)的显色反应机理
根据文献报道,[Fe(Phen)3]2+的基态为低自旋(1A1,S = 0),在吸收510 nm的光后产生金属到配体跃迁(1MLCT)的单重激发态[16,17]。因此,邻二氮菲合铁(II)显色的原因是发生了MLCT荷移跃迁[18]。2014年de Graaf, C.课题组[19]通过不同计算方法说明了紫外-可见吸收光谱的长波区吸收来源于MLCT荷移跃迁。此跃迁符合宇称规则(Laporte rule)和自旋多重度要求,因此摩尔吸收系数达到了104数量级,表现出明显的橙红色。
对于本科生的实验课程,紫外-可见吸收光谱的理论计算过于复杂,而前线分子轨道理论是学生较早接触和经常应用的知识。前线轨道中最高被占轨道(HOMO)和最低空轨道(LUMO),在讨论化合物的低能量吸收光谱的电子跃迁过程具有重要的指导意义[20]。2018年Selmi,W.课题组[21]利用HOMO和LUMO轨道的电子云分布说明化合物Fe(phen)3(BF4)(C2O4BF2)·H2O存在荷移跃迁。本实验指导学生运用Gaussian 09程序包[22],采用密度泛函(DFT)理论中B3LYP方法,在6-31+G (d,p)基组(非金属原子C,H,N)和赝势基组LanL2DZ (金属原子Fe)水平上对配离子的单晶结构(图3)进行了基态优化计算。
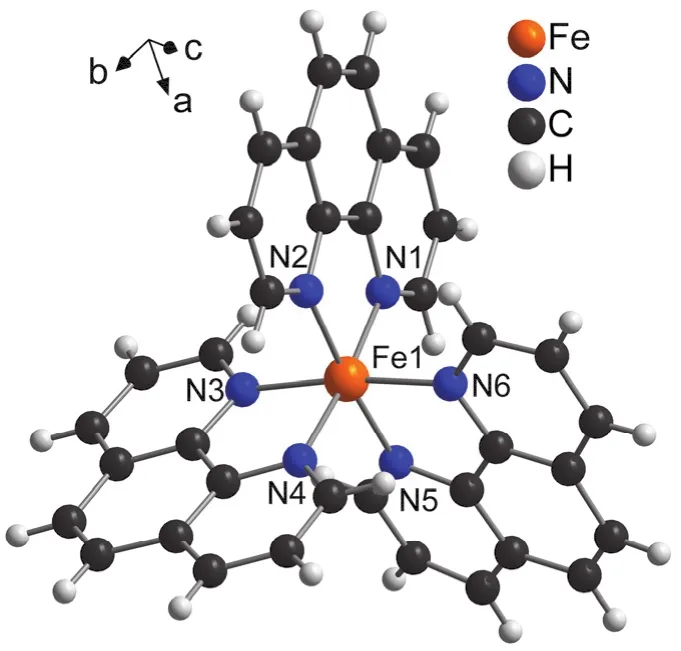
图3 [Fe(Phen)3]2+的单晶结构[21] (省去了溶剂和平衡电荷的离子)
优化前后配合物的结构无明显改变,相应的键长如表1所示。从表1的数据对比发现,Fe-N键长略有增加,但都在3%之内,说明计算中使用的方法是合适的。优化得到的键长小于2.1 Å (1 Å = 0.1 nm),符合低自旋的基态1A1时配位键的结构特征[23]。根据GaussView 5生成的配离子电子云分布图(图4)可知,配离子的最高占据轨道(HOMO)的电子云在Fe上具有较多分布,而其最低未占据轨道(LUMO)轨道的电子云主要分布在配体Phen上。显然HOMO到LUMO的跃迁可归属为铁离子到配体Phen的荷移跃迁(1MLCT)。前线轨道的计算便于学生更加深入理解分子光谱的电子跃迁本质,而且在客观上也进一步培养了学生实践结合理论的学术习惯。

图4 [Fe(Phen)3]2+的前线轨道示意图

表1 配离子晶体和优化后结构主要键长值
2.4 配离子组成分析
指定工作波长为510 nm,对配制的系列溶液进行测试,得到对应的吸光度A数据(表2)。
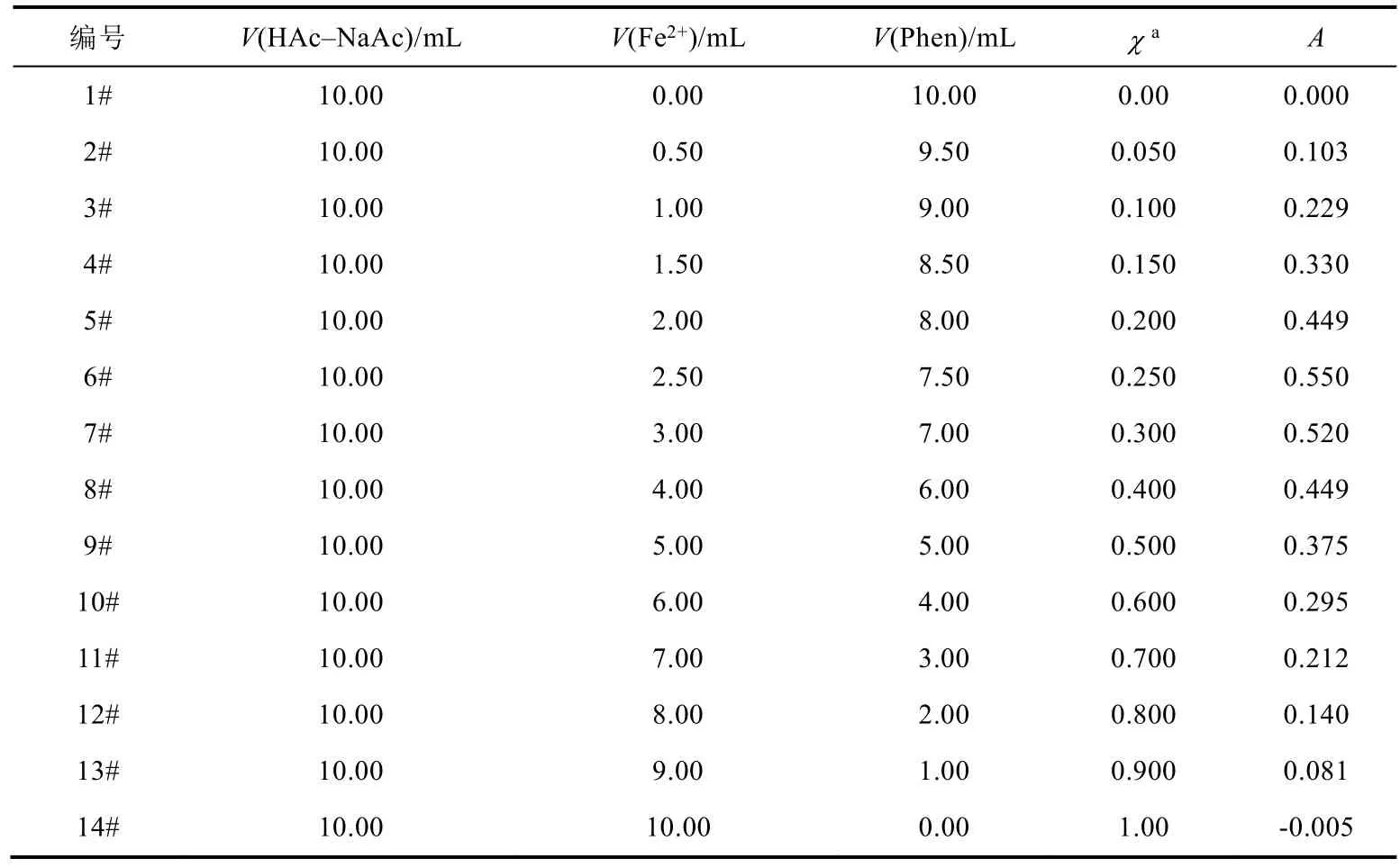
表2 系列溶液组成及其吸光度
用吸光度A作纵坐标,以溶液中Fe2+的摩尔分数χ为横坐标作图可得散点图(图5),从图中可以看出,14#溶液的吸光度虽然接近0但不为0,这是由于在空白校正时,选取未加入Fe2+的1#溶液作为空白;因此,需要对溶液的吸光度加以校正,减小系统误差[24,25]。

图5 溶液吸光度A与Fe2+的摩尔分数χ关系图
利用Origin软件以散点图中1#、14#溶液的吸光度连线作为基线进行吸光度校正,得到符合数据分析要求的散点图。进一步对散点图中顶点两侧的数据进行线性拟合得图6。图中顶点处的实测吸光度和理论吸光度非常接近,局部放大后得图6右上部的小图。从小图中可以明显分辨出实测最大吸光度A2(Y值)两侧数据的线性拟合直线交点A1对应的Fe2+摩尔分数χ(X值)为0.2498 ≈ 0.25,对应的组成比为Fe2+: Phen = 1 : 3。因此,可得邻二氮菲合铁(II)的组成为:[Fe(Phen)3]2+。
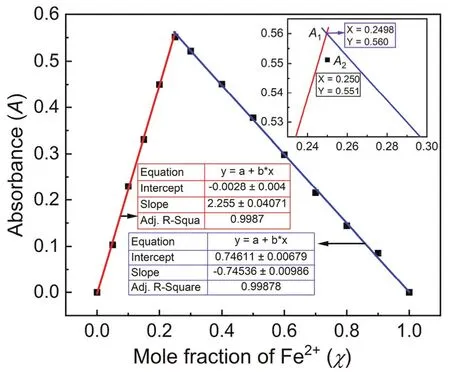
图6 校正后的溶液吸光度A与Fe2+的摩尔分数χ关系图
2.5 配离子解离度及稳定常数计算
配制溶液中6#的Fe2+: Phen = 1 : 3,其吸光度A2(Y= 0.551)为实测配离子的吸光度。由图6可以看出其吸光度值要小于拟合直线交点处的理论吸光度A1(Y= 0.560),说明配离子发生了少量解离。解离度为:

进一步可得lgK稳= 18.64,计算值在文献报道的允许范围内(17.0 < lgK稳< 21.5)。例如,1978年Irving等[26]指出[Fe(Phen)3]2+在298 K时lgK稳= 20.69;2020年Mohamed等[10]提出由于Phen的质子化效应等影响,在pH = 3.5的体系中得到[Fe(Phen)3]2+的表观(条件)稳定常数lgK稳= 17.2;2016年Lima等[27]报道的稳定常数分别为17次方和21次方(软件处理)。因此,实验结果处于合理的区间。
3 教学效果
本实验现象明显,也是目前分析检测中常用的方法,具有较好的实用价值,学生表现出较强的实验探究兴趣和创新热情。在规定的实验课时内,能够顺利完成所有实验内容,并获得数据。两届学生的数据结果显示拟合直线交点A1对应的Fe2+摩尔分数χ处于0.240-0.255之间,重现性良好;测定的稳定常数结果高度集中(17.5 < lgK稳< 20.2),符合预期结果;同时,通过分组对数据结果偏差的讨论,也锻炼了学生查阅资料、团结协作分析和解决问题的能力。此外,一部分同学还在文献调研过程中对最新报道的铁配合物类荷移跃迁激发态的相关研究[18,28]表现出了极大的兴趣,联系课题组进行相关科研实验,有效起到了教学启发科研的目的。
4 结语
本文对等摩尔连续变化法测定邻二氮菲合铁(II)的组成及稳定常数实验的内容进行了改进与扩充,提高教学训练的系统性与综合性。实验的开展有效促进了学生对配位平衡和酸碱平衡、配位显色机理、等摩尔连续变化法等知识的理解和应用;对于数据处理软件的运用,提高了实验结果的规范性和可重复性;理论和文献调研的知识在实验和问题讨论中得以验证和升华,激发了学生的实验探究兴趣和创新热情。改进后的实验有利于培养学生的学术研究能力和创新性思维,符合新时代大学生培养要求。
