紫外光诱导1-甲基-2-苯基吲哚啉的合成与表征
——国家自然科学基金项目转化的综合型微量有机化学实验
2022-09-03李冰赵馨鑫夏吾炯杜耘辰韩喜江
李冰,赵馨鑫,夏吾炯,杜耘辰,韩喜江
哈尔滨工业大学化工与化学学院,哈尔滨 150001
1 引言
有机化学实验是化学及近化学专业学生的必修课程之一,是学生理论联系实际、增强动手能力的重要环节,在高校课程体系中占有十分重要的地位[1]。伴随着有机化学新合成方法的不断涌现,实验教学也应与时俱进,不能仅仅满足于传统的知识传授、能力培养,更需要给学生提供接触科技前沿的机会,拓宽其视野,并逐步帮助他们建立环保意识和可持续发展理念[2-5]。而微量的有机光化学反应恰恰满足了这些需求,如其具有量少、高效、反应条件温和等特点。光化学反应也是有机合成化学中的常用方法之一,但在本科生实验教学中却很少采用,紫外光化学合成实验也比较少。
吲哚啉类化合物是一类重要的含氮杂环化合物,广泛存在于天然生物碱结构中,其杂环骨架是许多生物活性物质和药物分子的活性中心,如人体中重要的神经递质5-羟色胺的活性部分就是吲哚胺,另外吲哚啉类染料、太阳能电池的敏化剂,具有良好的光电转化性能,也是医药、植物生长调节剂的中间体。目前最直接的吲哚啉制备方法是通过催化加氢、环加成、过渡金属催化的芳基化或烷基化等反应实现吲哚去芳香化,反应步骤较为复杂。苯胺与烯烃分子间[3 + 2]环合反应是合成吲哚啉衍生物的有效途径,主要依靠过渡金属催化或过渡金属协同可见光化学反应的方法实现。
在进行国家自然科学基金项目“几种新型有机光化学反应研究”(NSFC 21672047)的科研工作中,我们经紫外光化学方法实现了2-单取代吲哚啉以及2,2’-双取代吲哚啉产物高区域选择性合成,研究结果发表于有机合成领域期刊Synthesis[6]。该方法条件温和,易于操作,同时光化学作为一种绿色环保的反应模式具有很好的科学性和趣味性,非常适用于实验教学。基于此,我们选取其中部分研究成果,设计了一个微量的紫外光化学合成实验:苯乙烯和N-甲基邻碘苯胺在光照下发生[3 + 2]自由基环合反应,高效合成1-甲基-2-苯基吲哚啉。避免了书本中常见的金属催化、高温状态,通过紫外光化学合成,学生可以切身实际地感受到现代化学实验中的“绿色化学”。
本实验既包含磁力搅拌、氮气交换、薄层色谱、柱色谱、旋转蒸发等基本操作,也包括了核磁共振波谱图的解析和紫外光化学反应的新知识点,产物吲哚啉骨架结构在药物及活性物质中有着重要的作用,如毒扁豆碱(−)-Physostigmines为吲哚啉骨架天然产物,可用于治疗青光眼,是一种可逆的胆碱酯酶抑制剂[7],将实验与日常生活相联系,符合实验教学绿色化、微型化[8,9]的新理念,可以帮助本科生了解有机光化学前沿进展,开拓视野,引起学生对有机化学的学习兴趣。本实验可作为具有一定有机化学实验操作基础的高年级本科生的拓展型或创新型实验项目。
2 实验部分
2.1 实验目的
(1) 掌握紫外光化学实验技术,理解自由基反应机理,掌握紫外光化学[3 + 2]环合制备吲哚啉衍生物的方法;
(2) 熟练掌握薄层色谱(TLC)、柱色谱、旋转蒸发仪、无氧氮气交换等基本单元操作;
(3) 掌握1-甲基-2-苯基吲哚啉化合物的鉴定方法。
2.2 实验原理
在有机化合物分子中形成新的碳环或杂环的反应叫做环合反应,多数环合过程是由两个反应物分子在适当位置发生缩合反应连接成一个分子,然后经分子内适当位置再环合形成新环。光化学指分子吸收光(包括紫外光和可见光)之后由基态达到激发态进而发生的化学反应行为,化学键在吸收光子能量之后发生均裂,形成具有不成对电子的自由基基团。分子间[3 + 2]型环合以及分子内自由基环合反应是合成五元环的重要手段,本实验经紫外光诱导形成自由基,发生两个分子间的自由基加成,然后再经分子内环合,获得自由基形式[3 + 2]环合反应的五元环产物。
反应机理过程如图1所示,在紫外光照射下,N-甲基邻碘苯胺通过C-I键的均裂产生自由基中间体A和碘自由基,两分子碘自由基结合为碘。自由基中间体A被苯乙烯捕获得到中间体B,在碘的氧化作用下B转化为阳离子中间体C,C经分子内的环合反应得到D。在碱的作用下,D失去质子得到吲哚啉产物。
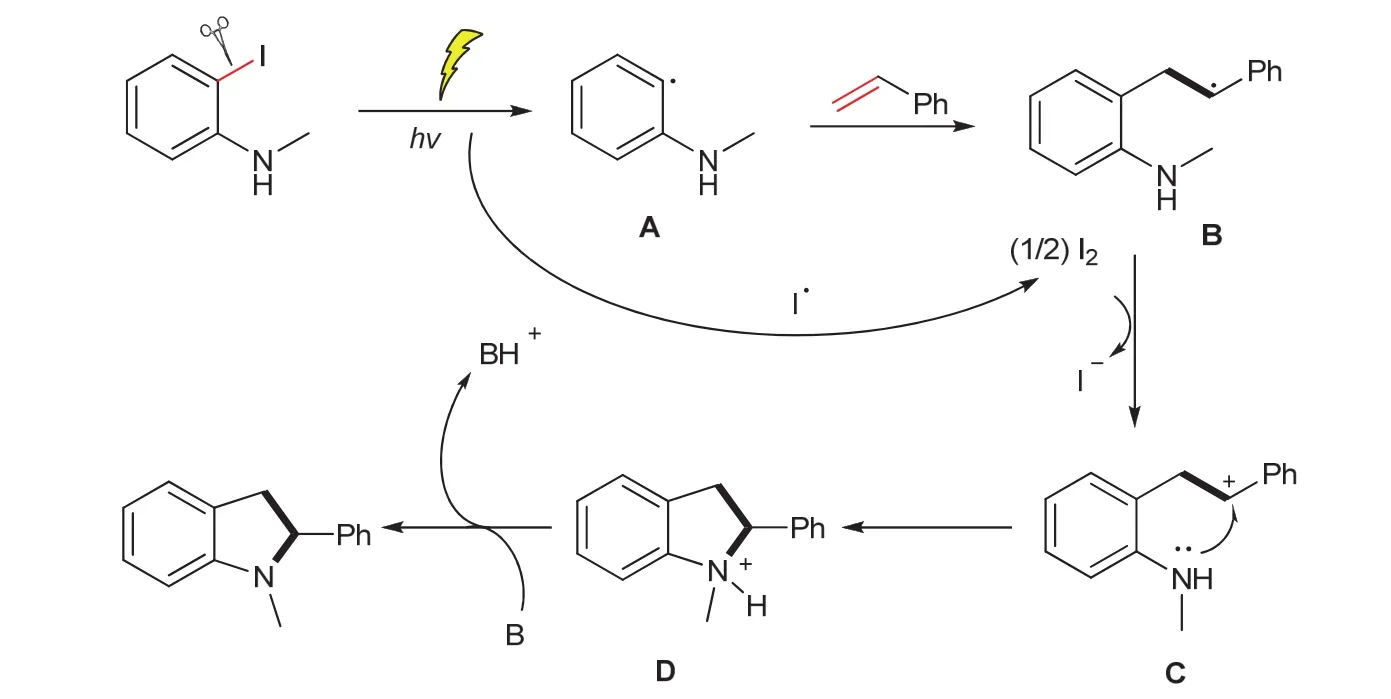
图1 N-甲基邻碘苯胺与苯乙烯的紫外光[3 + 2]环合反应机理
2.3 实验试剂与仪器:
实验主要试剂:邻碘苯胺,碘甲烷,氢化钠,苯乙烯,磷酸二氢钾,无水硫酸钠,采购于安耐吉,四氢呋喃(干燥),二甲基亚砜(干燥),乙酸乙酯,石油醚,采购于泰坦科技,试剂均为99%以上分析纯,未经特殊说明均可直接使用,柱硅胶200-300目(安徽良辰),薄层硅胶板GF254 (青岛谱科)。
实验仪器及耗材:核磁共振波谱仪(瑞士Bruker AVANCE III 600M),光反应仪(南京胥江XP-7),旋转蒸发仪(EYELA N-1100),磁力搅拌器(郑州长城85-2),循环水真空泵(郑州长城SHB),紫外分析仪(上海骥辉ZF-1),玻璃烧瓶及光反应管(北京欣维尔)。
2.4 实验步骤:
1) N-甲基邻碘苯胺的合成。
反应方程式如图2所示。将邻碘苯胺(110 mg,0.5 mmol)溶于干燥四氢呋喃(5 mL),加入25 mL干燥双口圆底烧瓶中,0 °C搅拌下加入氢化钠(60 mg,1.5 mmol),并继续搅拌30 min,然后在室温下滴加碘甲烷(4 μL,0.7 mmol),搅拌10 min。加水淬灭反应,乙酸乙酯(5 mL × 3)萃取,合并有机相,饱和食盐水洗涤、无水硫酸钠干燥,旋转蒸发仪蒸除溶剂,柱层析(洗脱剂为石油醚:乙酸乙酯,体积比为40 : 1)分离得到N-甲基邻碘苯胺(104 mg,淡黄色液体,产率:90%)。N-甲基邻碘苯胺核磁数据如下:1H NMR (400 MHz, CDCl3) δ 7.63-7.61 (m, 1H),7.22-7.18 (m, 1H),6.51 (m, 1H),6.43-6.40 (m,1H),4.16(s, 1H),2.82 (s, 3H)。13C NMR (100 MHz, CDCl3) δ 148.0,138.7,129.4,118.3,109.9,85.1,30.9[10]。

图2 N-甲基邻碘苯胺的制备
2) 紫外光诱导苯乙烯与N-甲基邻碘苯胺合成1-甲基-2-苯基吲哚啉。
反应方程式如图3所示。N-甲基邻碘苯胺(46.4 mg,0.2 mmol)置于玻璃光照管中,依次加入苯乙烯(52 mg,0.5 mmol)、2 mL DMSO,用氮气球置换体系内的空气20 min,光照管密封后置于300 nm的中压汞灯下光照并搅拌反应,用TLC监测反应进程,展开剂为石油醚:乙酸乙酯(体积比) = 50 : 1,6-8 h反应完全。反应体系加入水5 mL,乙酸乙酯(5 mL × 3)萃取,合并有机相,无水硫酸钠干燥,旋转蒸发仪蒸除溶剂,柱层析(洗脱剂为石油醚:乙酸乙酯(体积比) = 70 : 1)分离得到1-甲基-2-苯基吲哚啉(26.3 mg,无色液体,收率63%)。
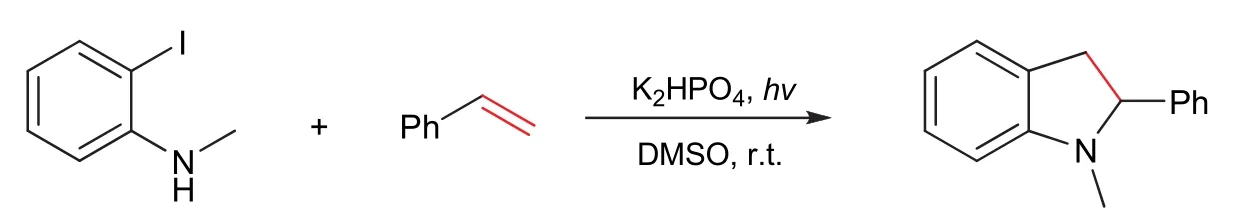
图3 紫外光诱导苯乙烯与N-甲基邻碘苯胺[3 + 2]环合反应
光化学反应装置如图4所示,光反应仪的中压汞灯灯管配有光源控制器,灯管置于石英冷凝套管中,通循环水进行冷却降温,反应管置于搅拌器上环绕冷凝套管放置进行光照,目前国内已有商业光反应装置,也可根据需要自行组装。

图4 紫外光化学反应装置
2.5 结果与讨论
2.5.1 1-甲基-2-苯基吲哚啉结构表征
1) 核磁共振氢谱表征。
核磁共振波谱仪为Bruker AVANCE III 600M,以氘代氯仿(CDCl3)为溶剂,四甲基硅烷为内标,测试不限于此型号仪器,使用其他厂家以及不同型号的仪器均可获得相近的核磁数据。
核磁氢谱(图5),共15个氢,所构建的五元环特征峰为高场区三组多重峰对应其一个亚甲基和次甲基氢,其中δ2.92和3.31两个氢,是环上亚甲基峰(CH2),由于与之相连的叔碳(CH)具有手性,使得两个氢处于不同的空间环境,造成化学位移不同,δ4.34一个氢,为CH的氢化学位移。δ2.63处三个氢的单峰,是典型的甲基氢的化学位移特征。δ6.55-7.46低场芳香区共9个氢,为两个苯环上的氢,其中右侧苯环由于其对称结构,因此有两组氢化学位移相同,对应δ7.35-7.46两组两个氢峰。氢谱数据1H NMR (600 MHz, CDCl3)δ7.44 (dd,J= 8.0, 0.9 Hz, 2H),7.36 (t,J= 7.5 Hz, 2H),7.33-7.27 (m,1H),7.14 (t,J= 7.7 Hz, 1H),7.06 (d,J= 7.1 Hz, 1H),6.71 (t,J= 7.4 Hz, 1H),6.52 (d,J= 7.8 Hz, 1H),4.34 (dd,J= 11.2, 8.8 Hz, 1H),3.31 (dd,J= 15.6, 8.8 Hz, 1H),2.92 (dd,J= 15.6, 11.2 Hz, 1H),2.61 (s,3H)。
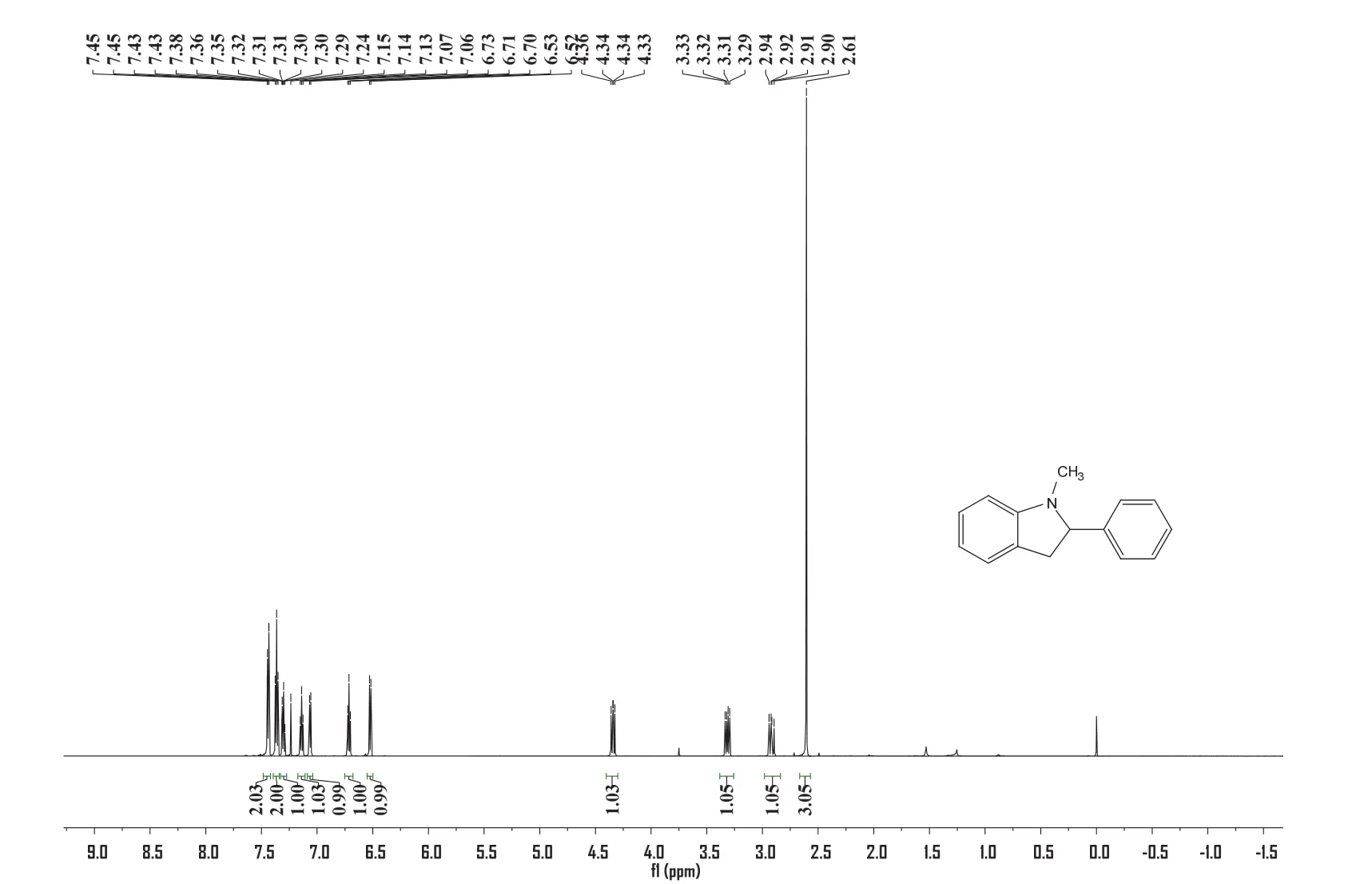
图5 1-甲基-2-苯基吲哚啉的核磁氢谱
2) 其他鉴定方法。
实验条件不允许测试核磁共振波谱时,可采取其他方法对产物进行定性的鉴定,如薄层色谱或质谱等。
薄层色谱法(TLC)鉴定,产物在薄层硅胶板上呈现淡红色,可使用展开剂为石油醚:乙酸乙酯(体积比) = 50 : 1,简便直观鉴定产物的生成。
质谱法,产物分子量为209.12,可选择气质联用仪或高分辨液质联用进行质谱测试,经气质联用检测,除可观测到该分子离子峰,还可观察到明显的失去甲基的离子碎片峰m/z194.0,高分辨质谱测得[M + H]+: 210.1277,理论计算值为210.1283,二者相符。
2.5.2 对照实验
为进一步增加学生对反应的理解,将学生分为5组,分别开展如表1所示的对照实验,对照标准反应条件,分别采用不同的光源、添加剂以及无氮气保护条件下进行反应,保持其他条件不变光照6-8 h,用同样的方法进行监测和后处理。在以上对照实验条件下,采用不同波长光源会导致收率明显降低,仅为20%-25%,而未加入磷酸二氢钾时分离收率会下降至45%-50%,避光条件下则无产物生成,无氮气保护(即在空气中进行反应)分离收率下降至40%-45%,实验结果表明该反应中光是必需条件,而光源、添加剂及空气中的氧气对反应均有较大的影响。
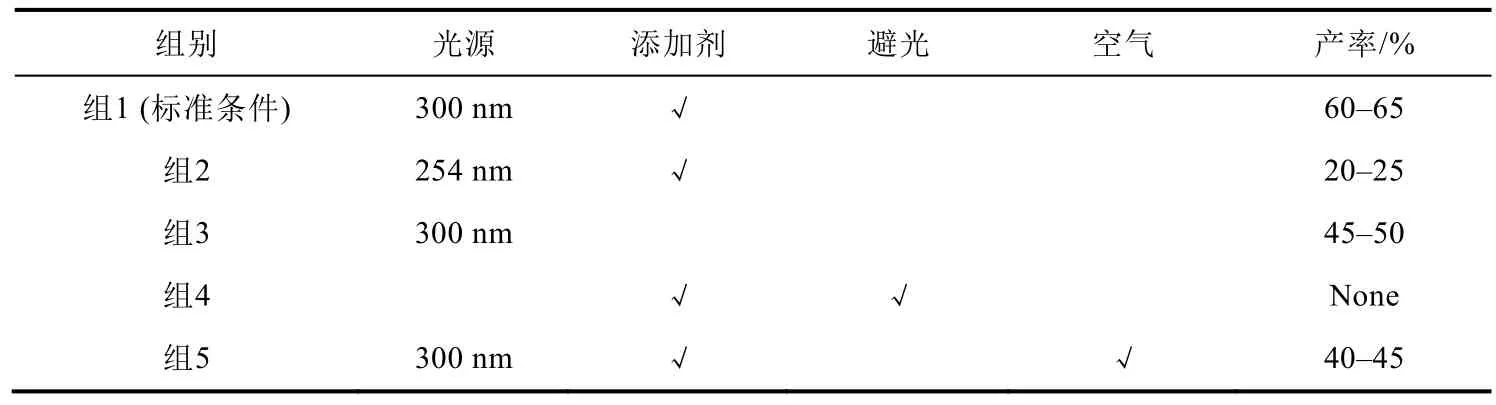
表1 对照实验
2.6 实验注意事项
(1) 光反应原料N-甲基邻碘苯胺制备方法较多,可由教师提前处理备用,也可安排连续实验由学生制备,亦可由学生自行检索文献设计其他合成方法进行准备。
(2) 光化学反应时间较长,需合理安排反应装置搭建、反应加料、反应监测及后处理等步骤。
(3) 温度升高不利于目标产物的获得,需在反应过程中通冷凝水将温度控制在25 °C左右。
(4) 紫外光反应装置应置于隔离装置中,避免直接照射损伤眼睛,在取样进行薄层色谱监测时,需将光源关闭,可将氮气球置于光照管口减少空气进入机会,取样结束继续密封反应。
2.7 思考题
要求每位同学在完成实验后提交实验报告,小组分别记录所获得的收率,并在报告的讨论部分回答以下问题:
(1) 查阅文献了解自由基反应相关知识,并分析紫外光化学的优缺点;
(2) 考虑本实验可能影响收率的其他因素有哪些;
(3) 结合文献,尝试推断反应可能的副产物有哪些。
3 结语
本实验应用紫外光化学方法合成吲哚啉衍生物,具有反应条件温和、绿色环保、易于操作等特点,避免过渡金属的使用,避免高温高压反应条件,合成的吲哚啉杂环骨架是许多具有活性的生物和药物分子的重要组成部分。将紫外光化学反应这一技术引入有机实验本科教学中,同时巩固萃取、旋转蒸发、薄层色谱以及柱色谱等操作,熟悉核磁共振波谱鉴定结构的方法并简单应用,这些能力的培养,为学生进行有机化学科学研究奠定了良好的基础。一方面可激发学生对有机化学实验的兴趣,另一方面充分体现了大学化学实验绿色化和微量化的教学改革目标,适用于本科生的实验教学。
