花生AhMYB113异位表达促进烟草花青素积累
2022-09-03李明曹慧许瑞瑞
李明,曹慧,许瑞瑞
(潍坊学院生物与农业工程学院/山东省高等学校生物化学与分子生物学重点实验室,山东潍坊,261061)
花生(Arachis hypogaeaL.)是我国重要的油料作物,是食用植物油脂和蛋白质的重要来源之一。我国花生种植面积约7000 万亩(约467 万公顷),总产约1600万吨,位居世界第一。花生含油量一般在50%左右,单位面积产油量分别是大豆的4 倍和油菜的2倍,相对于其它油料作物,花生具有种植规模大、产油效率高、油脂品质好、市场竞争力强等优势。因此,花生产业对我国国民经济的发展和粮油安全具有重要的战略意义。
花青素是一类重要的天然植物色素,广泛存在于植物的花、果实、茎和叶片中,在植物的生长发育过程中具有重要作用,如:吸引昆虫、鸟类等,为其传播花粉散播种子。花青素是一种酚类色素,其基本结构单元是3,5,7-三羟基-2-苯基苯并呋喃,作为一种非常重要的抗氧化剂,可通过抽氢反应将活跃的自由基转变成稳定的自由基,从而中断链式反应,保护生物体免受自由基侵害[1]。植物体内花青素种类繁多,黑枸杞中检测到37 种花青素[1]。根据R1和R2取代基的不同,可以形成多种花青素,植物中常见有天竺葵色素(pelargonidin)、矢车菊色素(cyanidin)、飞燕草色素(delphindin)、芍药色素(peonidin)、牵牛花色素(petunidin)和锦葵色素(malvidin),自然界中绝大多数花青素种类都是由这6 种花青素衍生而来[2,3]。花青素安全无毒,水溶性较好,是一种理想的食品添加剂,但花青素稳定性不高,温度、光照、pH值、金属离子、糖等因素均会影响其稳定性[4]。研究表明,低温、干旱等逆境胁迫能够促进植物体内花青素积累,从而缓解氧自由基的毒害,提高植物逆境适应能力[5~9]。
花青素生物合成主要受两类基因控制:一类是结构基因,编码花青素生物合成途径中的关键酶,如查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、黄烷酮3-羟化酶(F3H)、二羟基黄酮醇还原酶(DFR)以及花色素苷合成酶(ANS)等,它们共同催化苯丙氨酸和丙二酰经苯丙烷类途径合成各种花青素[10];另一类是调控基因,编码蛋白在转录水平上调控结构基因的表达模式和表达强度,如MYB、bHLH 和WD40转录因子基因[11,12]。
研究表明,MYB 转录因子家族是一个成员数量异常庞大的转录因子家族,广泛存在于真核生物中。植物体内一般含有大约200 个MYB 转录因子基因,如:拟南芥中已经发现了198 个,水稻中发现了185 个,金鱼草、玉米、棉花、番茄、苹果等植物中也发现了大量的MYB基因[13]。MYB 转录因子都含有一个高度保守的DNA 结合区域,即MYB 结构域,该结构域是一个大约50个氨基酸组成的肽段,包含一系列高度保守的氨基酸残基和间隔序列。根据MYB 结构域的数量,可以将植物中MYB 转录因子分 成4 个 亚 类:1R-MYB、R2R3-MYB、R1R2R3-MYB 和4R-MYB,其中R2R3-MYB 转录因子是植物中数量较多一类蛋白,其N 端含有两个保守的R 结构-R2R3,C 端为不保守的转录激活或转录抑制结构域[14,15]。
花青素生物代谢途径是一个非常复杂的调控网络,正调控和负调控调节是目前该领域的研究热点[16~18]。花生中,MYB 转录因子如何影响花青素合成和积累的研究报道还较少。本研究以绿色的鲁花11 和紫色种质056 杂交群体为材料,克隆花青素生物合成调控基因AhMYB113,分析保守结构域、系统进化树、表达模式以及烟草遗传转化等,探讨Ah-MYB113在花生花青素合成代谢过程中的调控作用,为今后花生品种改良提供相关的理论依据和技术支持。
1 材料与方法
1.1 材料
从鲁花11(叶色为绿色)和花生种质056(叶色为紫色)的杂交后代中,随机选择2 个绿色株系(分别命名为Green High,GH 和Green Short,GS)和2 个紫色株系(分别命名为Purple High,PH 和Purple Short,PS)作为试验材料。
将花生种子播种在花盆中,置于光照培养箱中进行培养(温度为25±0.5℃;光周期为光照16 h,黑暗8 h;湿度80%)。花生幼苗出土后2 周,取地上部的茎和叶作为RNA 提取材料,液氮速冻后-70℃保存备用。
野生型烟草(Nicotiana tabacumL.)品种NC89用于基因遗传转化。大肠杆菌DH5α、根癌农杆菌EHA105、植物表达载体pCAMBIA2300 均由本实验室保存;反转录试剂盒和克隆载体pMD18-T购于宝生物(大连)有限公司(TaKaRa);植物基因组DNA试剂盒、琼脂糖凝胶回收试剂盒和质粒提取试剂盒购于天根生化科技(北京)有限公司;DNA 聚合酶、限制性内切酶、T4 连接酶、DNA 分子量标准DL2000、卡那霉素、氨苄青霉素等实验试剂购于上海生工生物工程股份有限公司;DNA 测序由山东省农业科学院测序中心完成。
1.2 AhMYB113生物信息学分析
利用ExPASy 网站(http://expasy. org/)对花生AhMYB113编码蛋白的氨基酸序列进行等电点、分子量预测等。通过MUSCLE 程序对花生AhMYB113和其它同源蛋白进行多序列比对,选取MYB 结构域序列,再使用MEGA5.0(http://megasoftware. net)程序采用邻接法(Neighbor-Joining,NJ)生成系统进化树,校验参数Bootstrap 重复1000 次。保守性分析则采用DNAMAN 生物学软件进行保守域序列比对。
1.3 AhMYB113表达载体构建
采用CTAB 法提取花生地上部总RNA,利用Ta-KaRa PrimeScript 1st Strand cDNA Synthesis Kit 合成cDNA 第一条链。根据绿色和紫色花生数字基因表达谱和花生转录组数据电子克隆花生AhMYB113,通过Primer5.0 软件设计特异引物如下:Ah-MYB113F1:5’-GGTACCATGGAGGGATCCATAG-3’(带KpnI 酶切位点),AhMYB113R1:5’-CTGCAGTTATTGTGGATCCCAC-3’(带PstI酶切位点),PCR 产物连接pCAMBIA2300 表达载体,先提取质粒,然后转化根癌农杆菌EHA105,用于侵染。
1.4 转基因烟草的获得
利用农杆菌介导的烟草转化方法,农杆菌侵染转化烟草无菌叶片后转移至分化培养基上,待分化芽长至1 cm 时再转移至生根培养基中,生根后移入基质中培养。提取烟草基因组DNA,利用引物,通过PCR 技术筛选出转基因烟草株系。PCR 反应条件如下:94℃预变性5 min;94℃变性1 min,59℃退火40 s,72℃延伸1 min,30 个循环;72℃延伸5 min,4℃保存。
1.5 实时荧光定量PCR(qRT-PCR)
反应体系为:2×SYBR PCR mix 10µL,上、下游引物(10 mmol·L-1)各1 µL,cDNA 模板1 µL,ddH2O 7µL,总体系为20µL。qRT-PCR 反应条件为:94℃1 min;94℃10 s,60℃10 s,72℃10 s,40 个循环。每次循环第3 步进行荧光采集。所有PCR 反应都设3次重复。采用2-ΔΔCT法对数据进行定量分析,用Excel 作图。qRT-PCR 试验所需的引物通过Beacon Designer 8 软件设计,采用DNAMAN 和Primer BLAST软件验证引物特异性。
引物如下:AhMYB113F2(5’-GGAACAAGAACGGTGGCAAAGG-3’) 和AhMYB113R2 (5’ -CTTCTTCTTCTTCTTCCTCAGCACCT-3’);内参基因AhActinF3:5’-GTCATCGTCATCCTCTTCTC-3’;AhActinR3:5’-CATTCCTGTTCCATTGTCAC-3’,所有引物均由上海生工生物工程股份有限公司合成。
2 结果与分析
2.1 花生AhMYB113基因克隆和序列分析
结合花生数字基因表达谱分析结果,筛选到可能与花生花青素积累密切相关的MYB转录因子,将其命名为AhMYB113。根据AhMYB113的中间片段分别设计引物进行3’RACE 和5’RACE 扩增,最终获得AhMYB113的全长cDNA 序列。花生Ah-MYB113的ORF 全长864 bp,编码287 个氨基酸,预测分子量为32.6 kD,等电点为6.46。
2.2 花生AhMYB113结构域及进化树分析
花生AhMYB113 在GenBank 蛋白数据库中BLAST 结果显示,AhMYB113 与多种植物MYB 转录因子有较高的同源性,尤其是大豆(Glycine max)、菜豆(Phaseolus vulgaris)、鹰嘴豆(Cicer arietinum)等豆科植物。利用DNAMAN 软件对包括AhMYB113 在内的17 个R2R3-MYB 的氨基酸序列进行多重序列比对(图1),结果显示在N端都含有高度保守的2个R 基序(R2 和R3)的MYB 结构域,分别包含52 个和51 个氨基酸残基,表明AhMYB113 蛋白具有典型的R2R3-MYB结构域,属于MYB转录因子家族成员。

图1 花生AhMYB113与不同物种R2R3-MYB结构域序列比对Fig.1 Sequence alignment of R2R3-MYB domain in different species with AhMYB113 in peanut
系统进化树分析发现,花生AhMYB113 与拟南芥(AtMYB75、90、113和114)、金鱼草(AmVENOSA、AmROSEA1 和AmROSEA2)、矮 牵 牛(PhAN2、PhPHZ、PhAN4 和PhDPL)、苹果(MdMYB1、A 和10)和葡萄(VvMYBA1和VvMYBA2)中调控花青素积累的相关MYB 聚成一大类(图2),它们的亲缘关系较近,表明花生AhMYB113 可能在花生花青素积累过程中发挥重要调控作用。
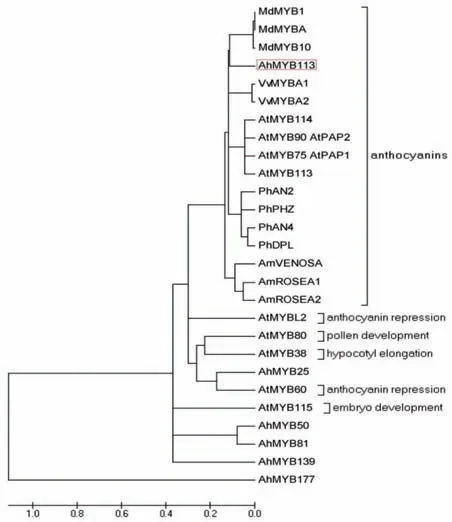
图2 AhMYB113与其它物种调控花青素生物合成相关MYB的进化树Fig.2 Phylogenetic tree between peanut AhMYB113 and other MYBs involved in the regulation of anthocyanin biosynthesis
2.3 不同花生品种AhMYB113的表达分析
利用qRT-PCR 技术分析AhMYB113在紫色和绿色花生中的表达,结果显示,AhMYB113在紫色花生(PH 和PS)中的表达量明显高于绿色花生(GH 和GS)(图3)。由此一定程度上验证了AhMYB113在花青素积累过程中发挥着调控作用。

图3 AhMYB113在不同叶色花生品种中的表达量Fig.3 Expression of AhMYB113 in peanut species with different leaf color
2.4 异位表达AhMYB113 的转基因烟草花青素含量的变化
为了进一步验证AhMYB113的功能,构建了表达载体pCAMBIA2300-AhMYB113,采用农杆菌介导法将AhMYB113转入烟草NC89,获得转基因烟草植株T-AhMYB113。随后,观察野生型烟草和转基因烟草的表型差异,由图4 可以看出,转AhMYB113基因的烟草叶片呈现不同程度的紫色,甚至有些转基因植株的根、茎和叶片均变成紫色,有些则是叶片局部呈现紫色(图4A 右)。经对比花器官和不同花期颜色发现,野生型烟草的花是粉色(图4B),转AhMYB113基因的烟草花的颜色呈现深红色甚至是深紫色,萼片颜色深于花瓣(图4C、D 的右图);转基因烟草的花药、花丝和花柱的颜色也明显不同于野生型烟草的浅黄、浅绿和绿色,而呈现深紫和浅紫色(图4E)。以上结果表明,花生AhMYB113可以促进转基因烟草的花青素积累,使转基因烟草呈现不同程度的紫色。

图4 野生型和转AhMYB113烟草的表型Fig.4 Phenotype of WT and AhMYB113 transgenic tabacco
3 讨论与结论
通过氨基酸序列分析表明花生AhMYB113在N端含有2 个高度保守的MYB 结构域,属于一种典型的R2R3-MYB 转录因子。MYB 转录因子是植物中最大的转录因子之一,具有多种生物学功能,在植物生长发育、次生代谢产物合成、植物激素应答以及对干旱、低温、高温、盐害、病虫害等多种非生物逆境胁迫的响应中均发挥重要作用[17~23]。目前,花青素合成途径是植物次生代谢产物合成中研究较多的一条途径,很多调控花青素合成的R2R3-MYB转录因子已经从水稻、棉花、大豆、马铃薯、番茄、萝卜、葡萄等植物中克隆,并进行了功能鉴定[19,24]。系统进化树分析发现花生AhMYB113与拟南芥、金鱼草、矮牵牛、苹果和葡萄中调控花青素积累的MYB亲缘关系较近,能够聚成在一起,表明花生Ah-MYB113 转录因子可能参与次生代谢调控;序列比对分析结果显示,花生AhMYB113与前人研究的Ah-MYB1和AhTc1的相似性非常高,而与AhMYB2和AhTT8的相似性较低,表明AhMYB113可能是Ah-MYB1和AhTc1的同源基因,因此,研究AhMYB113在花青素合成代谢中潜在的功能具有生物学意义。
R2R3-MYB 是调控植物花青素生物积累的一类重要转录因子。部分R2R3-MYB 转录因子能够特异性识别并结合到CHS、ANS、DFR、UFGT等基因启动子,激活下游结构基因的表达,促进花青素生物合成。这类R2R3 型MYB 转录激活因子过量表达,能够提高转基因植物中花青素含量,使转基因植物呈现紫红色或紫黑色[29]。将中国樱桃MrMYB1分别在拟南芥和烟草中异位表达,转基因拟南芥整株变成紫红色;而转基因烟草仅花瓣、花药、子房、种子等生殖器官中有大量积累花青素,叶片仍为绿色;梅花PmMYBa1在烟草中过量表达得到相似的结果,仅花和果实中花青素大量积累[29~31]。本研究将花生AhMYB113在烟草中过量表达,转基因烟草根、茎、叶、花、种子等器官均变成紫红色,不存在组织差异。R2R3 型MYB 转录激活因子转化烟草后,不同器官间花青素积累模式的差异,应该是内源bHLH以及相关结构基因表达水平或MYB转录因子作用模式不同引起的。
自然条件下R2R3-MYB 转录因子表达差异是引起农作物果实色泽变异的主要因素。由于gypsy转座子插入引起草莓FvMYB10基因发生自然突变,截断了FvMYB10蛋白全长的编码,阻断了花色素苷的合成,导致二倍体野生草莓果实色泽变异,果实变成白色[32]。苹果MdMYB10 能够调控果肉花青素合成,红肉和白肉苹果的果肉颜色差异,主要是由MdMYB10基因启动子不同造成的,红肉苹果为R6型启动子(R1:R6 或R6:R6),白肉苹果为R1 型启动子(R1:R1)。MdMYB10能够更有效地反式激活R6型启动子,从而保证红肉苹果中MdMYB10的高效表达以及花青素的大量积累[33]。萝卜RsMYB1是控制花青素积累的关键基因,心里美红肉野生型和白肉突变体RsMYB1核苷酸序列没有差异,但在启动子上游CACTA 转座子的甲基化水平上,白肉突变体明显高于野生型,去甲基化处理后白肉突变体能部分恢复花青素积累,表明RsMYB1启动子区域CACTA 转座子插入和甲基化程度较高是形成白肉突变体的主要原因[34]。
本研究结果表明,紫色花生幼苗中AhMYB113的表达水平要显著高于绿色花生,且AhMYB113异位表达可以显著提高转基因烟草各种组织中花青素的积累。如果从AhMYB113的启动子结构或者甲基化水平进行深入研究,或可进一步探究紫色和绿色花生中花青素含量差异的根本原因。
本研究克隆获得花生MYB转录因子AhMYB113基因,通过生物信息学分析发现,AhMYB113属于典型的R2R3 型MYB 转录因子,与拟南芥、金鱼草、矮牵牛、苹果、葡萄中调控花青素积累的R2R3-MYB亲缘关系近。AhMYB113在花生紫叶杂交种的表达量明显高于绿叶杂交种;在烟草NC89 中异位表达后,能够促进花青素的积累,使得转基因烟草叶片转变为紫色,花瓣、花药、花丝、花柱、柱头和萼片等组织分别呈现为紫红色或紫黑色。因此,我们认为花生的MYB 转录因子AhMYB113基因具有调控花青素积累的作用。
