pcDNA3.1-HisB-MEG3 体外表达载体的构建及分析验证
2022-09-03宋昕宇罗锦堂郭若楠
宋昕宇,罗锦堂,郭若楠,李 新
(天津农学院 动物科学与动物医学学院/天津市农业动物繁育与健康养殖重点实验室,天津 300384)
在生命过程中起着至关重要作用的生物大分子及其结构、功能和组成,一直以来都是科学家们热忱探索的课题。生命的基本过程就是从DNA 转录成RNA,再翻译成蛋白质,从而发挥生物学功能的过程,其中RNA 的编码尤为重要。科学家们把RNA 分成编码RNA 和非编码RNA(Non-coding RNA),其中长链非编码RNA(Long noncoding RNA,lncRNA)占将近98%。近十年来,随着对lncRNA 研究的深入,越来越多的研究成果证明了lncRNA 不是基因组上的“ 噪音”,其在诸多生命活动进程和新陈代谢过程中具有极其重要的作用。
作为一个已有大量研究的lncRNA,MEG3(Maternally Expressed Gene 3),又 称GTL2 (gene trap locus 2)基因,于2000 年首次被Miyoshi 等人报道,是一个lncRNA,并且是一个母系印记基因。MEG3一般位于染色体末端Dlk1-Dio3 印迹区内,人的14q32 染色体上。在小鼠上位于12 号染色体,在绵羊上位于18 号染色体,在牛上位于21 号染色体,并且小鼠MEG3 基因与人类具有同源性。
在人类医学方面,己有研究表明lncRNA MEG3在2 型糖尿病患者胰岛中表达异常。同时,MEG3是第一个被发现具有肿瘤抑制功能的lncRNA,它在人类的正常组织中广泛表达。MEG3 还可以通过多种途径抑制细胞增殖,是一个重要的肿瘤抑制因子,与多种恶性肿瘤的发病机制有关。
在维持动物有机体骨骼肌发育发面,MEG3 同样扮演着重要的调控角色,它可以显著促进卫星细胞的分化,调控骨骼肌的发育过程。MEG3 在小鼠骨骼肌发育过程中呈现显著变化,它对C2C12 细胞的分化具有促进作用,而过表达MEG3 对C2C12 细胞的增殖具有抑制作用。MEG3 可以促进小鼠、猪、牛、羊等动物肌肉细胞的分化,抑制细胞增殖,调节肌肉分化抑制因子。因此,MEG3 可作为畜牧业生产应用的分子标记。
有研究发现,lncRNA 在氧化应激反应中起到一定的作用,然而,关于lncRNA 在氧化损伤小鼠肌肉中表达情况尚不清楚。罗海静等挑选了5 种与氧化应激有关的LncRNA,试验结果发现lncRNA MEG3 在氧化损伤小鼠肌肉中的表达最高,这一研究充分证明了lncRNA MEG3 对损伤肌肉的修复起着很大作用。杨睿分别构建了2 种MEG3 的体外表达载体pcDNA3.1-MEG3-TTCC和pcDNA3.1-MEG3-CCCA,并将这2 种体外表达载体瞬时转染至猪骨骼肌卫星细胞中,再对lncRNA MEG3 的相对表达量进行检测,结果显示这2 种体外表达载体均能在体外进行表达,且pcDNA3.1-MEG3-TTCC 组的表达量显著高于pcDNA3.1-MEG3-CCCA 组。该研究说明,这2 种MEG3 的体外表达载体都能在骨骼肌卫星细胞增殖和分化过程中起着重要的调控作用。这一试验为lncRNA MEG3 对猪骨骼肌生长发育的调控作用的研究提供了充足的理论依据。
因此,无论是在癌症或肿瘤等疾病方面,还是在骨骼肌的分化和发育方面,lncRNA MEG3 都扮演着重要的角色。在前期的研究中,笔者对牛骨骼肌卫星细胞进行了转录组学、翻译组学及微肽组学3 个组学的测序分析,经过多组学联合分析发现MEG3 具有小的开放阅读框(sORF)结构,并在微肽组学中发现与之预测氨基酸序列对应的微肽产物,因此,初步判断MEG3 可能具有编码能力,可以编码产生功能性微肽。鉴于此,我们设计扩增了牛MEG3 基因ORF 区的编码序列,构建了融合蛋白载体pcDNA3.1-HisB-MEG3,把重组质粒转染至293T 细胞,检测其外源表达情况,为后续开展更深入的MEG3 功能探究提供材料和夯实基础,同时也为深入筛选验证具有编码产物的lncRNA 提供技术支持和佐证材料。
1 材料和方法
1.1 细胞来源
293T 细胞、牛骨骼肌卫星细胞(BSMSCs)均为天津市农业动物繁育与健康养殖重点实验室冻存。
1.2 质粒
质粒载体为带有His 表达标签的pcDNA3.1-HisB(图1),购自武汉淼灵生物科技有限公司。
图1 空载质粒pcDN3.1-HisB 基本结构图
1.3 试剂与耗材
试验用主要试剂和耗材见表1。

表1 试验所需主要试剂和耗材
1.4 仪器设备
CO培养箱(Thermo-scientific);Light Cycle 96荧光定量PCR 仪(Roche);超敏电泳凝胶成像分析系统(Bio-Rad);制冰机(SANYO);电泳仪(Bio-Rad);恒温循环水浴锅(德国劳达贸易有限公司);高压灭菌锅(TOMY);涡旋振荡器(德国艾卡公司);电子天平(美国奥豪斯公司);超纯水制造系统(优普);恒温摇床(IKA)。
1.5 核苷酸序列
依据转录组学、翻译组学及微肽组学多组学分析结果获得MEG3 的ORF 核酸序列信息,体外合成末端带有XhoI 和XbaI 酶切位点的目标片段序列。目的片段由金开瑞生物科技有限公司合成。
1.6 MEG3 外源表达载体构建
将MEG3 ORF 区的体外合成片段与pcDNA3.1-HisB 空载质粒分别用限制性核酸内切酶XhoI 和XbaI 进行双酶切处理(酶切体系见表2),37 ℃水浴20 min。酶切产物利用DNA 产物纯化试剂盒进行纯化回收。调整纯化后的目的片段与空载质粒pcDNA3.1-HisB 的比例为质粒∶目的片段=1∶3,利用T4 连接酶进行连接,反应条件为22 ℃2 h,4 ℃过夜。随后将连接产物按照1∶10 的比例加入预先解冻的感受态细胞中进行转化。将转化后的细菌在37 ℃摇床中复活1 h。随后铺30 uL 于Amp 平板上,37 ℃恒温培养10~12 h。挑取单克隆菌落接种于5 mL含有氨苄青霉素(1∶1 000)的液体培养基中振荡培养,筛选阳性转化子,将验证正确的阳性转化子送至上海生工生物工程有限公司测序,测序引物为F:CGCAAATGGGCGGTAGGCGTG;R:TAGAAGGCAC AGTCGAGG。利用DNA MAN 软件进行序列比对分析,测序结果正确的菌液进行质粒抽提,获得pcDNA3.1-HisB-MEG3 的体外表达载体。

表2 DNA/pcDNA3.1-HisB 酶切体系
1.7 目标微肽体外表达
1.7.1 细胞培养 本研究使用293T 细胞系进行MEG3 的体外表达,使用BSMSCs 进行RNA 水平的定量检测。
细胞复苏:取出实验室冻存的细胞,37 ℃水浴1~2 min 迅速解冻复苏,加入1 mL 完全培养基(20%FBS+DMEM),离心后弃上清,加入3 mL 完全培养基重悬细胞,转入60 mm 培养皿中,在37 ℃、5%CO培养箱中培养,观察细胞数量及生长情况。
细胞传代:当细胞生长至汇合率达到80%~90%时对细胞进行传代。弃培养基,加入1 mL 胰酶,37 ℃静置消化2 min,加入1 mL 完全培养基中和胰酶,轻吹重悬细胞,吸取细胞悬液离心,弃上清,加入完全培养基重悬细胞,按照适当比例接种于细胞培养板中。持续观察细胞状态。
1.7.2 细胞转染 待293T 细胞融合度达到80%,依据Lipofectamine 3000 转染试剂的说明书要求转染pcDNA3.1-HisB-MEG3 质粒和对照组pcDNA3.1-HisB 空质粒(NC)。每组试剂设3 个生物学重复。
使用opti-MEM 培养基稀释lipofectamine 3000、P3000 和载体质粒。293T 细胞由无抗培养基培养。12 孔板1 孔配置方法A:62.5 μL opti-MEM+3.75 μL lip 3000;B:62.5 μL opti-MEM +2.5 μL P3000+cDNA3.1-HisB-MEG3/pcDNA3.1-HisB 空质粒(NC),加入1 250 ng 质粒。将上述试剂室温孵育5 min,随后A、B 两管中试剂混合均匀再次孵育10 min。加入到293T 细胞培养皿中轻晃摇匀。转染6 h 后更换为有抗培养基,转染后24 h 分别收集细胞mRNA 和蛋白样品,进行后续分析。
1.8 目标微肽验证与鉴定
1.8.1 细胞总RNA 提取及外源微肽mRNA 表达鉴定 采用RNA 快速提取试剂盒分别抽提上述转染了pcDNA3.1-HisB-MEG3 质粒和对照组pcDNA3.1-HisB 空质粒的293T 细胞(24 孔板中培养)的总RNA,按照HiFiScript cDNA Synthesis Kit 说明书进行cDNA 的合成,反转录体系见表3。反应程序为:42 ℃15 min,85 ℃5 min。

表3 反转录体系
以GAPDH 为内参,利用实时荧光定量PCR(qRT-PCR)检测MEG3 融合蛋白的mRNA 表达情况。引物序列F:ATGTTTTTCCCAAACAGGTTGGTC;R:TTATTGGAGCTCGGAGACGG。每组试验设置3个生物学重复。
1.8.2 细胞总蛋白提取及Western blot 分析 利用RIPA 蛋白裂解液裂解并收集分别转染pcDNA3.1-HisB-MEG3 质粒及pcDNA3.1-HisB 空质粒(NC)的293T 细胞的总蛋白样品。将含有外源表达蛋白的细胞总蛋白通过12%SDS-PAGE 凝胶进行电泳分离,随后300 mA 转膜2 h。用5%脱脂奶粉封闭液室温封闭PVDF 膜2 h,根据目标蛋白分子量大小剪取PVDF 膜,并用适当一抗(anti-His 抗体/DAPDH抗体)4 ℃孵育过夜,TBST 洗膜后用荧光标记二抗(Secondary Antibodies-Goat Anti-Rabbit Mouse IgGHRP)室温孵育1 h。按照1∶1 的比例配置ECL 超敏发光液,并在超敏电泳凝胶成像分析系统下拍照保存。分析目的蛋白表达情况。
1.9 统计分析
对qRT-PCR 结果进行t 检验分析,按2Ct 计算,GAPDH 基因作为内参对检测的目的基因进行归一化处理。“ *”表示差异显著(P<0.05),“ **”表示差异极显著(P<0.01)。
2 结果与分析
2.1 pcDNA3.1-HisB-MEG3 表达载体构建及鉴定结果
在前期研究中,笔者团队发现lncRNA MEG3 可能具有编码潜能,能编码产生微肽,为验证这一结果,笔者利用前期的微肽组学结果和生物信息学手段,分析获得了lncRNA MEG3 可能的ORF 区,该ORF 区长度为555 bp,可能编码产生长度为185 aa的微肽(图2)。因此,笔者人工合成了末端带有XhoI、XbaI 酶切位点的lncRNA MEG3 的ORF 区序列(图3),为了方便后续试验,笔者在起始密码子后同时添加了6×His 以及3×Flag 小分子标签,再将其连入带有His 蛋白表达标签的pcDNA3.1-HisB 质粒中,以增加检测的敏感性。由图4 可知,本研究选择pcDNA3.1-HisB 空载质粒作为载体,经过XhoI、XbaI 双酶切,可将目的片段连接在空载质粒pcDNA3.1-HisB 上,从而在细胞中表达MEG3 蛋白。质粒中含有T7 启动子,可大量转录表达目标蛋白,6×His 标签位于目的基因MEG3 的上游,经过PCR扩增获得了全长6 167 bp 的pcDNA3.1-HisB-MEG3融合载体。

图2 目的片段核苷酸序列

图3 MEG3 的ORF 区序列

图4 pcDNA3.1-HisB-MEG3 重组质粒图谱
为验证pcDNA3.1-HisB-MEG3 融合载体序列的正确性,利用XhoI、XbaI 限制性内切酶进行质粒双酶切,对酶切产物及重组质粒进行凝胶电泳,如图5 所示,泳道1 是经过双酶切的重组质粒,在该泳道中形成一个长度为644 bp 的带有目的片段的条带以及一个长度为5 523 bp 的不含目的基因的条带,2 个条带的长度均符合要求。由此可以初步判断,pcDNA3.1-HisB-MEG3 表达载体构建成功。同时,设计lncRNA MEG3 ORF 区序列的特异性引物,对pcDNA3.1-HisB-MEG3 的融合载体进行PCR 扩增及测序分析,测序结果如图6 所示,序列完全匹配,说明pcDNA3.1-HisB-MEG3 表达载体构建成功。

图5 pcDNA3.1-HisB-MEG 重组质粒双酶切结果

图6 pcDNA3.1-HisB-MEG3 测序结果
2.2 细胞中pcDNA3.1-HisB-MEG3 mRNA 的表达检测
为了进一步验证pcDNA3.1-HisB-MEG3 在BSMSCs 中的过表达情况,于BSMSCs 细胞分别转染pcDNA3.1-HisB 空载体(NC)和pcDNA3.1-HisBMEG3 表达载体24 h 后,提 取BSMSCs 增殖期总RNA,检测与对照组相比pcDNA3.1-HisB-MEG3 表达水平的变化。如图7 所示,外源转入的pcDNA3.1-HisB-MEG3 在BSMSCs 细胞中其mRNA 表达量比NC 对照组高约23 倍,差异极显著。因此,可以初步判断在牛骨骼肌卫星细胞中 pcDNA3.1-HisB-MEG3 重组载体mRNA 可以正常表达。
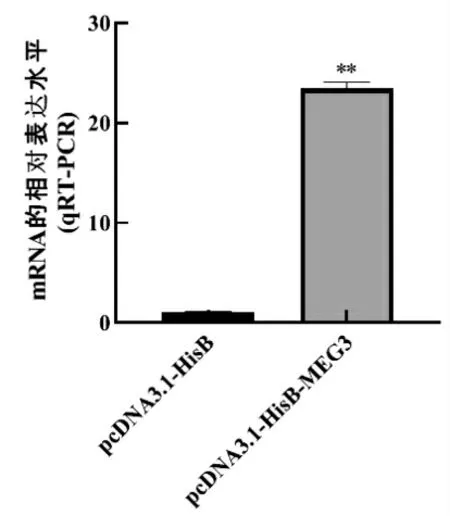
图7 MEG3 mRNA 表达检测结果
2.3 考马斯亮蓝定性检测蛋白的表达情况
本研究验证了pcDNA3.1-HisB-MEG3 在293T细胞中的mRNA 表达水平后,利用考马斯亮蓝染色对pcDNA3.1-HisB-MEG3 编码的微肽在蛋白水平的表达进行了初步检测。前期预测出MEG3 ORF 序列编码一个185 aa 的微肽,将其连入pcDNA3.1-HisB 载体后其编码的微肽-His 标签融合蛋白的大小约为17 kDa。考染结果如图8 所示,带有目的基因MEG3 的重组质粒转染293T 细胞后,在25~35 kDa 处(图中方框处)具有明显的蛋白条带,而NC组无明显条带,这说明pcDNA3.1-HisB-MEG3 在293T 细胞中表达了融合蛋白产物,证明其能在蛋白水平进行表达。

图8 293T 细胞中考马斯亮蓝染色定性检测MEG3 的蛋白表达水平
2.4 Western blot 试验结果
为进一步验证MEG3 微肽融合蛋白的外源表达,利用His 标签蛋白的特异性His 抗体进行了Western blotting 分析。结果如图9 所示,His 抗体孵育后,在pcDNA3.1-HisB-MEG3 转染组检测到明显的特异性条带,而NC 对照组没有检测到条带,说明本研究构建的pcDNA3.1-HisB-MEG3 在293T 细胞中融合蛋白成功表达。

图9 293T 细胞中Western blot 检测MEG3 的蛋白表达水平变化
3 结论与讨论
IncRNA 是一类转录本长度超过200 个核苷酸的RNA 分子,是转录组的主要组成部分,它正在成为调控发育进程中的核心参与者。同时,生物体基因组可以转录产生数目巨大、形式各异和功能不同的lncRNA 分子。已有研究结果表明,转录lncRNA分子的基因来源于生物体基因组上的许多区域,并且多数lncRNA 分子序列上都含有小的、未被注释过的开放阅读框序列。越来越多的研究表明这些缺少蛋白编码潜能的lncRNA 分子可以翻译成为多肽分子并参与相关的生命活动。
胡艳妹等研究发现,MEG3 在胰岛β 细胞高表达,具有组织特异性。干扰MEG3 后,小鼠葡萄糖耐受能力受损,血清胰岛素水平降低,胰岛素合成能力下降。初步证实,MEG3 可以通过参与胰岛素的合成和分泌来维持成年小鼠胰岛功能,进一步丰富和完善了胰岛发育和功能维持的基因调控网络。程宁等研究发现,MEG3 可促进白细胞介素1β 诱导的大鼠椎间盘髓核细胞增殖并抑制细胞凋亡,揭示了MEG3 对大鼠椎间盘髓核细胞增殖及凋亡的分子机制起着决定性作用,进一步奠定了MEG3 的研究基础。
在骨分化和形成方面,有研究表明,MEG3 的表达上调能抑制骨的自噬,从而抑制成骨分化和骨形成代谢。同时,还有不少研究表明,在牛骨骼肌卫星细胞中lncRNA MEG3 能够促进牛原代骨骼肌卫星细胞分化。在对动物生长发育性状的研究方面,通过剖析4 个绵羊品种的MEG3 基因的不同基因型和单倍型对生长发育的影响表明,MEG3 基因的不同基因型和单倍型在滩羊的体高、体长和胸围性状上存在显著差异,说明MEG3 对于绵羊生长发育性状有影响。
除了在动物上的研究和试验,在人类医学以及各种疾病的研究中,大量研究结果表明,MEG3 在预测宫颈癌患者肿瘤大小和淋巴结转移方面具有足够的敏感性和特异性,MEG3 在调节细胞增殖和凋亡基础上与宫颈癌的进展有关。因此,MEG3 可能是宫颈癌的一个潜在诊断工具和预后标志物。同时,MEG3 甲基化不仅是宫颈癌的危险因素,也是HR-HPV 感染和淋巴结转移的危险因素。更多研究表明,MEG3 在多种癌症中丢失,包括胶质瘤、脑膜瘤、胃癌和膀胱癌。因此,无论是在农业科学还是人类科学方面,MEG3 都有着巨大的研究价值。
为了后续在lncRNA 中针对MEG3 基因展开相关研究,本试验成功构建MEG3 的融合蛋白载体pcDNA3.1-HisB-MEG3,并能够在外源的293T 细胞中正常表达,为判断MEG3 对肿瘤和癌症及其他疾病中潜在作用的研究夯实理论基础,同时也说明lncRNA MEG3 在骨骼肌的生长发育中起着重要作用,有利于揭示部分非编码RNA 也具有编码潜能这一重要论题。
