植物蛋白饮料中榛子成分环介导等温扩增(LAMP)快速检测方法的建立
2022-09-02肖剑梁美丹冼燕萍刘冬豪劳嘉倩曹霞飞黄志深李丽丽
肖剑,梁美丹,冼燕萍,刘冬豪,劳嘉倩,曹霞飞,黄志深,李丽丽
(1.广州市食品检验所,广东广州 511400)(2.广州质量监督检测研究院,广东广州 511447) (3.暨南大学食品安全与营养研究院,广东广州 511443)
榛子,又称榛栗,山板栗等,有“坚果之王”的美誉,由于其富含蛋白质、脂肪、胡萝卜素、维生素、微量元素等,具有较高的营养价值而被越来越多应用到食品生产中,尤其是以榛子为原料的植物蛋白饮料,凭借其“天然、绿色、营养、健康”等特点,深受广大消费者的喜爱[1,2]。当前,我国整个植物蛋白饮料产业发展迅速,2007~2016年增速甚至已达24.5%,且在不断上升趋势,产品类型复杂多样,主要类型包括有豆乳类饮料、坚果类乳饮料、椰子乳饮料等[3]。榛子乳属于坚果类乳饮料的一种,近年来发展迅猛,但由于原材料成本较高,部分不法商家为谋求私利,采用低廉的大豆或花生等原材料伪造榛子乳饮料,并以低价的优势争抢市场,这种欺诈行为严重损害消费者的权益,破坏饮料市场行业的秩序[4]。目前,国内外对植物蛋白饮料成分检测的方法主要有高效液相色谱法(HPLC)[5,6]、酶联免疫法[7,8],普通PCR法[9,10]、实时荧光PCR法[11]和数字PCR法[12],但现有方法由于对操作要求(人员、环境、仪器设备、检测试剂)高、仪器设备高昂、检测成本高等缺点未广泛推广应用于基层检测。
以DNA为目标的源性成分鉴定是当今食品掺杂掺假研究较热门的技术之一,其具有灵敏度高、特异性强等优点。环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)[13],具有特异性强、灵敏度高、操作简单快速、实验设施要求低等优点[14],可应用于实验室外的快速高通量检测。该技术已广泛应用在致病菌和病毒检测[15-19]、转基因成分分析[20,21]、动物源性成分鉴定[22-24]、寄生虫鉴定[25]等领域中。本研究基于环介导等温技术,选择榛子特异性保守基因序列,设计一组LAMP特异性检测引物,研究LAMP的检测体系,建立植物蛋白饮料榛子成分快速检测方法,为抵制榛子蛋白饮料掺杂掺假提供高效的检测技术方法,保障饮料行业食品质量与安全。
1 材料与方法
1.1 材料与试剂
1.1.1 样本来源
榛子、板栗、芝麻、杏仁、核桃、花生、玉米、椰子、绿豆、黄大豆、黑大豆、红豆、糯米、小米、荞麦、燕麦、葵花籽、开心果、腰果、碧根果、松子、巴旦木、莲子、无花果、夏威夷果、红香米、黑香米、薏米、白眉豆、红腰豆、赤小豆、西瓜籽、红枣33种植物成分购于本地超市;32种植物蛋白饮料(标签声称含有榛子成分的有4个)购于京东超市。
1.1.2 主要试剂
DNA提取试剂盒,德国QIAGEN公司;BstDNA聚合酶、反应预混液(主要含dNTPs,MgSO4,甜菜碱等)、密封液、SYTO-9荧光染料,广州市双螺旋生物有限公司;引物由北京六合华大基因生物公司合成。
1.2 仪器与设备
II级A2型1376生物安全、NANODROP ONE超微量紫外分光光度计,购于美国Thermo Fisher Scientific公司;1-14K高速冷冻离心机,购于德国Sigma-aldrich公司;CFX96 Touch实时荧光PCR仪,购于美国Bio-Rad公司;HDTC-100恒温金属浴,购于上海汉诺仪器有限公司;微量移液器,购于德国Eppendorf公司。
1.3 实验方法
1.3.1 引物设计与合成
根据NCBI数据库中欧洲榛子染色体Ca8(登录号:LR899430.1)基因序列,通过Blast比对分析,确定该序列的特异性区域(第19517533~19519500 bp),使用软件 Primer Explorer Version 4(http://primerexplorer.jp/e/)设计LAMP引物5条,包括2条外引物F3、B3,2条内引物FIP(F1c+F2)、BIP(B1c+B2),1条环引物,引物序列设计位置见图1,引物序列见表1,引物由北京六合一华大基因公司合成,纯化方式为高效液相色谱法(HPLC)。
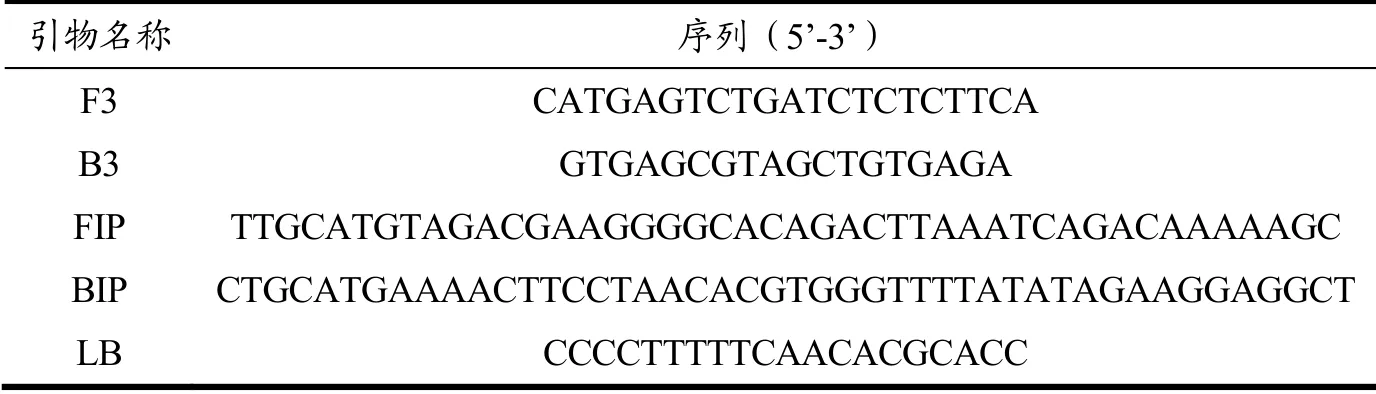
表1 引物序列 Table 1 Primer sequences
1.3.2 DNA模板的制备
坚果类、豆类、粮食种子等样品先用研磨机研磨成粉末,然后称取适量样品在液氮条件下进一步研磨,参考QIAGEN植物DNA提取试剂盒进行坚果类、豆类、粮食种子基因组DNA的提取。植物蛋白饮料样品,取样0.5 mL,按照磁珠法提取基因组DNA[26]。所有材料基因组DNA的OD260/OD280均在1.7~2.0之间,符合要求的DNA于-20 ℃保存备用。
1.3.3 LAMP反应体系的构建
LAMP反应体系(25 μL):反应预混液12.5 μL,BstDNA聚合酶1 μL,荧光染料0.5 μL,FIP 1.6 μmol/L,BIP 1.6 μmol/L,F3 0.2 μmol/L,B3 0.2 μmol/L,LB 0.8 μmol/L,DNA 2 μL,补水至25 μL,每个PCR反应管加入20 μL无菌石蜡油进行密封。每次反应以ddH2O和空白提取对照为阴性对照,以榛子DNA为阳性对照。使用实时荧光PCR仪进行LAMP恒温扩增,设置程序为63 30 s℃ ,(63 15 s℃ , 63 45 s℃ )45个循环。
1.3.4 榛子成分LAMP特异性检测
按照1.3.3建立的LAMP反应体系,以榛子DNA为阳性对照,以ddH2O和空白提取对照为阴性对照,以榛子、芝麻、杏仁、核桃、花生、玉米、椰子、绿豆、黄大豆、黑大豆、红豆、糯米、小米、荞麦、燕麦、葵花籽、开心果、腰果、板栗、碧根果、松子、巴旦木、莲子、无花果、夏威夷果、红香米、黑香米、薏米、白眉豆、红腰豆、赤小豆、西瓜籽、红枣32种植物成分作为特异性实验模板,用于验证该方法的特异性。
1.3.5 榛子成分LAMP引物灵敏度实验
以绿豆粉为基质,按比例制备不同质量分数的榛子混合样品(50.0%、10.0%、5.0%、0.5%、0.1%),提取DNA,同时将质量分数为0.1%的榛子样品DNA稀释10倍,获得质量分数为0.01%榛子样品DNA,按照1.2.3反应体系及程序进行扩增,确定该方法的灵敏度。
1.3.6 榛子成分LAMP稳定性实验
以榛子最低检出限的样品DNA进行LAMP扩增,重复10次实验,同时以以ddH2O和空白提取对照为阴性对照,以验证该方法的稳定性。
1.3.7 LAMP检测植物蛋白饮料中榛子成分
对市场上销售的32种植物蛋白饮料进行检测,验证本研究建立的LAMP检测方法,并以实时荧光PCR方法为参考比较方法[27],综合评价植物蛋白饮料中榛子成分LAMP检测方法的灵敏度、特异性、假阴性率、假阳性率和准确度;根据方法确认性能指标要求[28]:灵敏度≥98.0%,特异性≥90.4%,假阴性率≥2.0%,假阳性率≥9.6%,准确度≥94.0%。
1.3.8 数据处理
1.3.8.1 灵敏度、特异性、假阴性率、假阳性率和准确度的计算
式中:
真阳性数——测试方法和参比方法均为阳性的数量;
真阴性数——测试方法和参比方法均为阴性的数量;
假阳性数——测试方法为阳性、参比方法为阴性的数量;
假阴性数——测试方法为阴性、参比方法为阳性的数量。
1.3.8.2 稳定性测试Ct值相对标准偏差(RSD)
2 结果与分析
2.1 榛子成分LAMP扩增特异性检测结果
本研究采用33种不同的植物种子,按照设计的LAMP引物和构建的反应体系,在63 ℃温度条件下进行榛子成分LAMP恒温扩增,检测结果见图2。结果表明榛子样品DNA能扩增出明显的S型曲线,表现出良好的特异性扩增,其余32种植物包括绿豆、黄大豆等杂豆类,杏仁核桃等干果类,糯米、小米等粮食作物及其他成分的DNA均未得到任何扩增产物。孙敏等[2]对10种不含榛子食品,采用实时荧光PCR方法检测榛子成分,获得较好的特异性,本研究使用32种包含各种类别植物成分进行特异性研究,能充分证实建立的LAMP检测方法对榛子具有高度的特异性。
2.2 榛子成分LAMP扩增灵敏度实验
选取一定质量的榛子粉与绿豆粉进行相应比例混合,分别制备成质量分数为50.0%、10.0%、5.0%、0.5%、0.1%的榛子混合样品,按照试剂盒法提取DNA,由于难以获得质量分数0.01%的榛子混合样品,将0.1%混合样品DNA稀释10倍,作为质量分数为0.01%的榛子混合样品,将以上样品提取DNA,并进行LAMP扩增,扩增图谱见图3。结果显示,质量分数为50.0%、10.0%、1.0%、0.5%、0.1%的榛子混合样品DNA能扩增得到典型的S型曲线,质量分数为0.01%的榛子DNA扩增结果为阴性,因此,该方法的检测灵敏度可定为0.1%(以质量分数计)。魏晓璐等[9]建立检测核桃乳中花生、大豆成分PCR检测方法,结果检测花生成分的灵敏度为1%、检测大豆成分的灵敏度为0.1%;刘津等[29]建立的巴西坚果的LAMP检测方法检测低限为0.5%,本研究方法检测灵敏度达到或优于现有同类方法。另外,本研究选择以质量份数进行灵敏度的测试,与DNA浓度[2]或拷贝数[30]相比,更加准确反映样品中实际成分含量;相对于直接对DNA进行稀释,方法考虑了DNA提取质量影响,且更能直接反映出对应的产品中成分的含量,但实际固体样品混合有一定的操作极限,本研究选择对0.1%混合样本提取DNA进行稀释,更加准确可靠。
2.3 榛子成分LAMP扩增稳定性实验
本方法选择质量分数为0.1%榛子混合样品提取DNA,以此模板DNA进行10次重复LAMP扩增,结果见图4,结果Ct值在18.00~21.14范围(RSD=5.41%),Ct值是PCR定性检测判断阴阳性结果的标识值,较低的RSD值说明该方法稳定性较好,对于PCR定量检测,一般使用拷贝数进行稳定性评价,本研究方法RSD值与杨硕等[12]建立的微滴PCR方法得出的大豆和核桃拷贝数比值的相对标准偏差(RSD=3.86%)比较接近,都属于较高的水平。
2.4 植物蛋白饮料样本检测
LAMP技术主要是利用具有链置换特异性的BstDNA聚合酶和4条能够特异性识别靶标序列上多个特异性区域的引物,开启循环链置换反应,从而实现等温条件下的连续快速反应[31],该技术具有特异性强、灵敏度高、检测成本低等优点。Real-time PCR技术是在常规PCR的基础上添加荧光染料或荧光探针,具有操作简便,可实现对待测样品定性、定量分析[32],但是该技术需要的仪器设备较昂贵。本研究选择32个不同植物蛋白种类饮料产品验证LAMP扩增方法,同时以Real-time PCR[27]为参照方法,计算LAMP扩增方法的灵敏度、特异性、假阳性和假阴性。结果见表2。采用本研究的LAMP方法检测榛子成分,4个标签含有榛子成分的样品检测结果均为阳性,并以Real-time PCR检测方法为参照,两种方法的检测结果100%相符合。按照1.3.7统计方法,依据表3数据结果,得出本研究建立的植物蛋白饮料榛子成分LAMP扩增方法的灵敏度为100%,特异性为100%,假阳性率和假阴性率均为0。在相似研究中,刘津等[29]建立的巴西坚果的LAMP检测方法使用7个样本进行适用性方法验证,结果与实时荧光PCR方法完全一致,魏晓璐等[9]采用22种核桃乳作为建立检测方法的应用验证,但未使用参比方法进行验证。本研究采用多批次不同种类植物蛋白饮品进行方法比对验证,通过McNemar’s检验[27],得出方法验证的指标,结果均符合要求。
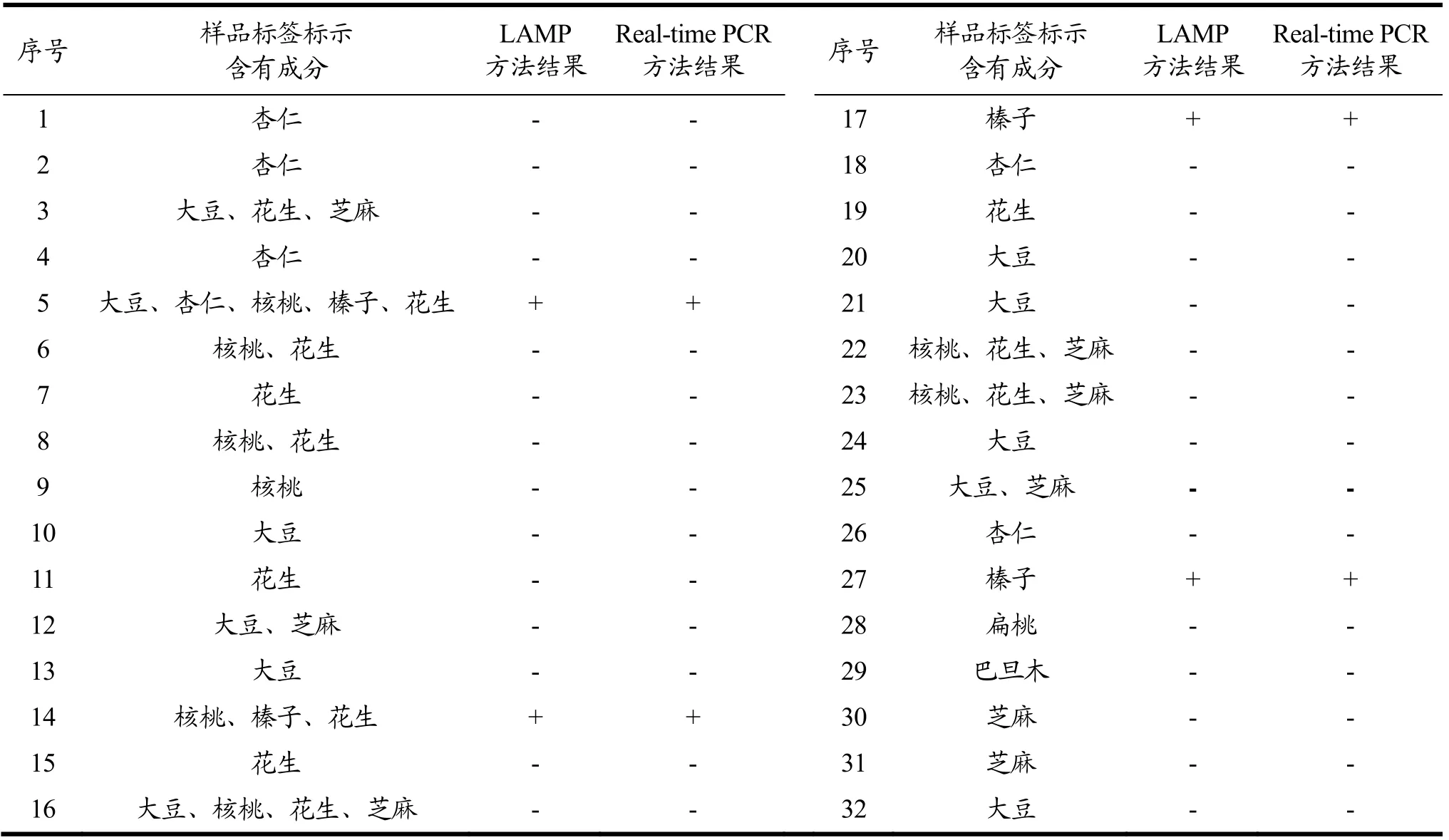
表2 LAMP和Real-time PCR检测32种植物蛋白饮料中榛子成分结果 Table 2 The test results of hazelnut components in 32 vegetable protein drinks by LAMP and Real-time PCR
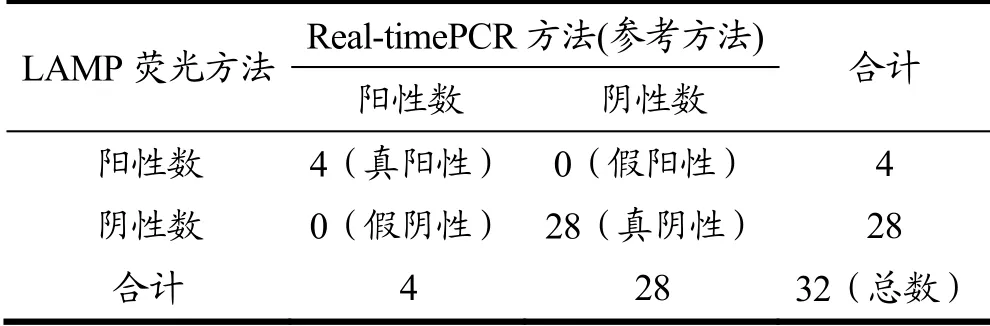
表3 LAMP和Real-time PCR检测植物蛋白饮料榛子成分数据统计分析结果 Table 3 The statistical analysis of hazelnut components in vegetable protein drinks by LAMP and Real-time PCR
3 结论
本文选择欧洲榛子染色体Ca8基因设计LAMP的特异性引物,构建优化LAMP反应体系,经过33种不同类别的植物源性成分特异性验证试验,除榛子DNA外,其他成分DNA未获得阳性结果,证实本方法具有较高的特异性。通过不同质量分数的榛子混合样品DNA扩增试验,验证了方法的灵敏度可达0.1%,同时,选择质量分数为0.1%榛子样品DNA,进行10次重复LAMP扩增,Ct值RSD为5.41%,证实本研究LAMP扩增稳定性较好。另外,以实时荧光PCR为参考方法,使用32个批次含多种不同源性成分多种类型的植物蛋白饮料做应用性验证,测试出本研究建立的LAMP方法灵敏度和特异性均为100%,无假阳性和假阴性,符合方法使用准确性要求,与其他方法相比,具有快速稳定、对仪器和操作要求较低的特点,从样品处理到最终结果可在2 h内完成,适用于在现场对不同基质植物蛋白饮品榛子成分的快速检测。该研究成果提供了一种植物蛋白饮料掺伪掺假快速筛查新型分子检测技术,为植物蛋白饮料行业良性发展保驾护航。
