基于UHPLC-Q-TOF-MS/MS的爬沙虫不同部位化学成分分析
2022-09-02刘海波冉俊枫任艳田余波吴发明毛羽苟琰司丹丹
刘海波,冉俊枫,任艳*,田余波,吴发明,毛羽,苟琰,司丹丹
(1.西南民族大学药学院 民族药物研究所,四川成都 610041)(2.遵义医科大学药学院,贵州遵义 563000) (3.四川省食品药品检验检测院,四川成都 611731)(4.SCIEX中国,北京 100015)
爬沙虫来源于广翅目巨齿蛉属Acanthacorydalis和部分大型齿蛉属Neoneuromus的老熟幼虫,主流物种之一为属模巨齿蛉Acanthacorydalis asiatica(Wood-Mason)。其营养价值高,是川西南、滇东北等地区传统的食、药两用滋补品[1,2],同时爬沙虫还是彝族、苗族、哈尼族、纳西族治疗小儿及老年人夜尿的特效民族药[1],具有温阳止溺、祛风湿等功效,用于小儿遗尿,老年人体虚夜尿,跌打损伤,风湿痹痛等症;现代研究表明,爬沙虫可明显降低水负荷多尿大鼠尿量,对肾阳虚大鼠肾脏具有明显保护作用,还能显著改善衰老大鼠的记忆力[3],具有较高的药用价值。
然而,目前对爬沙虫的化学成分研究极少,仅报道其富含多种氨基酸、脂肪、有机酸、多糖等[4],未见对其化学成分进行系统的分析,这直接制约了爬沙虫的深入研究与开发应用。调研表明,根据用途不同,爬沙虫使用部位有所差异,在云南景谷、四川攀西等地区有常将爬沙虫去头、胸后食用,入药则用全体,该食用或药用部位的选择方式尚缺乏科学依据[5,6],因此亟需对爬沙虫不同部位化学成分进行差异研究,为爬沙虫的物质基础研究及使用部位的选择提供依据。
UHPLC-Q-TOF-MS/MS技术具有灵敏度高、选择性好、分辨率高的特点,可有效提供化合物的结构信息,是目前国内外使用较为普遍的分析检测手段,被广泛应用于天然药物的成分分析与鉴定方面[7-10]。目前,针对液质联用识别出的化学成分,常以相对峰面积大小为相对含量指标确定不同样品的质量差异,鲜见用HPLC进行定量验证[11,12]。本研究基于UHPLC-Q-TOF-MS/MS技术对爬沙虫不同部位(头、胸、腹,见图1)化学成分进行定性鉴别,通过对照品、化合物精确分子质量和碎片信息及参考文献资料等手段鉴定化合物,利用多元统计分析筛选不同部位差异化合物,并进行含量测定,为其药效物质基础研究及药用部位的筛选提供依据。
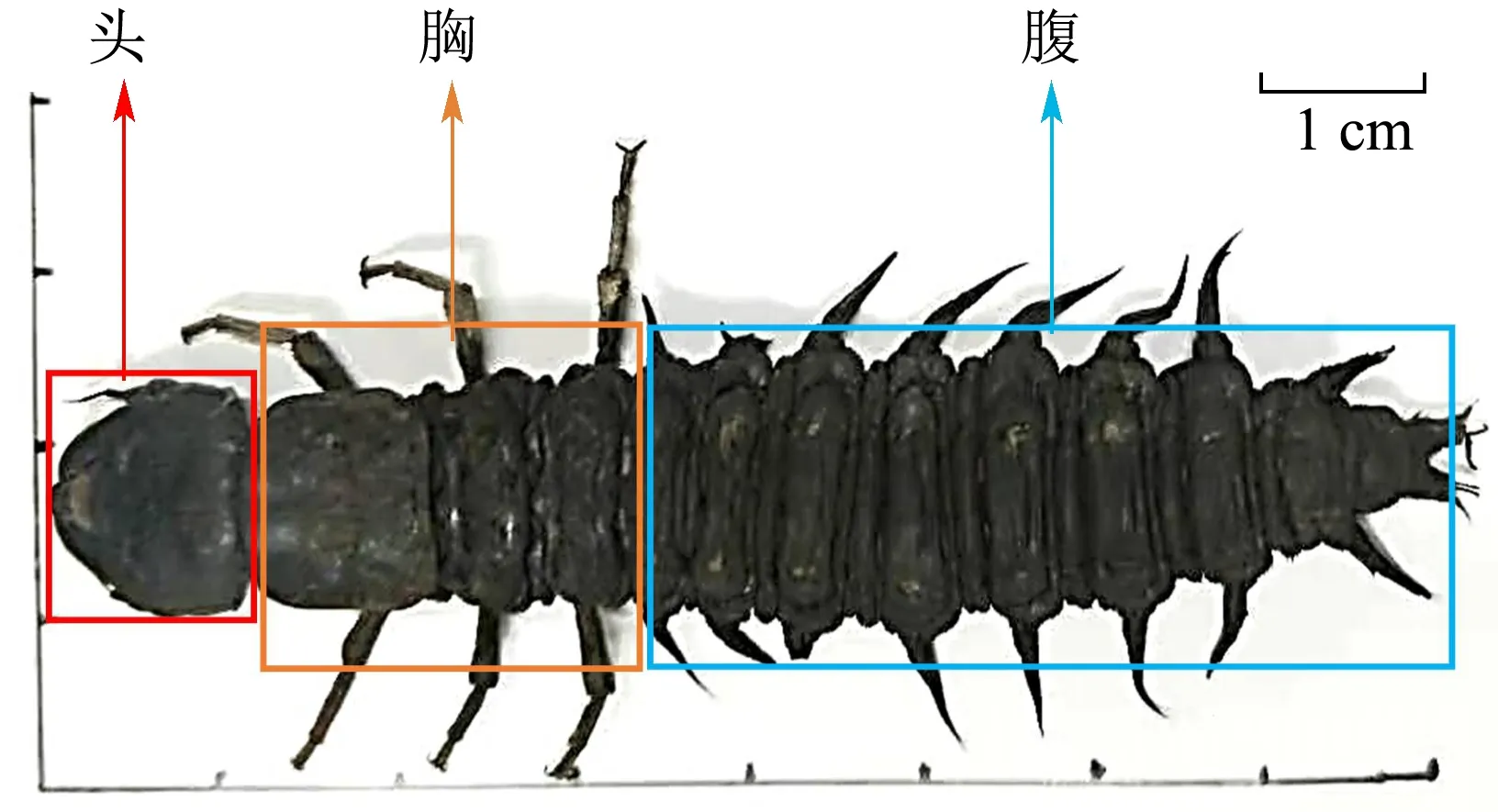
图1 爬沙虫不同部位示意图 Fig.1 The different parts of hellgrammites
1 材料与方法
1.1 材料
1.1.1 药材
爬沙虫采于云南西双版纳,经遵义医科大学药学院吴发明教授鉴定为属模巨齿蛉Acanthacorydalis asiatica(Wood-Mason)的干燥幼虫。
1.1.2 试剂
对照品D-山梨醇、苯丙氨酸、尿苷、烟酸、组氨酸、亚油酸、次黄嘌呤、缬氨酸、异亮氨酸、亮氨酸,成都克洛玛生物科技有限公司,批号分别为CHB190118、CHB180525、CHB180121、CHB180614、CHB181129、CHB180612、CHB180522、CHB180616、CHB180313、CHB190106;乙腈、甲酸、异硫氰酸苯酯均为色谱纯,其他试剂均为分析纯。
1.1.3 仪器与设备
LC-30A型超高效液相色谱仪,日本岛津公司;Triple TOF 6600型四极杆串联飞行时间高分辨质谱仪,美国SCIEX公司;Agilent 1260 Infinity液相色谱仪,美国Agilent公司;JY92-IID型超声波细胞粉碎机,宁波新艺超声设备有限公司;CPA225D型十万分之一分析天平,德国赛多利斯公司。
1.2 实验方法
1.2.1 UPLC-Q-TOF-MS/MS分析
1.2.1.1 爬沙虫供试品溶液的制备
分别取爬沙虫头、胸、腹干品适量,粉碎后过100目筛,精密称取1.0 g,置于100 mL试管中,加入75%乙醇50 mL,于超声波细胞破碎仪中超声处理30 min(功率600 W),取出,放冷,用75%乙醇定容至刻度,摇匀,0.22 μm微孔滤膜过滤,取续滤液,即得。
1.2.1.2 对照品溶液的制备
称取适量D-山梨醇、苯丙氨酸、尿苷、烟酸、组氨酸、亚油酸、次黄嘌呤对照品于10 mL容量瓶中,加入色谱甲醇定容至刻度,分别制备成质量浓度为1 mg/mL的对照品溶液,0.22 μm微孔滤膜过滤,取续滤液,即得。
1.2.1.3 色谱条件
质谱负离子模式色谱条件:色谱柱为 Waters acquity BEH amide柱(100 mm×2.1 mm,1.7 μm);流动相为25 mmol/L乙酸铵水溶液(A)-乙腈(B)洗脱梯度(0~2 min,95% B;2~18 min,95%~65% B;18~20 min,65%~40% B;20~22 min,40%~40% B;22~22.1 min,40%~95% B;22.1~30 min,95%~95% B),流速0.2 mL/min,柱温30 ℃,进样量1 μL。
质谱正离子模式色谱条件:色谱柱为 Waters acquity HSS T3柱(100 mm×2.1 mm,1.8 μm);流动相为0.1%甲酸水溶液(A)-乙腈(B),洗脱梯度:0~1.5 min,1% B;1.5~15 min,1%~99% B;15~20 min,99% B;20~21 min,99%~1% B;21~30 min,1% B;流速0.2 mL/min,柱温30 ℃,进样量1 μL。
1.2.1.4 质谱条件
电喷雾离子源(ESI),正、负离子模式,喷雾电压(IS)为+5500 V,-4500 V;雾化气压力(GS1)为55 psi;气帘气压力(CUR)为35 psi;辅助气压力(GS2)为55 psi;离子源温度(TEMP)为550 ℃;簇裂解电压(DP)为80 V;碰撞能量(CE)为35 V;碰撞能量滚动区间(CES)为15 V;检测模式为信息关联采集模式(IDA),多重质量亏损(MMDF)和动态背景扣除(DBS)为触发二级的条件,符合该条件优先进行二级扫描。
1.2.2 HPLC测定差异化合物含量
1.2.2.1 供试品溶液制备
用于烟酸、次黄嘌呤含量测定的供试品制备方法同1.2.1.1。
用于缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸含量测定的供试品制备方法:精密吸取1.2.1.1下供试品溶液1 mL,置5 mL量瓶中,加入0.1 mol/L异硫氰酸苯酯-乙腈溶液600 μL及1 mol/L三乙胺乙腈溶液600 μL,混匀,室温放置1 h后,加50%乙腈水至刻度,随后转移至10 mL的EP管中,加入正己烷5 mL,振荡,放置10 min,吸取下层溶液,用0.45 μm微孔滤膜滤过,取续滤液,即得。
1.2.2.2 对照品溶液的制备
烟酸、次黄嘌呤混合对照品溶液:精密称取烟酸10.95 mg,次黄嘌呤15.59 mg,加10%甲醇溶解并定容至100 mL,即得。
缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸混合对照品溶液:精密称取缬氨酸12.85 mg、异亮氨酸10.62 mg、亮氨酸12.24 mg、苯丙氨酸11.66 mg,加50%甲醇溶解并定容至25 mL,即得混合对照品储备溶液。精密吸取混合对照品储备溶液1 mL,置5 mL量瓶中,加入0.10 mol/L异硫氰酸苯酯-乙腈溶液600 μL及1 mol/L三乙胺乙腈溶液600 μL,混匀,室温放置1 h后,加50%乙腈水至刻度,随后转移至10 mL的EP管中,加入正己烷5 mL,振荡,放置10 min,吸取下层溶液,用0.45 μm微孔滤膜滤过,取续滤液,即得。
1.2.2.3 色谱条件
烟酸、次黄嘌呤含量测定:Agilent TC C18色谱柱(250 mm×4.6 mm,5 μm);柱温:30 ℃;检测波长:262 nm;流动相:A相为甲醇,B相为0.02 mol/L磷酸二氢钾溶液;梯度洗脱(0~5 min,99% B;5~15 min,98% B;流速:1 mL/min;进样量:10 μL。
缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸含量测定:Agilent TC C18色谱柱(250 mm×4.6 mm,5 μm);柱温:43 ℃;检测波长:254 nm;流动相:A相为0.10 mol/L醋酸钠(醋酸调pH至6.5)-乙腈(93:7),B相为乙腈-水(4:1),梯度洗脱(0~11 min,7% B;11~13 min,12% B;13~15 min,15% B;15~25 min,25% B;25~30 min,35% B;流速:1 mL/min;进样量:10 μL。
1.2.3 数据统计与分析
采用PeakView 2.0版本软件对质谱原始数据进行处理,SIMCA 14.1进行主成分分析(PCA)和正交偏最小二乘判别分析(OPLS-DA);采用SPSS 26.0统计分析试验数据,计算标准偏差,数据结果以平均值±标准偏差表示,并进行单因素方差分析,显著水平p为0.05。
2 结果与讨论
2.1 爬沙虫不同部位化学成分分析
采用UHPLC-Q-TOF MS/MS在上述“1.2.1.3”项液相色谱条件和“1.2.1.4”项质谱条件下对爬沙虫样品进行分析,获得爬沙虫不同部位的正、负离子模式全扫描总离子流图(TIC),见图2。将该数据导入PeakView 2.0软件,获得满足质量误差小于5×10-6,同位素分布正确的目标化合物,通过对照品比对、参考相关文献、数据库匹配分析及二级碎片裂解规律,从爬沙虫头、胸、腹供试品溶液中共鉴定出25个化合物(见表1),头、胸、腹分别鉴定出19、21、19个化合物,包括9种氨基酸类成分,6种有机酸类成分,5种核苷类成分,5个其他类成分。
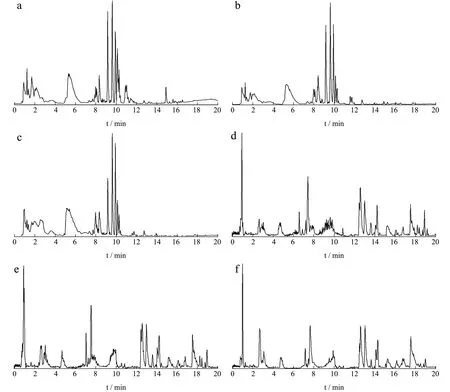
图2 爬沙虫不同部位总离子流图 Fig.2 The total ion chromatogram of different parts of hellgrammites
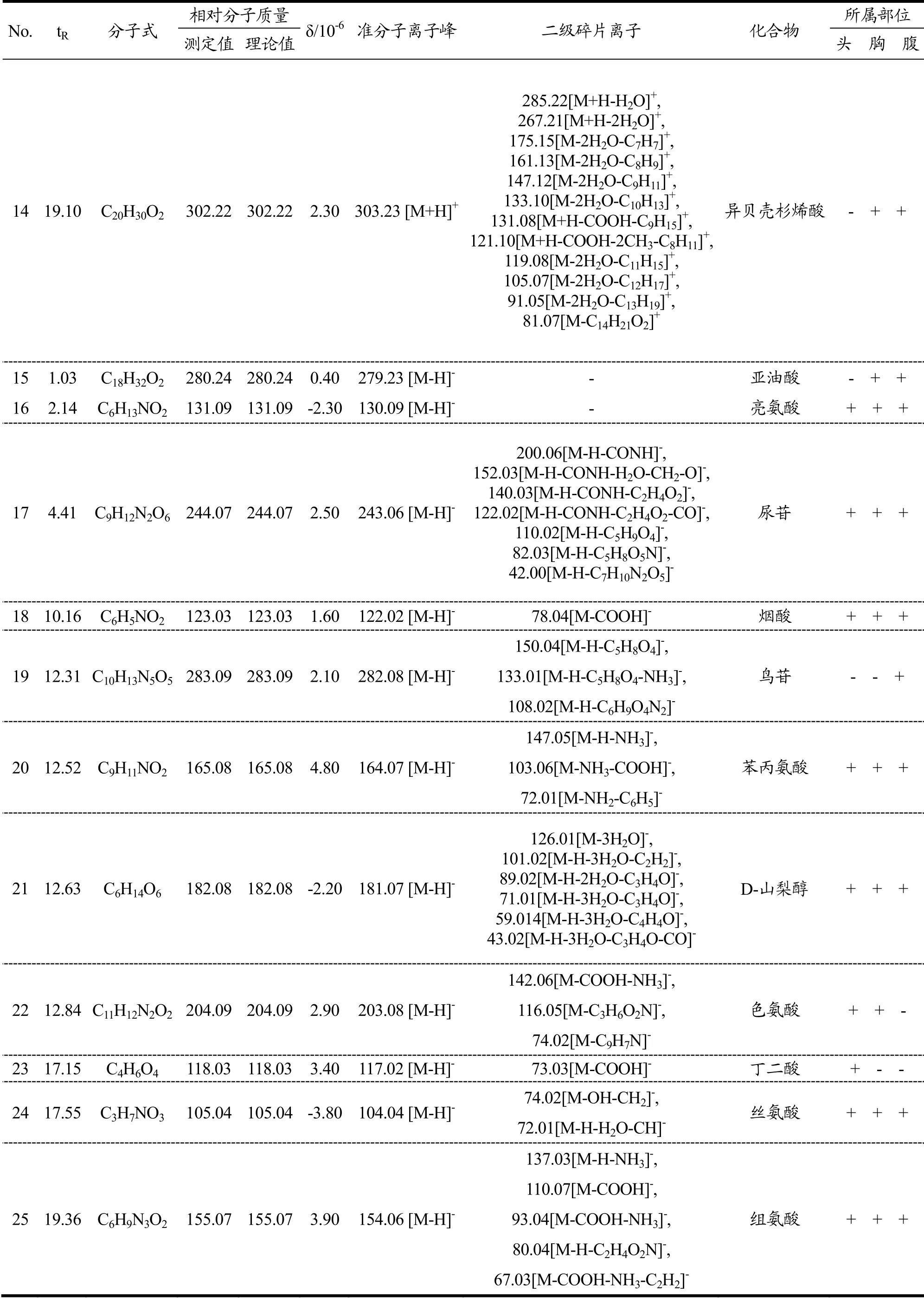
续表1
2.1.1 氨基酸类化合物的鉴定
在正、负离子模式下爬沙虫头、胸、腹中共检测到9种氨基酸,其中脯氨酸、谷氨酸、色氨酸为首次报道。以脯氨酸和苯丙氨酸为例,正离子模式下,保留时间为0.99 min,一级质谱获得m/z116.07 [M+H]+的质谱信号,二级质谱分别出现70.07,68.05质谱峰,根据数据库匹配出分子式为C5H9NO2,二级质谱图显示准分子离子峰丰度较低,易失去HCOOH形成稳定的70.07 [M+H-HCOOH]+碎片离子,也可失去OH-CH3N形成68.05 [M-OH-CH3N]+碎片离子,结合文献报道[13],推测该化合物为脯氨酸。负离子模式下,保留时间为12.52,一级质谱获得m/z164.07 [M-H]-的质谱信号,二级质谱出现147.05,103.06,72.01质谱峰,根据数据库匹配出分子式为C9H11NO2,主要的二级碎片离子为 147.05 [M-H-NH3]-,103.06 [M-NH3-COOH]-,72.01 [M-NH2-C6H5]-,经对照品比对,推断该化合物为苯丙氨酸,二级质谱及可能的裂解途径见图3。
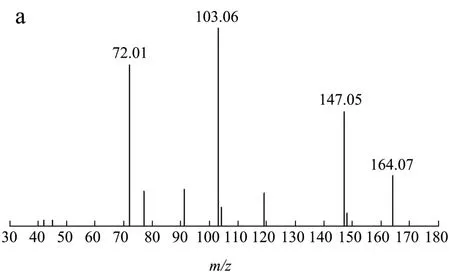
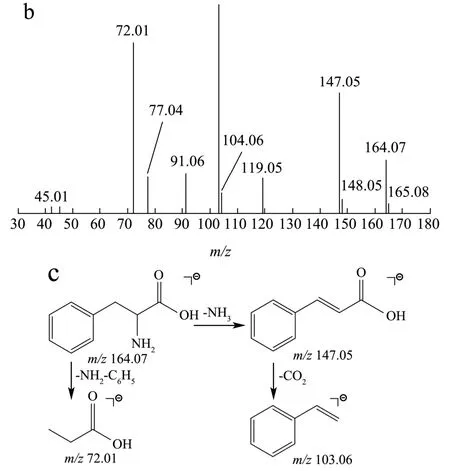
图3 苯丙氨酸的二级质谱图(a),对照品的二级质谱图(b)及其裂解规律(c) Fig.3 Secondary mass spectrogram of phenylalanine (a), secondary mass spectrogram of reference (b), mass spectrometric fragmentation pattern of phenylalanine (c)
2.1.2 有机酸类化合物的鉴定
在正、负离子模式下爬沙虫头、胸、腹中共检测到6种有机酸。以肉桂酸和烟酸为例,正离子模式下,保留时间为5.40 min,一级质谱获得m/z149.06 [M+H]+的质谱信号,二级质谱出现103.06,77.04质谱峰,根据数据库匹配出分子式为C9H8O2,主要二级碎片离子为103.06 [M+H-HCOOH]+,77.04 [M-CH2= CH-COOH]+,推测该化合物为肉桂酸,二级质谱及可能的裂解方式见图4。负离子模式下,保留时间为10.16 min,一级质谱获得m/z122.02 [M-H]-的质谱信号,二级质谱出现78.04质谱峰,根据数据库匹配出分子式为C6H5NO2,二级质谱图显示准分子离子峰丰度极低,易失去COOH形成稳定的78.04 [M-COOH]-碎片离子,经对照品比对,推断该化合物为烟酸。
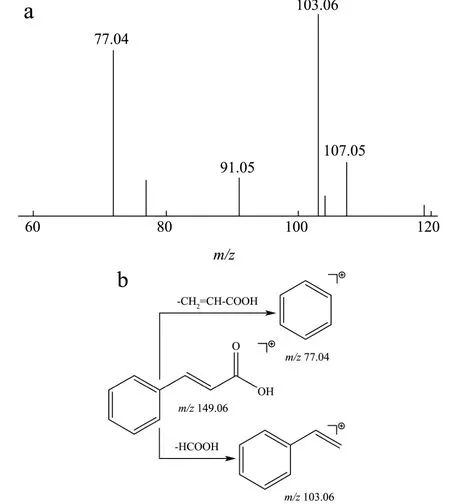
图4 肉桂酸的二级质谱图(a)及裂解规律(b) Fig.4 Secondary mass spectrogram of cinnamic acid (a) and mass spectrometric fragmentation pattern of cinnamic acid (b)
2.1.3 核苷类化合物的鉴定
在爬沙虫头、胸、腹中共检测到5种核苷类化合物。以次黄嘌呤和尿苷为例,正离子模式下,保留时间1.71 min,一级质谱获得m/z137.05 [M+H]+的质谱信号,二级质谱图显示准分子离子峰丰度较高,二级碎片m/z120.02,119.04,110.04为准分子离子分别失去1个NH3,H2O和HCN形成,与文献报道相符[14],故推断该化合物为次黄嘌呤,本实验发现,m/z110.04离子还可进一步在高能碰撞下失去一个CO形成m/z82.04子离子。负离子模式下,保留时间4.41 min,一级质谱获得m/z243.06 [M-H]-的质谱信号,二级质谱出现200.06 [M-H-CONH]-、152.03 [M-H-CONH-H2O-CH2-O]-、140.03 [M-H-CONH-C2H4O2]-、122.02 [M-H-CONH- C2H4O2-H2O]-、110.02 [M-H-C5H9O4]-、82.03 [M-H- C5H8O5N]-、42.00 [M-H-C7H10N2O4]-的碎片离子,根据数据库匹配出分子式为C9H12N2O6,经对照品比对,推测该化合物为尿苷,二级质谱及可能的裂解方式见图5。
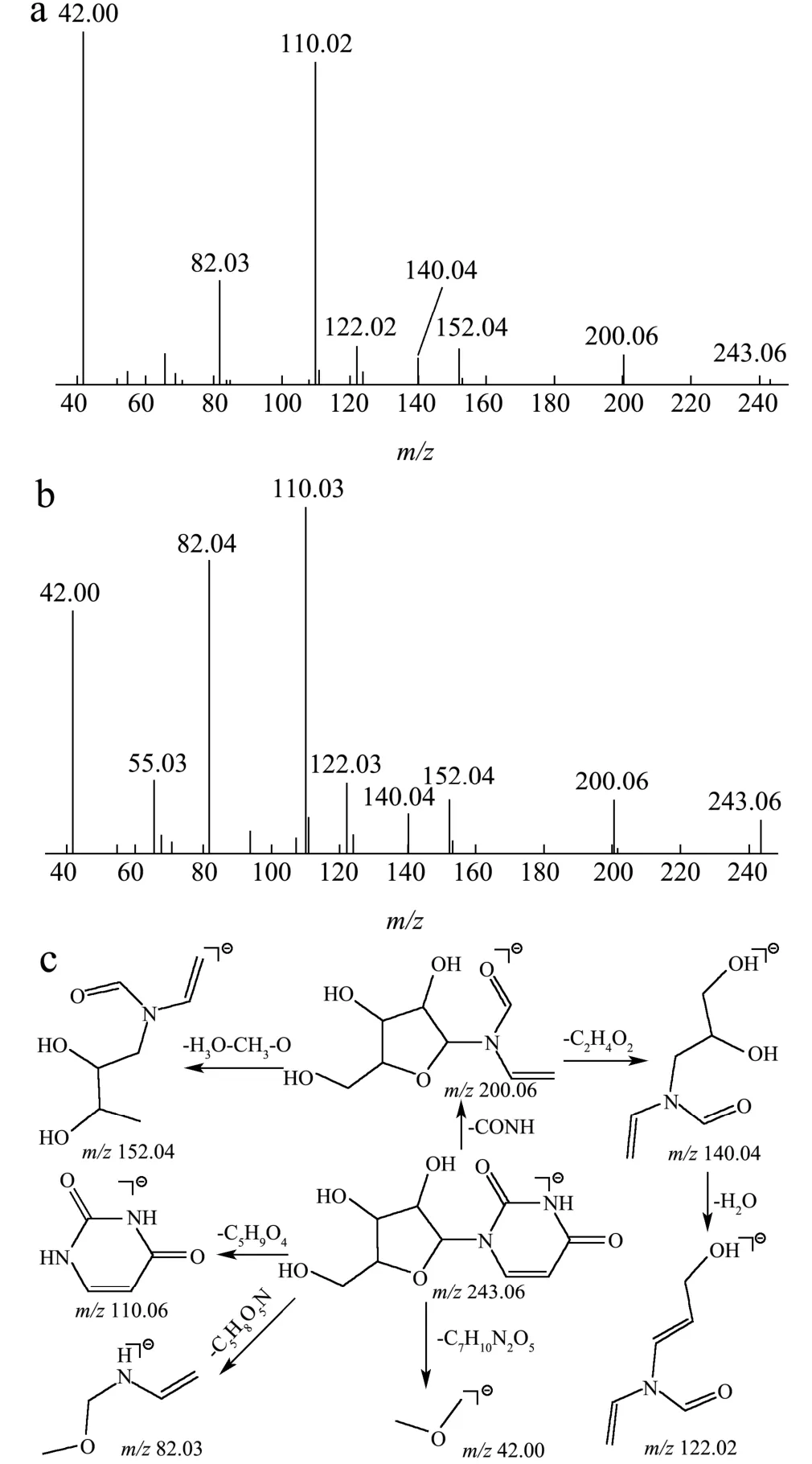
图5 尿苷的二级质谱图(a),对照品的二级质谱图(b)及其裂解规律(c) Fig.5 Secondary mass spectrogram of uridine (a), secondary mass spectrogram of reference (b), mass spectrometric fragmentation pattern of uridine (c)
2.1.4 其他类化合物的鉴定
结合数据库与相关文献及二级碎片离子信息,本研究从爬沙虫不同部位中推测可能还含有左旋肉碱、维生素b2、D-山梨醇、樟脑、胡薄荷酮。
2.2 多元统计分析
以2.1所鉴定的化合物的峰面积为变量导入SIMCA14.1软件中进行主成分分析,结果见图6。由图可见,爬沙虫不同部位可以较好的分离,说明爬沙虫头、胸、腹三个部位彼此之间的化学内涵存在较大差异。在PCA分析的基础上,利用OPLS-DA模型将爬沙虫不同部位样品进行两两比较,得到散点图,见图7(a、b、c);之后建立S-plot,以找出不同部位样品间差异化合物,见图7(d、e、f)。S-plot图中数据点离原点越远对样品分组差异的贡献值越大,结合变量权重重要性排序(VIP)进行筛选,条件为VIP>1,从爬沙虫不同部位中共筛选到缬氨酸,次黄嘌呤,烟酸,苯丙氨酸,异亮氨酸,亮氨酸6个差异最大的化合物。
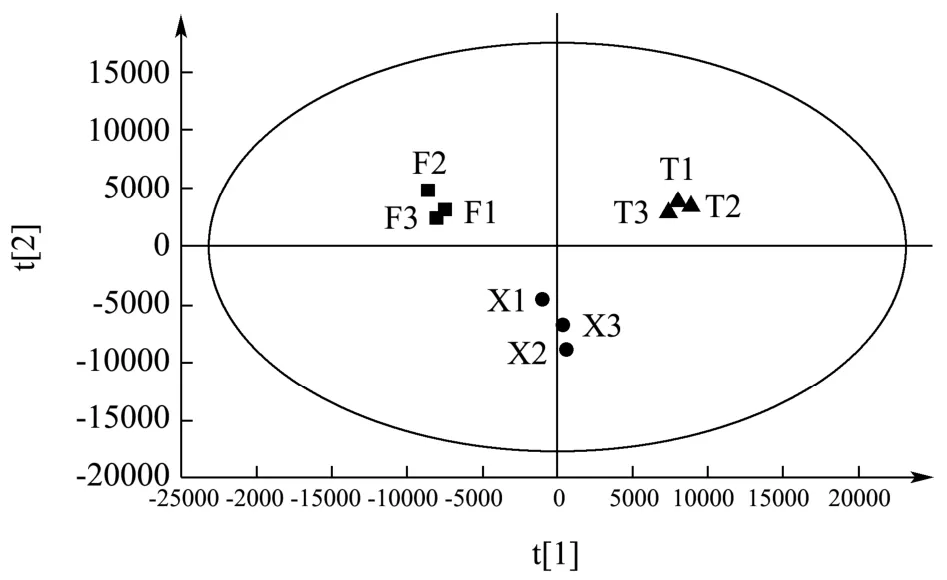
图6 爬沙虫不同部位的PCA图 Fig.6 PCA score plot of different parts of hellgrammites
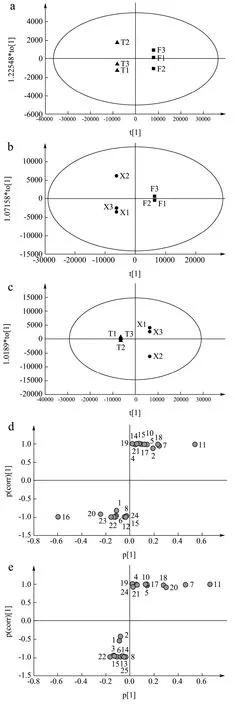
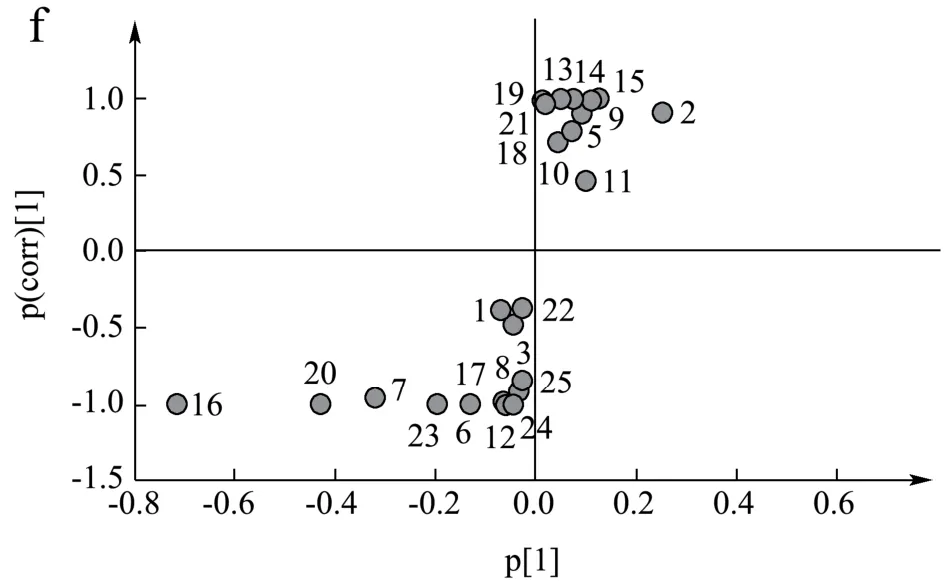
图7 爬沙虫不同部位的OPLS-DA图和S-plot图 Fig.7 OPLS-DA score plot and S-plot of different parts of hellgrammites
2.3 爬沙虫不同部位差异化合物含量的测定
取1.2.2.1项下供试品溶液,按1.2.2.3项下色谱条件进行测定,将峰面积代入回归方程,分别计算烟酸、次黄嘌呤、缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸含量,结果见表2。采用SPSS 26.0进行显著性差异分析,p<0.05认为6种成分在头、胸、腹三个部位之间均具有显著性差异。
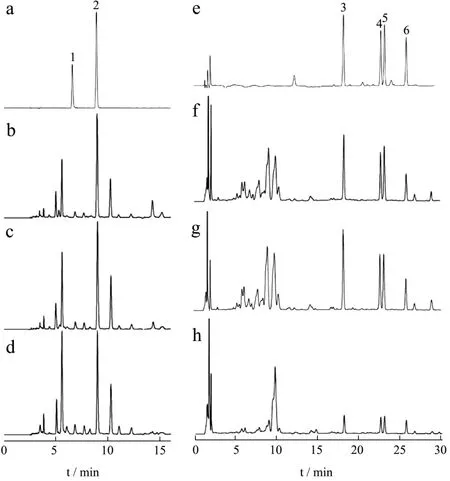
图8 混合对照品溶液和供试品溶液的HPLC图 Fig.8 HPLC chromatograms of mixed reference standard solution and sample

表2 爬沙虫不同部位差异化学成分含量测定(mg/g,n=3) Table 2 Content of 6 different chemicals in different parts of hellgrammites (mg/g, n=3)
2.4 分析与讨论
2.4.1 爬沙虫化学成分分布规律与物质基础分析
爬沙虫不同部位推断出25种成分,包括氨基酸类成分9种,有机酸类成分6种,核苷类成分5种,其他类成分5种。文献分析表明其中19个成分,包括3个氨基酸(脯氨酸、谷氨酸、色氨酸)、6个有机酸、5个核苷及5个其它化合物为爬沙虫中首次报道。由表1可知,在其头、胸、腹中分别鉴定出19、21、19种化合物,不同部位共有化合物14种(包括7种氨基酸类成分,2种有机酸类成分,2种核苷类成分,3种其它化合物)。爬沙虫不同部位共有成分较多,整体成分相似,多元统计分析结果表明爬沙虫不同部位成分含量差异较大,正交偏最小二乘判别分析(OPLS-DA)筛选出6种差异最大化合物,经HPLC测定含量验证,表明6种成分在头、胸、腹三个部位之间均具有显著性差异。
爬沙虫化学成分具有多种药理作用,根据文献报道,爬沙虫中所检测的苯丙氨酸、精氨酸、亮氨酸、谷氨酸4种氨基酸在维持人体氮平衡中发挥重要作用[13],是重要的功能性成分。有机酸类成分如肉桂酸有减小心肌缺血再灌注损伤、抗肿瘤等作用[14],异贝壳杉烯酸具有抗菌、抗炎等活性[15]。核苷类成分亦有抗肿瘤、抗病毒等多种药理作用[16,17]。上述成分的发现可为爬沙虫药效物质基础研究提供依据。此外,在爬沙虫头、胸、腹中均检测到左旋肉碱,在三个部位中相对峰面积均较大且无显著差异,该成分对肾脏[18,19]和肾小管上皮细胞[20,21]具有显著保护作用,可能是爬沙虫入药发挥肾脏保护作用的药效物质基础之一。
2.4.2 爬沙虫差异化学成分与使用部位分析
本文结果表明烟酸、次黄嘌呤、缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸为爬沙虫头、胸、腹三个部位之间的主要差异化学成分。含量测定结果显示,烟酸、次黄嘌呤在头、胸、腹中的含量极低,而缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸在头、胸、腹中的含量较高,且头、胸含量显著高于腹部。
爬沙虫在食用时,部分地区会去掉头、胸,推测可能主要考虑到头、胸具有硬壳与嘴夹,食用不便,口感不佳等因素有关。而爬沙虫入药时则与食用时不同,《黔南本草》中记载,爬沙虫入药时常以干燥全虫入汤剂,或研末入丸、散剂[22],不必考虑其食用是否方便,口感等问题。且爬沙虫中缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸在头、胸中的含量显著高于腹部,这4种必需氨基酸常参与人体的免疫调节,这可能是爬沙虫作为全虫入药的又一原因之一。
作为药食两用型资源,爬沙虫在不同用途时(食用、药用)可根据使用目的采用不同的部位(腹、全虫)。爬沙虫在作为食材时,将头、胸作为废弃物,可将其收集起来作为药用原材料,进一步节约资源。囿于系统化学方法的局限性,目前本文只对鉴定出的25种成分进行分析,爬沙虫中还含有大量其他成分,特别是氨基酸类,课题组在前期测定其富含缬氨酸、亮氨酸、异亮氨酸等7种人体必需氨基酸[3]。因此本文后续展开对爬沙虫不同部位每类化合物的深入研究与分析,结合营养功能与药用功能,进一步确证爬沙虫使用部位选择的科学性,为其加工以及资源更合理的开发应用提供依据。
3 结论
本文运用UHPLC-Q-TOF-MS/MS技术对川滇特产爬沙虫不同部位的化学成分以及成分差异物质进行含量分析,在爬沙虫头、胸、腹中共鉴定出25种化合物,6种主要差异物,除缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、丝氨酸、组氨酸6种[3]成分外,其他19种化合物均为爬沙虫中首次报道。该方法快速,简便,结果准确,为药食两用的动物源食材爬沙虫的研究提供技术支撑,同时本实验为爬沙虫进一步药用物质基础研究奠定基础,有利于其使用部位的选择与产地加工、资源的合理利用开发。
