不同产地黄精的化学成分及体外降血糖功效的比较
2022-09-02马娟张怡雯董晨阳柴洋洋郭庆启
马娟,张怡雯,董晨阳,柴洋洋,2*,郭庆启,2
(1.东北林业大学林学院,黑龙江哈尔滨 150040)
(2.黑龙江省森林食品资源利用重点实验室,黑龙江哈尔滨 150040)
黄精是百合科黄精属(Polygonatum)的药食同源植物[1]。全国大部分地区都有分布,主要产于宁夏、甘肃、广西、陕西、黑龙江、河北、辽宁、贵州、湖南、云南等地[2]。据报道黄精具有许多药理作用和生物学活性,例如抗氧化和抗衰老,此外还具有抗骨质疏松、神经保护、增强免疫力、抗糖尿病、抗疲劳和抗癌作用,同时也有治疗疲劳、虚弱、糖尿病、咳嗽、消化不良、食欲不振、性功能障碍、背痛和剧烈疼痛的作用。由于黄精含有多种活性成分,例如生物碱、黄酮、类固醇皂苷、木质素、氨基酸和多糖,才能发挥如此丰富的生物活性[3]。
糖尿病是一种由于遗传等因素引起的,因先天性或后天体内胰腺分泌胰岛素不足,使得糖代谢、脂肪代谢紊乱的疾病。现代医学治疗本病方法较多,如注射胰岛素、口服降血糖药等,大多数都以西药为主,然而使用西药控制不可避免长期用药,同时一些并发症的出现也让治疗的风险增大。糖尿病在中医中被分类成“消渴病”[4]。滋阴清热法是本病的主要治疗原则[5]。而中药的使用,不仅能有效延缓肝、肾的损伤,发挥温合的药效,同时适用于大多数患者。徐锦龙等[6]已就黄精多糖显著降低糖尿病大鼠模型血糖水平的机制进行研究并得出黄精中药制剂治疗2型糖尿病不劣于单纯西药治疗的结论,贾璐等[7]也通过观察小鼠血糖水平证实了黄精多糖具有降低高血糖小鼠空腹血糖值等作用。
肠道微生物群是人体最大的生物系统[8],同时,肠道菌群有助于平衡人类与环境之间的动态平衡,而代谢异常会导致肠道菌群功能失调,内部环境紊乱以及病原体的繁殖[9]。因此,如何逆转肠道菌群的失衡已成为糖尿病的治疗策略[10]。大量研究表明,益生菌可以有效地干扰糖尿病患者的胰岛素分泌从而抵抗2型糖尿病[11],冉雄等[12]通过系统地评估,得出参芪复合物导致2型糖尿病患者的菌群代谢产物为内毒素、短链脂肪酸、胆汁酸、吲哚等,所以通过研究肠道菌群结构和组成的调节情况考察植物活性成分的血糖调控作用具有一定的研究价值。
王俊杰等[13]发现不同地区的黄精中都含有18种氨基酸,但是不同地区黄精氨基酸的含量存在差异性,而不同产地的黄精其化学成分含量也不尽相同。因此本研究旨在测定分析六个不同产地(安徽、湖南、云南、黑龙江、辽宁、广西)黄精的主要化学成分(水分、灰分、皂苷、多糖、粗蛋白、粗纤维、粗脂肪)的含量差异,就六个不同产地的黄精对α-葡萄糖苷酶、α-淀粉酶、葡萄糖透析延迟指数进行分析比较,选取有效化学成分含量较高、降糖性能较好的黄精进一步体外酵解培养,通过16S rDNA测序对培养液的菌群进行分析,探究肠道菌群的结构和组成情况,分析黄精降血糖作用。
1 材料与方法
1.1 材料与试剂
黄精样品分别选自六个不同产地,其中安徽黄精产地为安徽省池州市青阳县九华山,湖南黄精产地为湖南省永州市祁阳县挂榜山,云南黄精由云南省临沧市云县信合农业发展有限公司提供,黑龙江黄精由黑龙江省哈尔滨市阿城区天门山农业综合开发股份有限公司提供,辽宁黄精产地为辽宁省鞍山市海城市析木镇,广西黄精产地为广西省百色市西林县那哈村王子山,获得材料后,将表面泥土洗净,用刀切成薄片(0.5 cm左右),置于45 ℃烘箱中烘干至恒重,粉碎,过40目筛后放入保鲜袋冷冻保存。
清洁级昆明小鼠购自青岛大任富城畜牧有限公司(许可证号:SCXK(Lu)2014-0007)。
薯蓣皂苷元、蒽酮、考马斯亮蓝G-250、α-葡萄糖苷酶、α-淀粉酶、可溶性淀粉、粘蛋白、胰蛋白胨、阿拉伯半乳聚糖、瓜尔豆胶、L-半胱氨酸盐酸盐,上海源叶生物科技有限公司;蛋白胨、酵母浸粉,北京奥博星生物技术有限责任公司;牛血清白蛋白,美国BiotoPPed公司;香草醛、3,5-二硝基水杨酸,天津市光复精细化工研究所;无水乙醇,辽宁泉瑞试剂有限公司;正丁醇,天津市富宇精细化有限公司;高氯酸,天津政成化学制品有限公司;石油醚,天津市北联精细化学品开发有限公司;磷酸,天津市耀华化学试剂有限责任公司;浓硫酸、浓盐酸,西陇化工股份有限公司;苯酚,天津市天力化学试剂有限公司;其它药品试剂均为国产分析纯。
培养基(g/L):可溶性淀粉5 g、蛋白胨5 g、胰蛋白胨5 g、酵母提取物4.5 g、NaCl 4.5 g、KCl 4.5 g、果胶2 g、粘蛋白4 g、络蛋白(干酪素)3 g、阿拉伯半乳聚糖2 g、NaHCO31.5 g、一水合硫酸镁0.69 g、瓜尔豆胶1 g、L-半胱氨酸盐酸盐0.8 g、磷酸二氢钾0.5 g、磷酸氢二钾0.5 g、胆酸盐0.4 g、CaCl20.08 g、FeSO4·7H2O 0.5 g、吐温80 1 mL、刃天青4 mL(0.025%,m/V),121 ℃下灭菌15 min使用[14]。
1.2 仪器与设备
FW 100高速万能粉碎机,天津市泰斯特仪器有限公司;B-220恒温水浴锅,上海亚荣生化仪器厂;BS-224-S电子分析天平,北京赛多利斯科学仪器公司;UV-6300紫外可见分光光度计,上海美谱达仪器有限公司;RE52CS旋转蒸发器,上海亚荣生化仪器厂;SB25-12DTD超声波清洗机,宁波新芝生物科技股份有限公司;灭菌锅,上海东亚压力容器制造有限公司;恒温培养箱,天津市泰斯特仪器有限公司;离心机,上海安亭科学仪器厂;pH计,上海仪电科学仪器股份有限公司;XK96-A快速混合机,江苏新康医疗器械有限公司;SPetramax 2e全自动酶标仪,美国MD公司;超净工作台,北京亚泰科隆仪器技术有限公司;TGL-16G离心机,上海安亭科学仪器厂。
1.3 方法
1.3.1 黄精化学成分测定
1.3.1.1 水分含量测定
参考GB 5009.3-2016《食品中水分的测定》,采用直接干燥法测定。
1.3.1.2 灰分含量测定
参考GB 5009.4-2016《食品中灰分的测定》,采用灼烧法测定。
1.3.1.3 多糖含量测定
参考蓝松[15]的方法,采用苯酚-硫酸法测定。
使用紫外分光光度计,重复测定三次后除去异常数据,取平均值,以吸光度为纵坐标,葡萄糖浓度(mg/mL)为横坐标绘制标准曲线,得到y=13.266x +0.1049,R2=0.9997的回归方程。
1.3.1.4 皂苷含量测定
参考苑璐等[16]的测量方法进行对照品溶液的制备及供试品溶液的制备,称取60 ℃干燥至恒重的黄精粉末2 g,加入石油醚50 mL,40 ℃超声提取30 min,过滤,药渣挥干溶剂后,加入80%乙醇,40 ℃超声提取30 min,功率60 W,过滤,取滤液,蒸干溶剂后加入10 mL 0.5 mol/L盐酸,混匀,40 ℃超声提取45 min。再用正丁醇超声提取2次,正丁醇用量分别为30、10 mL,后挥去正丁醇,用甲醇定容至10 mL,即得供试品溶液。
通过紫外分光光度计,采用香草醛-冰醋酸法测定,重复测定三次后除去异常数据,取平均值,以总皂苷的含量以吸光度为纵坐标,薯蓣皂苷元浓度(mg/mL)为横坐标,绘制标准曲线,得到y=2.1871x+0.1161,R2=0.9997的回归方程。
1.3.1.5 粗脂肪含量测定
参考GB 5009.6-2016《食品中脂肪的测定》,采用索氏抽提法测定。
1.3.1.6 粗蛋白含量测定
参考柳荫等[17]的方法,进行标准蛋白质溶液的制备,使用紫外分光光度计,重复测定三次后除去异常数据,取平均值,以标准蛋白质浓度(mg/mL)为横坐标,吸光度值为纵坐标绘制标准曲线,得到y=0.901x+0.0062,R2=0.999的回归方程,并结合王远茜等[18]的研究内容,采用考马斯亮蓝法测定。取20 g鲜黄精,在料液比1:5(g/mL),pH为9(NaOH溶液调节)的条件下放置于4 ℃冰箱浸提4 h,过滤之后用HCl分别调pH至3.5,过滤后再离心,取上清液密封保存。滤渣再提取一次,合并滤液。取样品溶液0.1 mL于试管中,各加入5 mL考马斯亮蓝试剂,充分混合,放置10 min,以试剂空白为对照,波长595 nm处比色,测定吸光度值。
1.3.1.7 粗纤维含量测定
参考GB/T 5009.10-2003《植物类食品中粗纤维的测定》,采用碱提酸沉法测定。
1.3.1.8 水提物与醇提物制备
参考梁小瑞等[19]的方法,分别称取不同产地黄精粉末5 g,分别加100 mL蒸馏水浸泡2 h(料液比为1:20),加热回流提取3次,每次2 h,合并提取液并离心分离3000 r/min,离心20 min,上清液使用旋转蒸发仪减压浓缩至5 mL,所得即为水提物。
参考武晓英等[20]的方法,精密称取5 g黄精粉末,加入40 mL的80%乙醇(m/V=1:8),浸泡24 h,回流提取3次,每次2 h,以4000 r/min离心10 min,合并离心上清液,旋转蒸发回收乙醇至无醇味,所得即为醇提物。
1.3.1.9 黄精水提物及醇提物对α-葡萄糖苷酶的抑制作用
参考包瑞敏等[21]和赵堂彦等[22]的方法,水提物进行稀释,吸取400 μL样品加100 mL水即为待测水提物样品溶液;在试管中加入1000 μL磷酸盐缓冲溶液(pH 6.8,0.05 mol/L),200 μLα-葡萄糖苷酶溶液(0.2 U/mL),100 μL样品溶液;37 ℃水浴20 min;加入200 μL PNPG溶液(0.02 mol/L);继续37 ℃水浴20 min;加入800 μL Na2CO3溶液(1 mol/L)停止反应;于405 nm处测定其吸光值。同时做相同体系下的样品对照组(用磷酸盐缓冲溶液代替α-葡萄糖苷酶溶液,加入PNPG溶液后再加入NA2CO3溶液)、样品空白组(用磷酸盐缓冲溶液代替α-葡萄糖苷酶溶液,加入PNPG溶液后再加入NA2CO3溶液)。醇提物不稀释,操作方法与上述相同。α-葡萄糖苷酶抑制率计算公式如下:
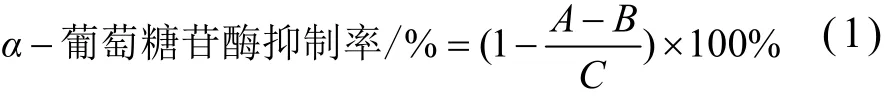
式中:
A——样品组吸光度;
B——样品对照组吸光度;
C——样品空白组吸光度。
1.3.1.10 黄精水提物及醇提物对α-淀粉酶的抑制作用
参考赵堂彦等[22]、马利华等[23]的方法,水提物进行稀释,吸取400 μL样品加100 mL水即为待测水提物样品溶液;在试管中加入200 μL黄精提取液混合500 μL的α-淀粉酶(0.50 mg/mL)的磷酸钠缓冲溶液(0.02 mol/L,pH 6.9,含0.006 mol/L NaCl为稳定剂);37 ℃水浴孵育5 min;加入500 μL淀粉溶液(0.02 g/mL,0.02 mol/L钠缓冲溶液,pH 6.9,含0.006 mol/L NaCl);37 ℃水浴孵育5 min;加入500 μL二硝基水杨酸停止反应;沸水中进一步孵育5 min;反应混合物冷却后,在540 nm处读取吸光度;同时做相同体系下的样品对照组(除淀粉溶液外,所有试剂和酶都有)。醇提物未稀释,加入1 mL二硝基水杨酸,其余步骤均相同。α-葡萄糖苷酶抑制率计算公式如下:

式中:
A对照样品吸光度——不加淀粉溶液时540 nm处吸光度;
A样品吸光度——加淀粉溶液时540 nm处吸光度。
1.3.1.11 葡萄糖透析延迟指数的测定
参考龚卫华等[24]和黄冬云等[25]的方法,准确称取0.2000 g样品粉末和0.0200 g葡萄糖加入到10 mL的蒸馏水中;连续搅拌1 h,装入截留量为7000的透析袋中;将透析袋放入250 mL锥形瓶中;250 mL锥形瓶中加入150 mL蒸馏水;37 ℃恒温振荡;于30、60、90、120 min吸取葡萄糖透析液2 mL;测定葡萄糖的质量浓度,采用硫酸蒽酮比色法[26]测定葡萄糖的含量,620 nm处测定吸光度,以x为葡萄糖质量浓度(mg/mL),y为吸光度计算回归方程,得到y=6.5071x +0.0034,R2=0.9977的标准曲线;同时做相同体系下的样品对照组(加入粉末样品,不加葡萄糖)、空白对照组(加入葡萄糖,不加粉末样品)。葡萄糖透析延迟指数(GDRI/%)的计算公式如下:
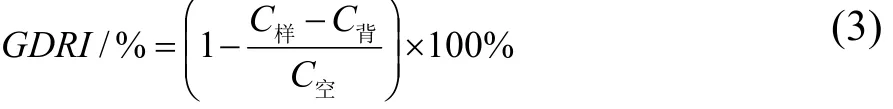
式中:
C样——样品溶液的葡萄糖质量浓度;
C背——样品对照的葡萄糖质量浓度;
C空——空白对照的葡萄糖质量浓度。
1.3.2 黄精水提物体外模拟酵解培养
1.3.2.1 粪便接种物的制备
建立2型糖尿病鼠模型采用高脂饮食-链脲霉素诱导的方法[27],同时采用应激性排便法,轻提起小鼠尾部,后按压小鼠腹部,收集其新鲜粪便于无菌EP管中,用PBS缓冲液按固液比1:4的比例配置成20%的固液混合物,涡旋混匀,分别使用3层无菌纱布过滤,得到粪便滤液,以上操作均在厌氧操作台中完成。
1.3.2.2 体外模拟酵解培养
将黄精水提物进行体外酵解[28]后作为实验组(TFE),酵解培养体系的组成为45%粪便液、45%发酵培养基、10%黄精水提物,同时以无菌蒸馏水作为对照(正常小鼠NFC,糖尿病小鼠TFC)。将样品发酵液若干移入灭菌后的10 mL EP管中,用橡胶塞塞紧后放入装有厌氧产气包的厌氧培养袋中,再置于37 ℃的恒温培养箱中培养48 h。
1.3.2.3 pH的测定
在酵解0、6、12、24、48 h时,从样品组与对照组中分别取2 mL测定pH,记录数据。
1.3.2.4 16S rDNA测序分析
将酵解培养48 h的培养液于-80 ℃冻存,后送至杭州联川生物技术股份有限公司进行16S rDNA高通量测序,分析其菌群变化情况。
1.3.3 数据处理
每个实验重复三次,得到的数据采用Origin 2021软件进行统计分析,结果用Mean±SD/SE表示,并用SPSS 26.0软件进行处理分析,以单因素方差分析和t检验进行组间差异显著性比较,不同小写字母表示不同组别之间数据差异显著(p<0.05)。
2 结果与分析
2.1 活性成分含量分析
通过对六个产地(安徽、湖南、云南、广西、辽宁、黑龙江)的主要活性成分即水分、灰分、皂苷、多糖、粗蛋白、粗纤维、粗脂肪的含量测定,结果如表1所示,黄精的各活性成分间存在显著差异性(p<0.05)。各产地黄精水分含量较大,范围在75.40% ~91.88%,都达到了75%以上,广西产黄精的水分高达91.88%,与其他5种有显著差异(p<0.05),比较后可知,水分含量从高到低依次为:广西>辽宁>云南>湖南>黑龙江>安徽;灰分的含量在1.59%~3.82%,可见灰分的含量都未超过5%,湖南灰分与其他五个产地差异显著,而广西与黑龙江的灰分含量差异不显著,六个产地灰分含量从高到低依次为:湖南>云南>安徽>辽宁>黑龙江>广西;六个产地粗脂肪的含量为6.30%~8.70%,都小于10%且大于5%,其中云南、辽宁的黄精粗脂肪差异不显著,广西、湖南的黄精粗脂肪差异不显著,安徽、黑龙江黄精粗脂肪差异不显著,六个产地粗脂肪含量从高到低依次为:云南>辽宁>湖南>广西>黑龙江>安徽;粗纤维的含量范围在0.80%~ 4.48%,黑龙江地区的黄精粗纤维含量最少,只有0.8%,且与其它地区黄精粗纤维含量有显著差异(p<0.05),而广西的粗纤维含量达到4.48%,与其它地区黄精粗纤维含量显著差异(p<0.05),六个产地粗纤维含量从高到低依次为:广西>辽宁>安徽>湖南>云南>黑龙江;皂苷是黄精中较为重要的活性成分,这六个产地的皂苷范围是0.66~1.28 mg/mL,其中湖南、广西两地的皂苷浓度都大于1 mg/mL,与其它地区黄精皂苷含量有显著差异(p<0.05),六个产地皂苷含量从高到低依次为:湖南>广西>安徽>云南>辽宁>黑龙江;同样的,黄精多糖也是黄精活性成分中较为重要的部分,其中含量范围为0.01~0.03 mg/mL,黑龙江的黄精其多糖含量较其他地区最有优势,达到了0.03 mg/mL,且与其它地区黄精多糖含量有显著差异(p<0.05),六个产地多糖含量从高到低依次为:黑龙江>湖南>安徽>广西>云南>辽宁,而湖南、广西两地的黄精多糖、皂苷含量位于前列;粗蛋白的含量范围在0.45~0.68 mg/mL,除黑龙江与云南外,其余产地黄精的粗蛋白含量都在0.60 mg/mL以上,六个产地粗蛋白含量从高到低依次为:广西>安徽>辽宁>湖南>云南>黑龙江。通过对比分析各个产地活性成分含量,广西黄精的水分含量最高,并且其无机成分相对较少,黄精多糖含量较高,同时广西黄精的皂苷含量名列前茅,与湖南黄精的皂苷含量相差不多,粗纤维粗蛋白含量也最多;同时湖南黄精的皂苷含量最高,其余活性成分含量同样较高,因此选择湖南产地与广西产地的黄精进行进一步研究。
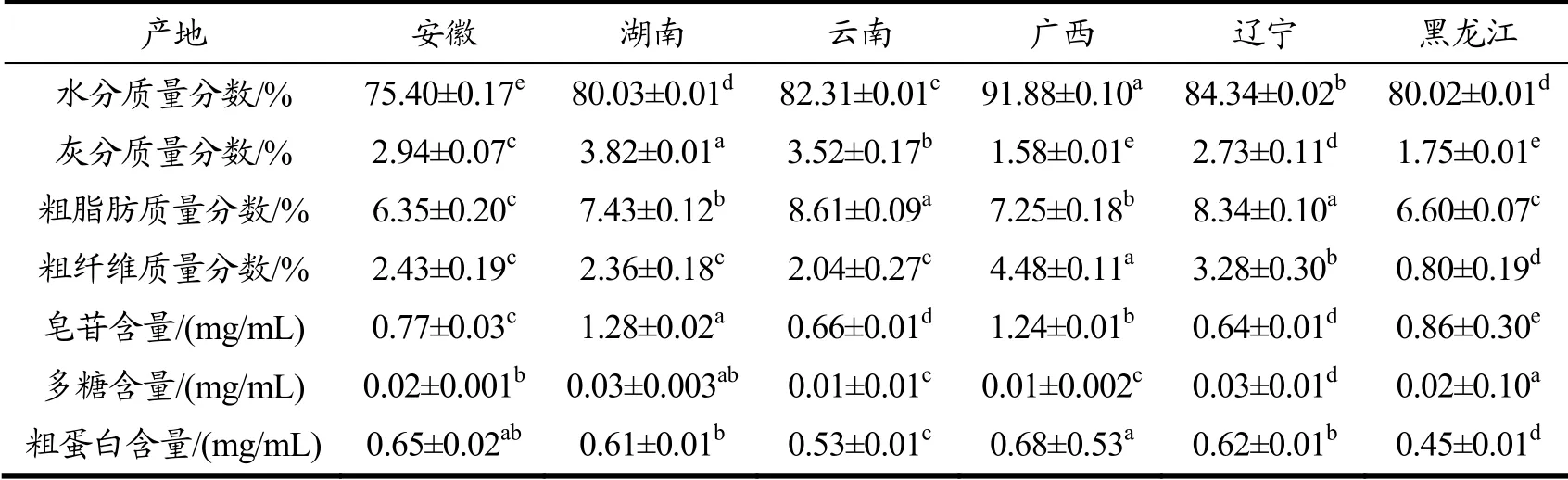
表1 不同产地黄精中化学成分的含量 Table 1 Contents of chemical compositions in Polygonatum
2.2 降血糖性能比较分析
本研究通过测定六个产地黄精水提物、醇提物对于α-葡萄糖苷酶、α-淀粉酶两种酶的抑制率,初步分析比较各个产地的降血糖性能,结果如图1所示,广西黄精水提物与醇提物对于α-葡萄糖苷酶的抑制能力最强,其中黄精水提物的抑制率为98.36%,黄精醇提物的抑制率为97.93%,较其余5个产地的黄精对于α-葡萄糖苷酶的抑制作用有显著性差异(p<0.05),六个产地黄精水提物对于α-葡萄糖苷酶的抑制率由高到低排序为:广西>湖南>黑龙江>安徽>云南>辽宁,六个产地黄精醇提物对于α-葡萄糖苷酶的抑制率由高到低排序为:广西>黑龙江>安徽>辽宁>湖南>云南。
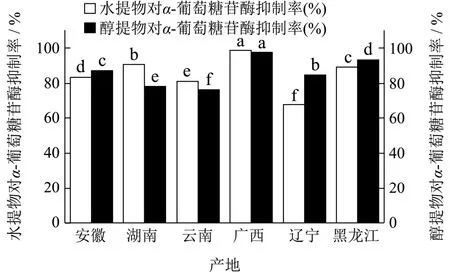
图1 黄精水提物及醇提物对α-葡萄糖苷酶的抑制作用 Fig.1 Inhibitory effect of aqueous and ethanol extracts of Polygonatum on α-glucosidase
如图2所示,在α-淀粉酶的抑制率结果中可以看到,各个产地黄精水提物对于α-淀粉酶的抑制率明显高于黄精醇提物对于此酶的抑制率,例如辽宁黄精的水提物对于α-淀粉酶的抑制率达到了85.16%,而辽宁黄精醇提物对于α-淀粉酶的抑制率只达到了20.87%,差异极显著(p<0.05),这表明不同的处理方法及提取方式都会对其化学成分和功效造成影响。其中六个产地黄精水提物对于α-淀粉酶的抑制率由高到低排序为:安徽>云南>黑龙江>广西>湖南>辽宁;六个产地黄精醇提物对于α-淀粉酶的抑制率由高到低排序为:湖南>黑龙江>安徽>云南>广西>辽宁。
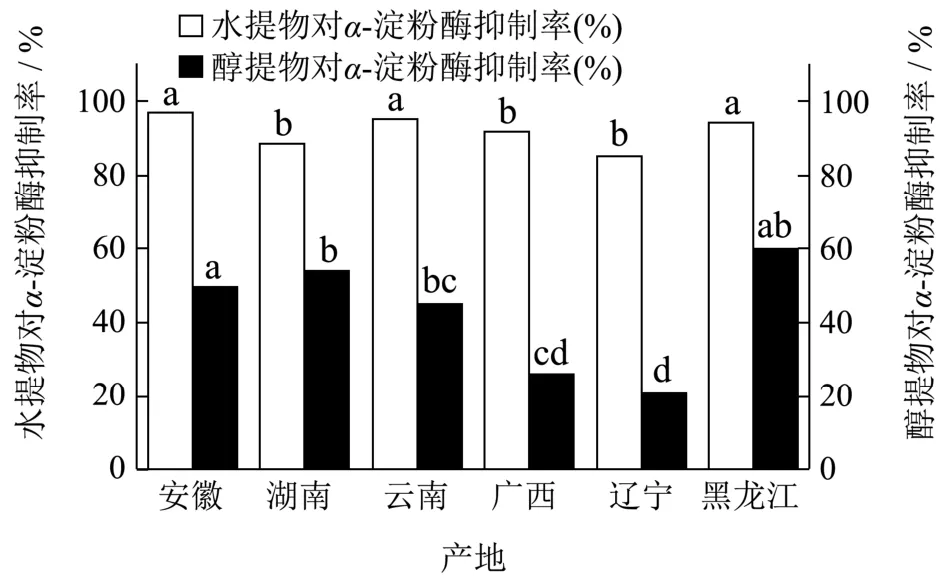
图2 黄精水提物及醇提物对α-淀粉酶的抑制作用 Fig.2 Inhibitory effect of aqueous and ethanol extracts of Polygonatum on α-amylase
结合2.1部分对各个产地活性成分含量的分析比较,广西黄精其水提物与醇提物对于α-葡萄糖苷酶的抑制性较其余产地差异较显著(p<0.05),同时广西黄精水提物对于α-淀粉酶的抑制率也较高,为91.85%;湖南黄精的水提物对于这两个酶的抑制率与广西黄精相比较,差异略显著(p<0.05),然而也处于较高水平,其水提物对于α-葡萄糖苷酶的抑制率达到了90.24%,且湖南黄精醇提物对于α-淀粉酶的抑制率为六个产地中最高,达到了54.21%;除此之外,黑龙江黄精也值得我们关注,由上一部分化学成分含量分析可知,黑龙江黄精中多糖含量较高,而其水提物与醇提物对于α-葡萄糖苷酶与α-淀粉酶的抑制率都达到了较高水平。综上所述,广西黄精相对于其他产地黄精有较好的降血糖活性。
同时进行葡萄糖透析指数的测定,当葡萄糖在胃肠道中被延迟吸收时,血液中的血糖含量将会减少[24]。葡萄糖透析延迟指数(GDRI)可是一个重要的体外指标,对于预测纤维对胃肠道葡萄糖吸收的延迟具有重要作用[29]。不同产地黄精水提物和醇提物的葡萄糖透析指数结果如图3所示,随着时间的增加,安徽、湖南两地黄精的葡萄糖透析指数先增长后下降,在60 min时,安徽黄精的葡萄糖透析指数达到最高(87.19%);广西黄精的葡萄糖透析指数则一直呈现增长趋势,由30 min时的45.53%上升到了120 min时的73.25%,云南黄精的葡萄糖透析指数呈现先减后增的趋势,30 min时已经达到了最高(97.32%),60、90 min时都有所下降,120 min时云南黄精的葡萄糖透析指数又增长回93.31%;辽宁、黑龙江的葡萄糖透析指数增大后减小,随后继续增大,后减小,90 min时,两地黄精都达到最高水平,辽宁黄精的葡萄糖透析指数为93.78%,黑龙江黄精的葡萄糖透析指数为96.28%;本试验中,各产地黄精的GDRI要显著高于橄榄核中提取纤维的GDRI(22%~29%)、芒果皮中纤维的GDRI(21%)和杨桃果渣纤维的GDRI(25%)、麦麸中纤维的GDRI(5.3%)[30]。
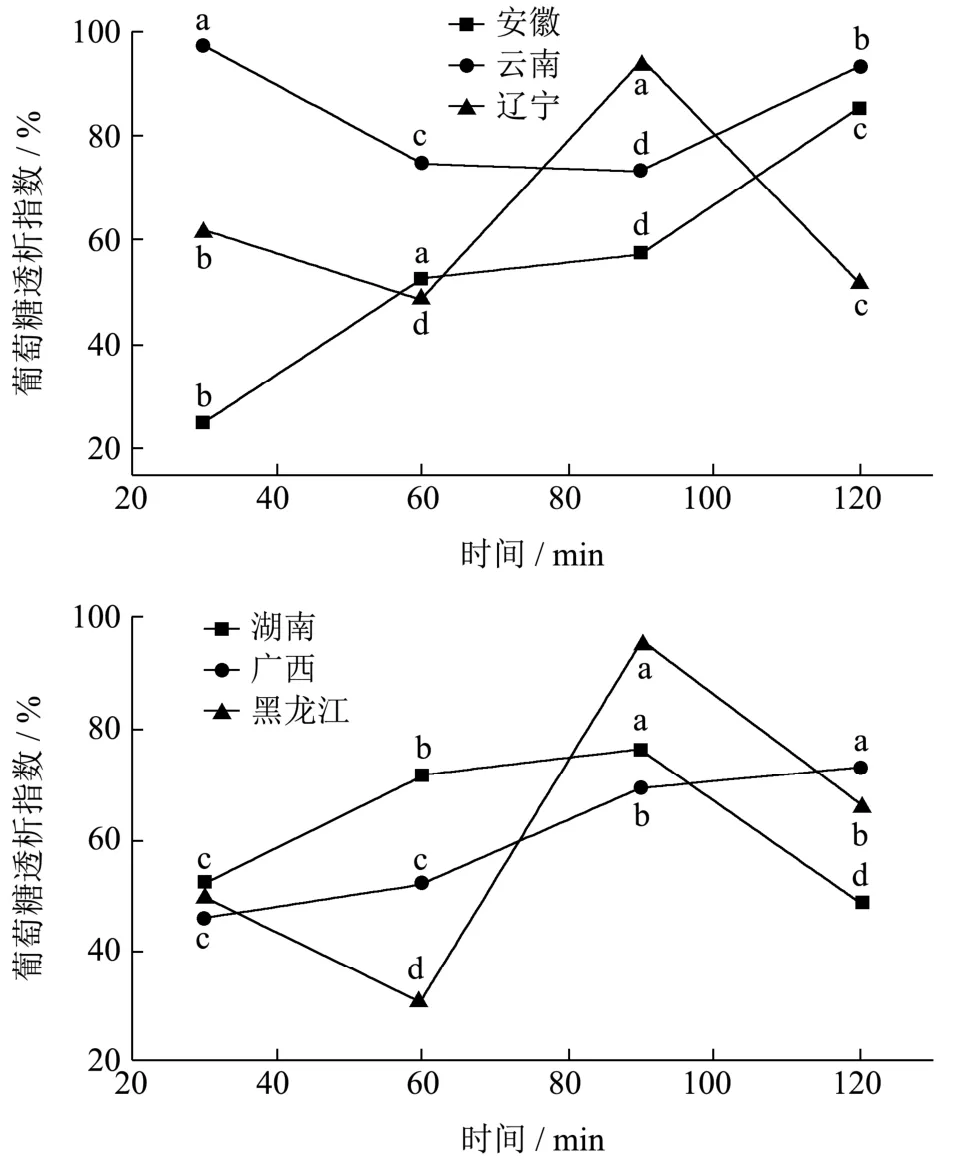
图3 不同时间各个产地黄精水提物、醇提物葡萄糖透析指数的变化情况 Fig.3 Changes of glucose dialysis index of water extract and alcohol extract of Polygonatum from different places of origin at different time
总体来看,云南黄精的葡萄糖透析能力优于其他产地黄精,各地黄精在葡萄糖透析指数达到最高水平时差异不显著,但各地黄精在30、60、90、120 min时的葡萄糖透析指数变化趋势不同,这可能与黄精的来源和内在结构、其活性成分含量都有一定关系。
2.3 16S rDNA结果分析
根据六个产地黄精化学成分含量及降血糖性能的综合比较分析,选用广西黄精的水提物进行体外酵解培养。将培养液进行16S rDNA高通量测序。
2.3.1 feature分布Venn图分析
如图4所示,三个组中feature表达均为非零,即为三个组共有的feature的丰度为120,同理,若存在feature只存在于一个分组,则该feature为该分组特有,可以看到,NFC的特有feature丰度为435,TFC的特有feature丰度为483,TFE的特有feature丰度为285。而NFC与TFC共有feature的丰度为143,NFC的特有feature丰度为412,TFC的特有feature丰度为460,此两组共有的feature的相对丰度较低,表明正常小鼠与糖尿病小鼠肠道菌群组成及优势菌群差异显著。TFC与TFE这两个组别是我们重点比较的一组,其中共有的feature的丰度为289,TFC的特有feature丰度为314,TFE的特有feature丰度为116,这表明了黄精的提取物对于糖尿病患者的肠道菌群有一定的影响,从而导致了特有feature的产生与相对丰度的变化。最后一组对比为NFC与TFE,共有feature的丰度为129,其中NFC的特有feature丰度为426,TFE的特有feature丰度为276,可以看到,此两组的feature差异显著,即正常小鼠的肠道菌群与经过培养的糖尿病小鼠的肠道菌群的菌种与数量差异显著。
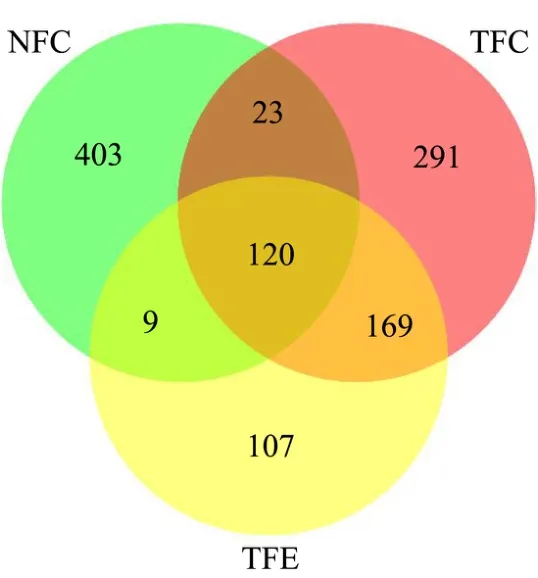
图4 三个组分的Venn图 Fig.4 Venn diagram of three components
2.3.2 Alpha多样性分析
稀释曲线(rarefaction curve)通过模拟重新取样的过程,观察NFC、TFC、TFE三组中物种及菌群变化的趋势,估计样本中的物种丰富程度。如图5a稀释曲线所示,横坐标代表随机抽取的序列数量,纵坐标代表观测到的feature数量。可以看到NFC的chao1指数为245.50~297.64,TFC的chao1指数为266.00~327.40,TFE的chao1指数为200.00~246.13,同时通过图5b看到NFC的shannon指数为5.61~5.97,TFC的shannon指数为5.86~6.00,TFE的shannon指数为5.26~5.67,其所有样本的数据的覆盖率都达到了1.00(0.999以上),即在相同的测序深度下,TFC中的feature数目的丰度大于NFC,同时NFC的feature数目的丰度大于TFE。也就是在一定程度上TFC的丰富度和多样性高于NFC,同时NFC的丰富度和多样性高于TFE,表明糖尿病小鼠的肠道菌群结构比正常小鼠的肠道菌群结构复杂,而经黄精提取物干预后,糖尿病小鼠的肠道菌群结构变得简单,改善了糖尿病小鼠肠道菌群的紊乱情况。从上图曲线中我们也可以看到,曲线在测序深度为0~500的范围内继续上升,而到后面曲线趋于平缓,这说明估算测序数据量足够,且测序数据量渐进合理,达到饱和。
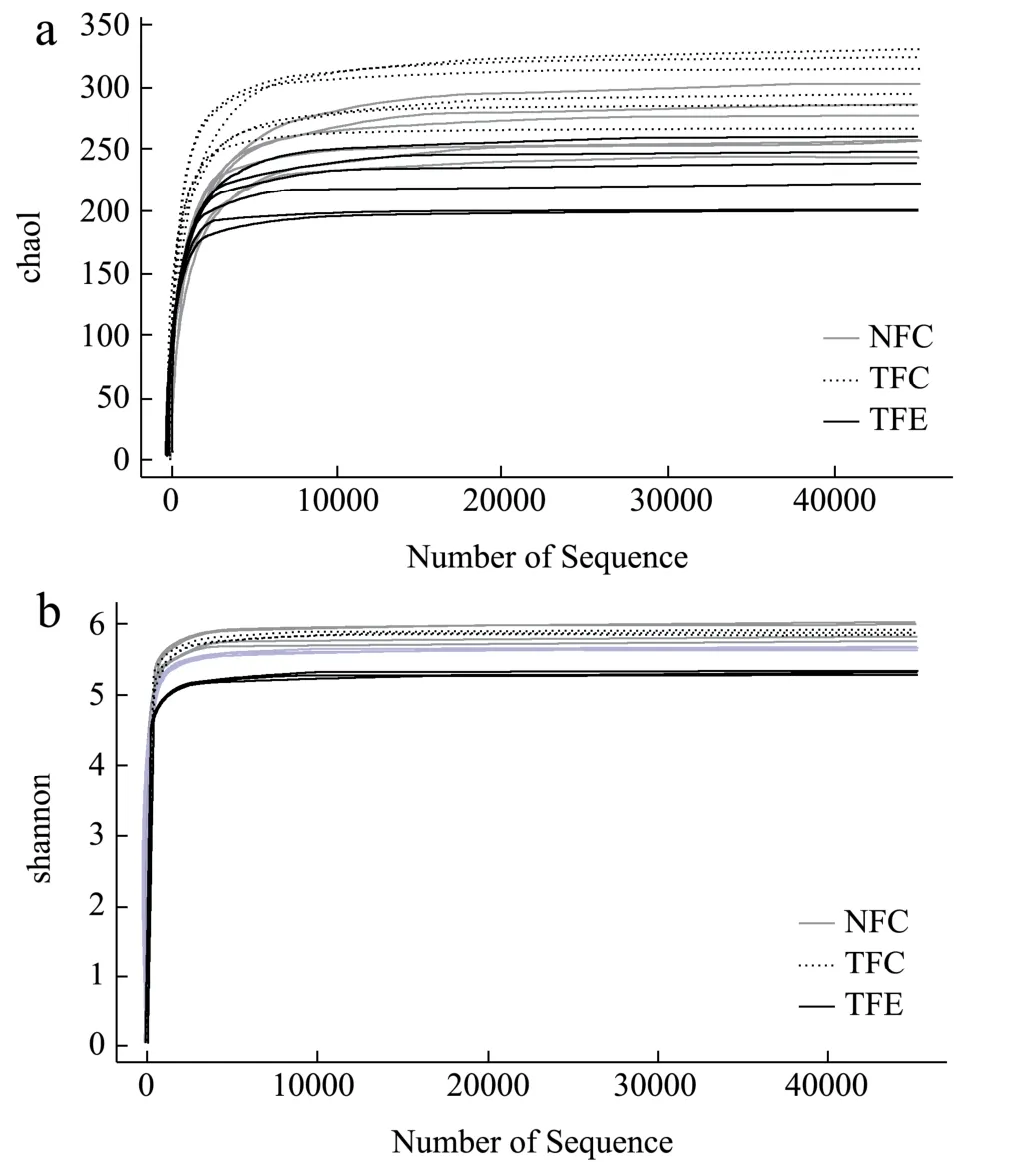
图5 三个组分的chao1指数稀释曲线图(a)和shannon指数稀释曲线图(b) Fig.5 Chao1 exponential dilution curve (a) and shannon exponential dilution curve (b) of the three components
2.3.3 物种分析
如图6所示,默认选取丰度最高的30个物种分类,将每个分组样本的相对丰度进行柱状图展示。柱状图的形式便于更直观地进行样品丰度的比较。在各个层级中,我们可以直观的看到优势菌种的表达情况,及在各个不同处理中的变化趋势。在本文中我们重点关注门、属水平的分类,代表性强且分类层级清晰便于比较,易于分析。
门水平下各组分样品丰度如图6a所示,在糖尿病鼠的粪便滤液与黄精水提取液体外厌氧培养48 h小时后,丰度显著降低的菌门有Firmicutes厚壁菌门、Bacteroidetes类杆菌门等,丰度显著增大的菌门有Actinobacteria放线菌门、Proteobacteria变形菌门等。
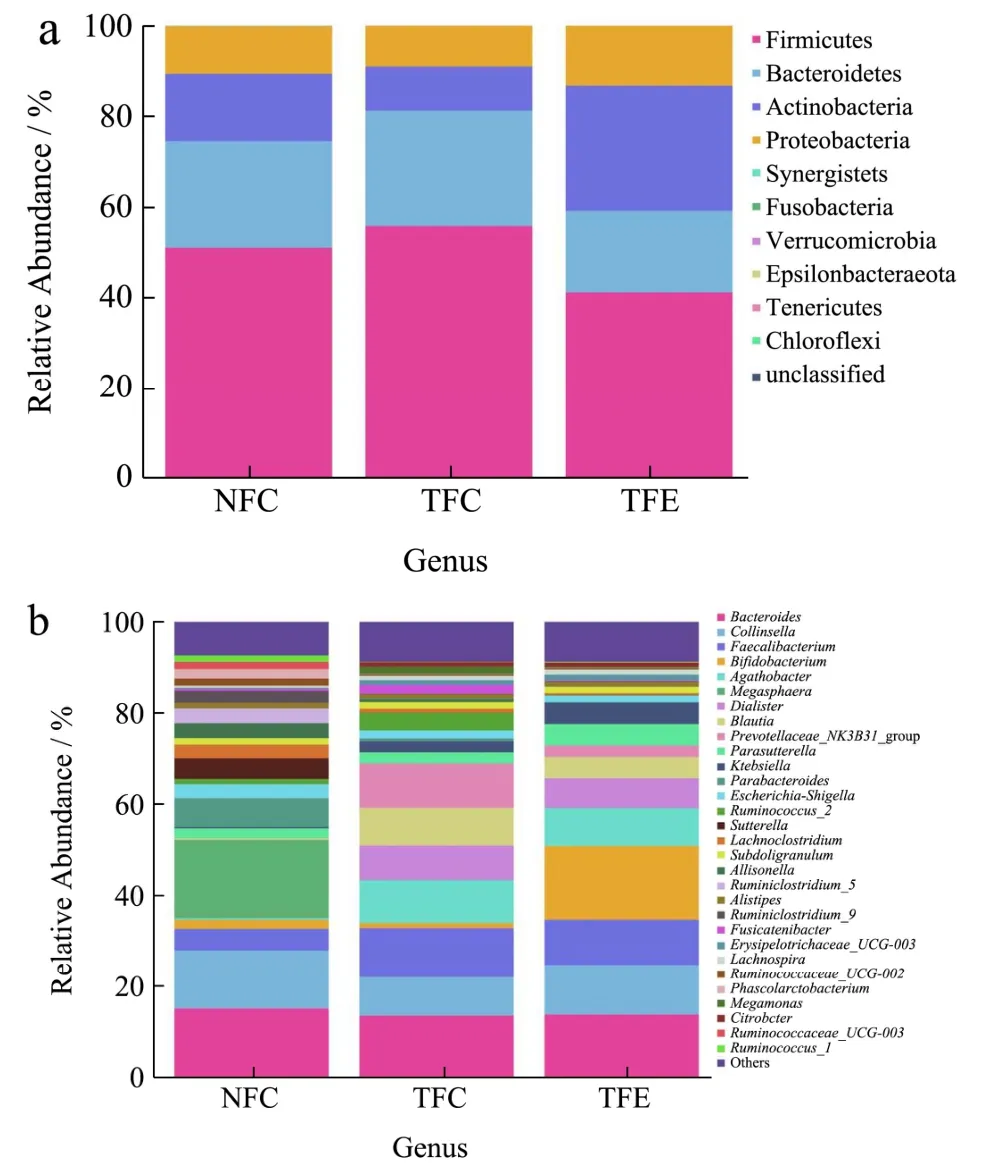
图6 各组分样品门水平(a)和属水平(b)的柱状图 Fig.6 The histogram of each component sample gate level (a) and genus level (b)
属水平下,经黄精水提物干预后,糖尿病小鼠的肠道菌群中丰度降低的菌群有Faecalibacterium粪杆菌门、Agathobacter无杆菌、Dialiste戴阿里斯特杆菌、Blautia布芬特式菌、Parabacteroides拟杆菌、Escherichia-Shigella大肠杆菌志贺氏菌、Lachnoclostridium巨单胞菌门、Allisonella阿里松氏菌、Fusicatenibacter融合杆菌等,丰度显著降低的菌群有Prevotellaceae_NK3B31_group普雷沃氏菌、Ruminococcus_2瘤胃球菌等;而丰度增大的菌有Bacteroides拟杆菌、Collinsella柯林斯氏菌、Parasutterella副沙门氏菌、Klebsiella克雷伯菌、Alistipes理研菌科另枝菌等,丰度显著增大的菌群有Bifidobacterium双歧杆菌等。
Bacteroidetes类杆菌门的代谢产物都在厌氧感染中起着重要作用,故Bacteroidetes类杆菌门为有害菌,说明黄精提取物使病鼠肠道菌群中的有害菌门减少,具有有益作用。Proteobacteria变形菌门可以发酵葡萄糖,产酸产气,对糖尿病小鼠而言是有益菌门,而此菌的变化情况与范顺明等[31]研究的生知母-生黄柏对糖尿病小鼠降糖过程中变形菌门的变化情况相同。门水平下,黄精提取液对于病鼠的肠道菌群构造与各优势菌门的丰度都有很大的改变,有益菌门丰度相应增大,而有害菌门丰度减小。
Bifidobacterium双歧杆菌是一种肠道有益微生物,李俊洁等[32]已就此菌的药理作用进行研究,双歧杆菌具有降低血脂等功能,故对于糖尿病等代谢疾病作用优良。Faecalibacterium粪杆菌门为化能有机营养,发酵代谢,是厌氧菌门,糖化血红蛋白是监测糖尿病人血糖水平的重要指标,研究发现,粪杆菌丰度与糖化血红蛋白呈负相关[33]。Prevotellaceae_NK3B31 _group普雷沃氏菌擅长消化肠道中的糖蛋白。Ruminococcus_2瘤胃球菌是一种异型发酵菌群,维生素分解菌群。
综上所述,在黄精水提物干预后,改善了糖尿病小鼠肠道菌群中优势菌门的丰度和多样性,Proteobacteria变形菌门、Bifidobacterium双歧杆菌等有益菌丰度增大,而Prevotellaceae_NK3B31_group普雷沃氏菌、Ruminococcus_2瘤胃球菌等有害菌丰度降低,这意味着黄精有效改善糖尿病小鼠肠道菌群紊乱,具有一定降血糖性能。
2.3.4 黄精水提物体外酵解培养pH变化
分别在体外酵解0、6、12、24、48 h时对培养液进行pH的测定,测定结果如下:
如图7所示,NFC、TFC、TFE三组整体pH值呈现下降趋势,其中正常小鼠粪便液的pH值显著低于糖尿病小鼠粪便液的pH值,根据2.3.2 Alpha多样性分析结果可知,正常小鼠的肠道菌群结构比糖尿病小鼠的肠道菌群结构复杂,且前者肠道菌群中菌群的丰度大于后者,导致正常小鼠的粪便液中有机酸含量更高,pH值更低。而经过黄精提取物培养后的培养液的pH值远小于未经培养的正常小鼠与糖尿病小鼠的粪便液,这可能是由于随着体外酵解培养时间的增加,小鼠肠道菌群中一些产酸菌的繁殖速度变快,其产生的短链脂肪酸等有机酸含量增加,短链脂肪酸等有机酸能够改善肥胖小鼠的血糖水平,并提高胰岛素敏感性[33]。前期研究发现,经过黄精提取物的干预后,糖尿病小鼠肠道菌群中一些产酸菌如变形菌门(Proteobacteria)等的丰度增大,从而导致TFE组pH值整体小于TFC组,且下降趋势明显,同时酸性环境对有益菌的生存、繁殖具有推动作用,而抑制有害菌门的增值,这意味着黄精可以显著改善糖尿病小鼠肠道菌群的pH值与血糖水平,使其趋于稳定状态。
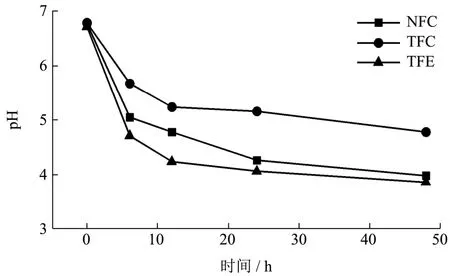
图7 不同时间黄精水提物体外酵解液pH的变化情况 Fig.7 Changes of the pH of the extracorporeal fermentation solution of Polygonatum water extract
3 结论
3.1 通过对比分析六个产地黄精的化学成分含量,广西黄精的水分、粗纤维、粗蛋白都显著高于其他产地黄精,湖南黄精的多糖与皂苷含量显著高于其它产地,而广西黄精的提取物对于α-葡萄糖苷酶的抑制率同样较优。广西黄精的葡萄糖透析指数一直呈现增长趋势,各地黄精的葡萄糖透析指数变化趋势不同,这可能与黄精的来源和内在结构、其活性成分含量都有一定关系。故本研究选用广西黄精水提物体外酵解培养,后经16S rDNA高通量测序及分析发现,在门水平与属水平下,各有益菌门丰度增大,如变形菌门(Proteobacteria)、双歧杆菌(Bifidobacterium)等,而普雷沃氏菌(Prevotellaceae_NK3B31_group)、瘤胃球菌(Ruminococcus_2)等有害菌门丰度降低。研究[32]发现,黑木耳中的黑木耳多糖主要是由木糖、果糖、甘露糖以及葡萄糖组成的杂多糖,其对α-葡萄糖苷酶和α-淀粉酶具有较强的抑制作用,且体外降血糖活性较强。而白云飞等[33]所研究的黑木耳多糖与银耳多糖、山楂黄酮复配物促进小鼠肠道菌群中乳杆菌、双歧杆菌、嗜酸乳杆菌等有益细菌的生长与本文中黄精提取物干预后促进小鼠肠道菌群中变形菌门(Proteobacteria)、双歧杆菌(Bifidobacterium)等有益细菌生长,趋势一致,这说明黄精提取物的干预对于糖尿病小鼠肠道菌群的紊乱有着一定的改善作用,且黄精具有体外降血糖活性。
3.2 本研究比较分析了不同产地各化学成分的含量差异,并对不同产地黄精的降血糖性能进行测定,结合16S rDNA进行物种分析,充分证实了黄精的调节作用,为黄精在糖尿病防治方面提供理论依据。
