石金钱龟低聚肽制备工艺优化及其抑制新冠病毒的潜能
2022-09-02苏可盈杨贵卓戴庞聪李莉徐晓飞张学武
苏可盈,杨贵卓,戴庞聪,李莉,徐晓飞,张学武*
(1.广州工商学院工学院,广东广州 510850)(2.华南理工大学食品科学与工程学院,广东广州 510642) (3.东莞华发生物科技有限公司,广东东莞 523000)
新型冠状病毒SARS-COV-2是于2019年底开始流行的一种急性呼吸道感染病毒。科学家们分离出导致该疾病的病原体,并指出它是一种新的冠状病毒,属于2003年流行的非典型肺炎病毒SARS-COV的同一病毒家族[1]。目前,药物治疗的研究主要在于寻找SARS-COV-2蛋白酶(MPro)的抑制剂[2,3]和SARS-COV-2棘突蛋白(S蛋白)的抑制剂[4]。其中,SARS-COV-2棘突蛋白是一种糖蛋白,它能在冠状病毒表面上形成类似于冠状样外观[5],它是冠状病毒SARS-COV-2识别宿主细胞的主要驱动力,负责与宿主细胞上的ACE2受体结合,并介导宿主细胞膜和病毒膜的融合从而感染宿主细胞[6]。本研究旨在应用分子对接技术筛选出SARS-COV-2棘突蛋白的抑制剂。分子对接是药物筛选常用的方法,该方法能模拟某些配体物质与特定的受体蛋白结合模式,再根据计算物理化学参数来预测其结合势能,两者的结合势能越低,说明配合体越稳定,配体对蛋白质活性的抑制越强[7,8],目前,分子对接已被广泛用于低聚肽药物的筛选,学者们已应用分子对接技术从虾夷扇贝[9]、发酵大豆制品[10]、吞拿鱼[11]中成功筛选出了抑制SARS-CoV-2活性的低聚肽。
石金钱龟(学名:Mauremys mutica),又称石龟、黄喉拟水龟,在分类上隶属龟鳖目、潮龟科、拟水龟属,在我国华东、华南等地分布较广,也常见于越南、日本等国家。龟肉在我国作为食疗和药用有着悠久的发展历史,龟肉营养丰富,可滋阴养颜,增补保健,延年益寿,入药可治疗痛风、糖尿病、肺结核。龟肉中粗蛋白含量约为16.46%,其中必需氨基酸占40%,其氨基酸模式基本能满足FAO/WHO所推荐的人体所需的氨基酸模式[12]。且多项研究表明,龟肉多肽有抗氧化[13]、抗肿瘤[14]等生理功能。
由此可见,从传统应用角度和现代研究视角均能体现龟肉具有提高抵抗力的相关功能,所以龟肉蛋白对新冠肺炎病毒的作用值得探究。而现存对于龟肉酶解的研究中,龟肉蛋白的水解度较低(仅为15%左右)[14,15],且所得肽类分子较大,这在一定程度上抑制了龟肉肽类生物活性的发挥。本研究用复合酶酶解龟肉,通过工艺优化最大程度获得分子量较小的低聚肽,并通过分子对接技术模拟龟肉低聚肽与新冠肺炎病毒S蛋白的结合,以探究龟肉低聚肽抑制新冠肺炎病毒的潜能。
1 材料与方法
1.1 试剂与仪器
石金钱龟由广东省东莞市华南协同创新研究院提供;氢氧化钠、盐酸,均为分析纯,天津鼎盛鑫公司;木瓜蛋白酶、风味蛋白酶、中性蛋白酶、胰蛋白酶,均为食品级,北京鸿润宝顺科技有限公司;硼砂、十二烷基硫酸钠、邻苯二甲醛OPA,均为分析纯,天津福晨公司;1,4二巯基苏糖醇DTT、丝氨酸标准品,均为色谱纯,恒远博泰生物科技有限公司。
RT-6100全自动酶标仪,杜雷公司;AB104电子天平,瑞士梅特勒公司;数显PH计,上海雷磁;KD-10N真空冷冻干燥机,郑州科达;UV-1000紫外可见光光度计,上海仪电;HH-S21-4数显恒温水浴锅,上海博讯;TD5台式高速离心机,德国纳赫特;JJ-2高速组织捣碎机,常州亿通;SPX-250B-Z生化培养箱,上海双旭;THZ-100恒温振荡培养器,上海赫田。
1.2 实验方法
1.2.1 龟肉水解液的制备
龟肉蛋白的酶解工艺流程如下:
取肉→搅碎→调节料液比(1:6)→调节pH值→加酶→恒温密封酶解→沸水浴灭酶→低温高速离心→取上清液
将冷冻于-4 ℃的石金钱龟室温解冻,剔骨去皮,保留龟肉,准确称量龟肉,按料液比(1:6)加入蒸馏水,置于高速组织捣碎机搅拌至无相连龟肉纤维,制得龟肉原浆。取50 mL龟肉原浆于100 mL锥形瓶,用1 mol/L NaOH溶液和1 mol/L HCl溶液调节原液pH值,添加相应的蛋白酶,用保鲜膜封口后于55 ℃恒温振荡培养器保温酶解,期间保持pH恒定。酶解结束后于沸水浴中保温6 min,冷却至室温后于低温高速离心机8000 r/min 15 min,取上清液冷冻保存,已备后续水解度的测定。
1.2.2 龟肉蛋白液水解度的测定
本文采用邻苯二甲醛法(OPA法)进行龟肉蛋白液水解度的测定,并作了适当调整。OPA法测定步骤:标准溶液测定(ODcontrol):将400 μL丝氨酸标准溶液加入到一个装有3 mL OPA试剂的测试管中混合均匀(5 s)后精确静置2 min后立即读取340 nm的吸光值;空白试验(ODblank):吸取400 μL去离子水参照标准溶液测定进行;样品测定(ODsample):吸取400 μL样品溶液参照标准溶液测定进行。得出结果按公式(1)(2)(3)计算水解度。
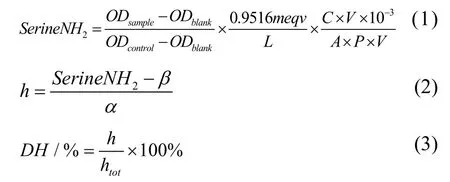
式中:
C——稀释倍数;
A——料液比0.167;
P——蛋白含量;
β——查表得0.40;
α——查表得1.00;
htot——查表得7.6。
1.2.3 酶组合的筛选
在参考现有研究[14,15]的基础上,选择了动物蛋白酶解常用的风味蛋白酶、中性蛋白酶、木瓜蛋白酶进行探究,且该三种酶的最适pH值和最适温度相近,便于酶解条件的控制。利用风味蛋白酶:木瓜蛋白酶=1:1、风味蛋白酶:中性蛋白酶=1:1、木瓜蛋白酶:中性蛋白酶=1:1三种酶组合进行酶解,酶解条件为:加酶量5%(m/V,两酶总质量/龟肉原浆)、pH 7、55 ℃、酶比例为1:1(酶解开始时同时加入)、酶解时间5 h,测定水解度,确定最适的酶组合。
1.2.4 单因素实验
取三份150 mL石金钱龟龟肉原浆,将酶配比设置为风味蛋白酶:木瓜蛋白酶=1:1、1:2、2:1,加酶量为3%、pH 7、55 ℃、酶解5 h,操作步骤按“1.2.1”,测定样品水解度,确定水解度最高的酶配比。取四份150 mL石金钱龟龟肉原浆,将加酶量设置为1%、3%、5%、7%,采用最适的酶配比,其他反应条件同上,进行水解反应,操作步骤按“1.2.1”,测定样品水解度,确定最适的加酶量。取四份150 mL石金钱龟龟肉原浆,pH设置为5、6、7、8,采用最适的酶配比和加酶量,其他反应条件同上,进行水解反应,操作步骤按“1.2.1”,测定样品水解度,确定最适pH值。取七份150 mL石金钱龟龟肉原浆,酶解时间设置为2、3、4、5、6、7,采用最适的酶配比、加酶量和pH值进行水解反应,操作步骤按“1.2.1”,测定样品水解度,确定最适水解时间。
1.2.5 正交实验设计
在单因素实验探究所得的最优酶解条件的基础上,对风味蛋白酶占比、加酶量、pH、时间四个因素设置更细致的梯度条件,以水解度为指标,进行L9(34)正交实验探究。试验因素与水平见表1。
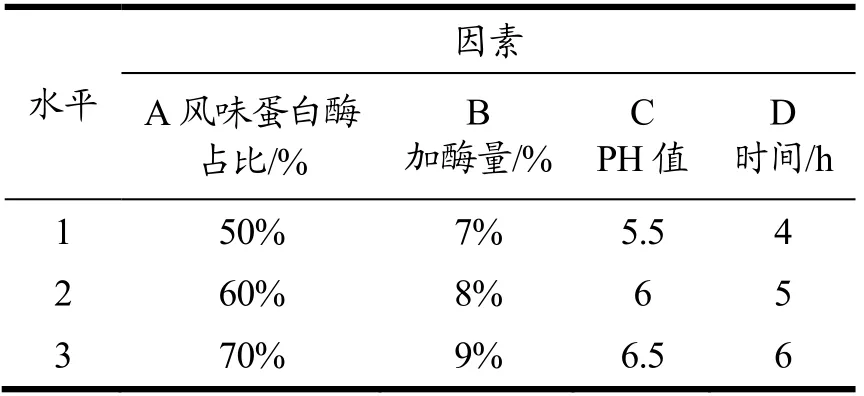
表1 因素水平表 Table 1 Factor and level for orthogonal experiment
1.2.6 UPLC-MS法分离龟肉低聚肽
利用高效液相色谱质谱联用法分离龟肉低聚肽并鉴定低聚肽结构。所用超高效液相色谱仪为Thermo Fisher Scientific TMQ Exactive,色谱柱为Aquity UPLC BEH C18色谱柱,粒径1.7 μm,质谱仪为组合型四级杆Orbitrap质谱仪。A相为0.1%甲酸水溶液,B相为0.1%甲酸乙腈溶液,进样量20 μL,流速0.3 mL/min,进样盘温度10 ℃。洗脱参数设置为0 min:95% A相、5% B相;30 min:60% A相、40% B相;30.1 min:95% A相、5% B相;35 min:95% A相、5% B相。检测波长:220 nm。质谱参数设置:正离子模式;Sheath gas flow rate:45 L/min;Aux gas flow rate:15 L/min;Sweep gas flow rate:2 L/min;雾化电压:3.50 kV;毛细管温度:320 ℃;S-lens RF level:55.0;Aux gas heater temp:350 ℃;扫描范围是200~3000m/z。获得样品的一级、二级质谱图。
1.2.7 Peaks Studio解析低聚肽序列
使用Peaks Studio X软件的DB search和de novo模块对质谱数据进行解析。DB search蛋白数据库来源为UniProt蛋白数据库(https://www.uniprot.org/)Plukenetia volubilis物种,DB search解析参数设置为:Parent Mass Error Tolerance 20.0×10-6,Fragment Mass Error Tolerance 0.1 u,Max Missed Cleavages 100。De novo解析参数设置为Parent Mass;Error Tolerance 20.0×10-6,Fragment Mass Error Tolerance 0.1 u。筛选出可信度大于95%的低聚肽序列进行后续分析。
1.2.8 Peptide Ranker生物活性评价
Peptide Ranker 是一种基于新型神经网络的生物活性肽预测服务器,用于预测低聚肽具有生物活性的概率[16]。低聚肽的生物活性用“Score”表示,数值越高,表示低聚肽的预测活性越高,选择“Score>0.5”的低聚肽进行后续的分子对接。
1.2.9 石金钱龟低聚肽与SARS-Cov-2 S蛋白活性结构域的分子对接
本研究用HPEPDOCK进行分子对接。HPEPDOCK是一种新颖的Web服务器,可通过分层算法将蛋白质-肽对接。HPEPDOCK并未进行冗长的模拟来精炼肽构象,而是通过MODPEP程序生成的肽构象的整体来考虑肽的灵活性[17],HPEPDOCK Web服务器可从http://huanglab.phys.hust.edu.cn/hpepdock/获得。先从PDB(https://www.rcsb.org/)中找出SARS-Cov-2病毒S蛋白的活性结构,其编号为7DWZ,EMData来源为EMD-30890。
1.2.10 数据处理
每次试验设3组平行,数据采用x±SD表示,用Excel、SPSS 9.0软件进行数据处理和图表制作。
2 结果与分析
2.1 酶组合的筛选
复合酶水解结果如图1所示,“风味蛋白酶+木瓜蛋白酶”组石金钱龟肉的水解度最高,为24.12%,高于“中性蛋白酶+风味蛋白酶”组合(21.92%)和“木瓜蛋白酶+中性蛋白酶”组合(16.61%)。“木瓜蛋白酶+风味蛋白酶”组合的水解度最高的原因可能是木瓜蛋白酶是内切的巯基蛋白酶,且酶切位点具有非特异性[18],使其酶切作用具备更多的可能性,从而能产生更丰富的短肽链。而风味蛋白酶同时具有外切和内切特性,酶切位点多样,有利于短肽的生成,且已有研究表明其对水产品的酶解效果较好[18]。因此选择“风味蛋白酶+木瓜蛋白酶”组合进行后续研究。
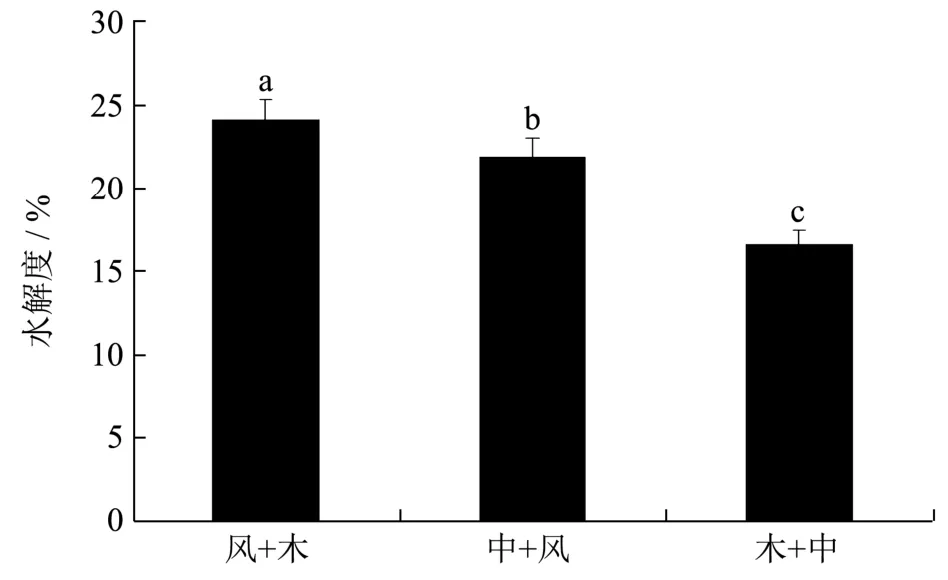
图1 复合蛋白酶对石金钱龟肉水解度的影响 Fig.1 Effect of combination of emzyme on degree of hydrolysis
2.2 单因素实验分析
2.2.1 酶配比对水解度的影响
风味蛋白酶与木瓜蛋白酶的不同酶配比对水解度影响如图2所示。由图2可知,风味蛋白酶:木瓜蛋白酶=1:1时水解度最高,为25.43%,与风味蛋白酶:木瓜蛋白酶=2:1时的水解度(24.81%)相近,但风味蛋白酶:木瓜蛋白酶=1:2时水解度明显下降。所以,选取风味蛋白酶:木瓜蛋白酶=1:1进行后续研究。
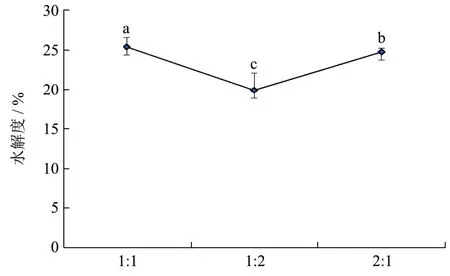
图2 复合酶的酶配比对水解度的影响 Fig.2 Effect of proportion of composite emzyme on degree of hydrolysis
2.2.2 pH值对水解度的影响分析
pH值对水解度影响如图3所示。随pH升高,酶解液的水解度呈先升高后下降的趋势,当pH=6时,水解度最高,为23.16%,当pH>6时水解度持续下降,可能是碱性环境破坏了酶的空间结构,亦可能是碱性环境抑制了酶活性,造成酶活性降低,从而影响水解过程[18]。

图3 pH对水解度的影响 Fig.3 Effect of pH on degree of hydrolysis
2.2.3 酶解时间对水解度的影响分析
本试验酶解时间对水解度的影响如图4所示,结果显示,龟肉酶解2 h~5 h的水解度逐渐增大,酶解时间为6 h时水解度最高,为24.82%,此阶段酶的作用位点较多,且活性中心并未饱和,6 h后,水解度轻微下降至20%左右,从而选择酶解时间6 h作后续研究。
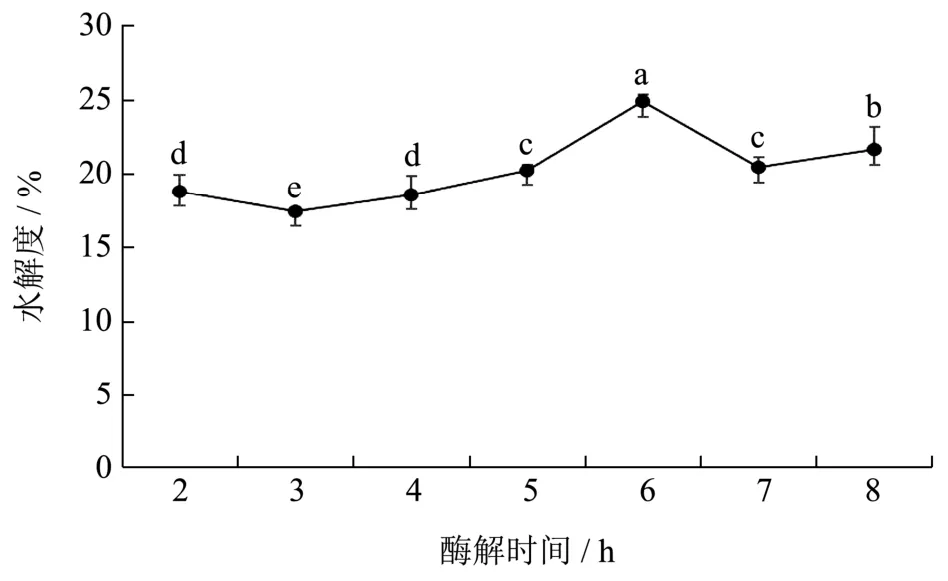
图4 酶解时间对水解度的影响 Fig.4 Effect of hydrolysis time on degree of hydrolysis
2.2.4 加酶量对水解度的影响分析
加酶量对水解度影响如图5所示,加酶量在7%以下时,水解度随加酶量的增加而呈上升趋势,说明酶解开始时,增加酶用量会增加酶与底物的接触率,促进水解反应。当加酶量为7%时,水解度最高,为27.78%,所以选择加酶量7%作后续研究。
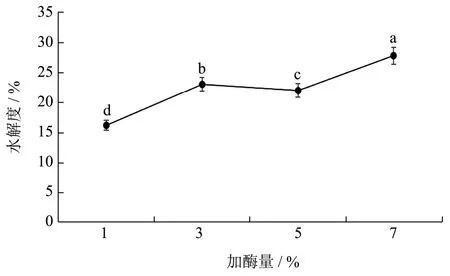
图5 加酶量对水解度的影响 Fig.5 Effect of hydrolysis time on degree of hydrolysis
2.3 正交实验结果分析
风味蛋白酶和木瓜蛋白酶的正交实验结果见表2。在单因素实验结果的基础上,本研究对四个因素设置了更细致的水平梯度,对酶解条件进行了进一步的优化。由表1和表2可知,各因素对水解度影响大小顺序为:风味蛋白酶占比>pH值>酶解时间>加酶量。在本实验中,最优方案为A3B1C1D1。则确定复合蛋白酶酶解石金钱龟肉的最佳工艺参数为:风味蛋白酶:木瓜蛋白酶=7:3、加酶量为7%、pH为5.5、酶解时间为4 h,通过验证实验得知此条件下的水解度为42.56%。该酶解效果大大优于现有研究中单一酶的水解效果,如张永进等[19]分别探究了复合蛋白酶、木瓜蛋白酶、胰蛋白酶对中华草龟龟肉和龟血的酶解反应,所得水解度约为20%;徐杰等[18]使用风味蛋白酶对珍珠龙胆石斑鱼肉酶解,5 h后其水解度仅为9.99%;陶美洁等[20]用风味蛋白酶、木瓜蛋白酶等4种酶分别酶解贻贝蒸煮液,所得的水解度最大为13.98%。可见,用单一酶对肉类蛋白进行水解时,水解度较低,且时间较长。而李军等[21]用碱性蛋白酶和风味蛋白酶等多种酶复配而成的复合蛋白酶对鲢鱼骨胶原蛋白进行水解,得到水解度高达49%,与本研究水解度测定的结果有一定相似性。
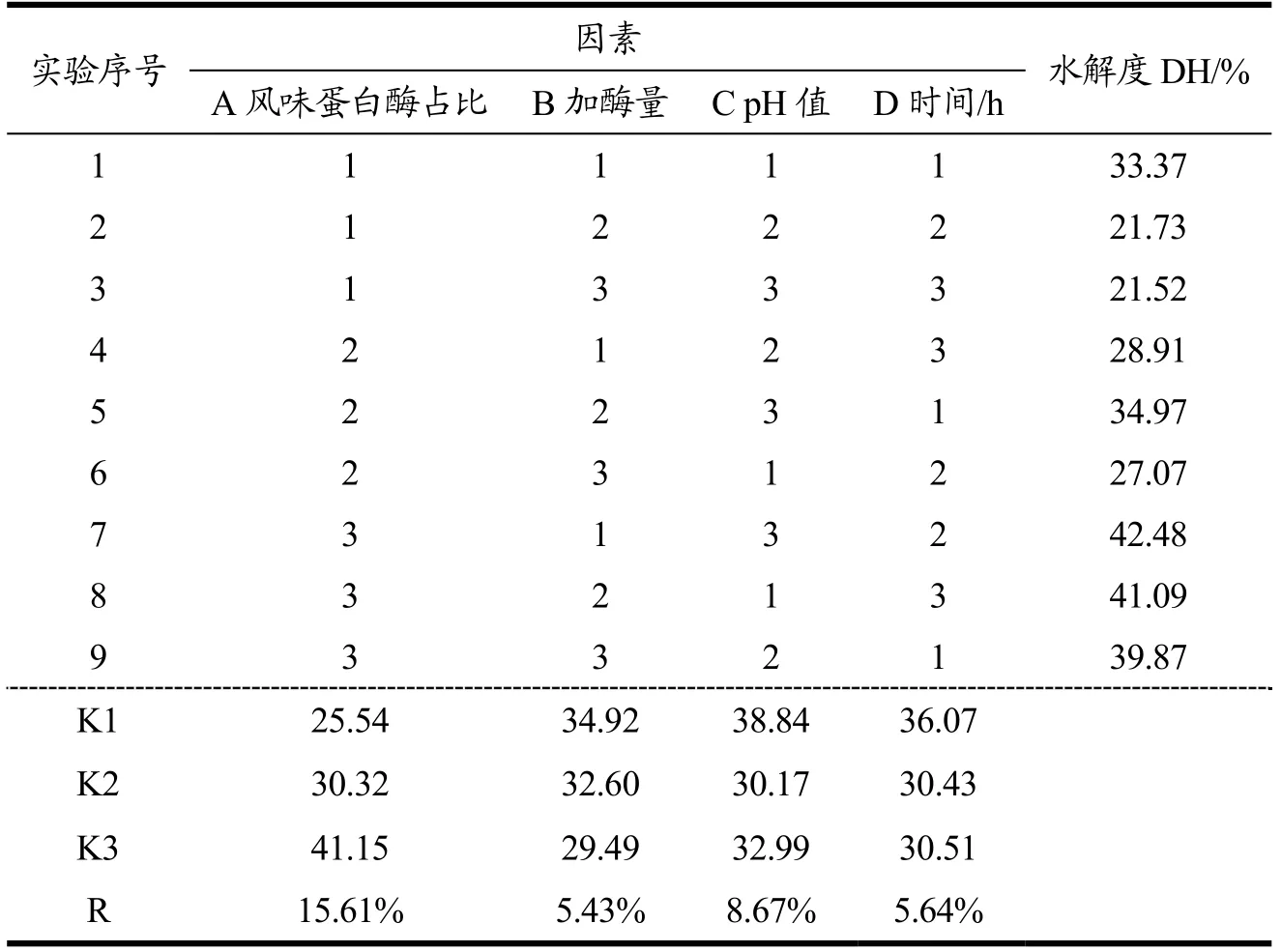
表2 正交实验结果 Table 2 Result of orthogonal experiment
2.4 HPLC-MS分离与de novo肽序列测定
利用高效液相色谱-质谱联用法对优化后的酶解低聚肽进行分离,可得质谱图(如图6所示)。把质谱数据导入Peak Studio 8.5软件进行de novo分析,可测得可信度(ALC)在50%以上的低聚肽序列共510条,肽链长度介于“四肽”至“十六肽”之间,低聚肽占比为89.7%。其中“ALC>95%”的低聚肽序列共20条,肽链长度介于“四肽”至“七肽”之间,低聚肽占比为100%。低聚肽是指由2~9个氨基酸脱水缩合而成的短肽,分子量一般在1000 u以下,与多肽相比,低聚肽有溶解性好,性能稳定,安全性高,更易吸收的特点。如二肽和三肽可以通过肠道内的PepT1和PepT2肽类转运系统直接吸收[22],四肽和五肽可以通过细胞旁路紧密连接途径运输[23],这样的吸收方式消耗能量更小。
图6 石金钱龟样品的高效液相色谱-质谱图 Fig.6 HPLC-MS diagram of Mauremys mutica peptide
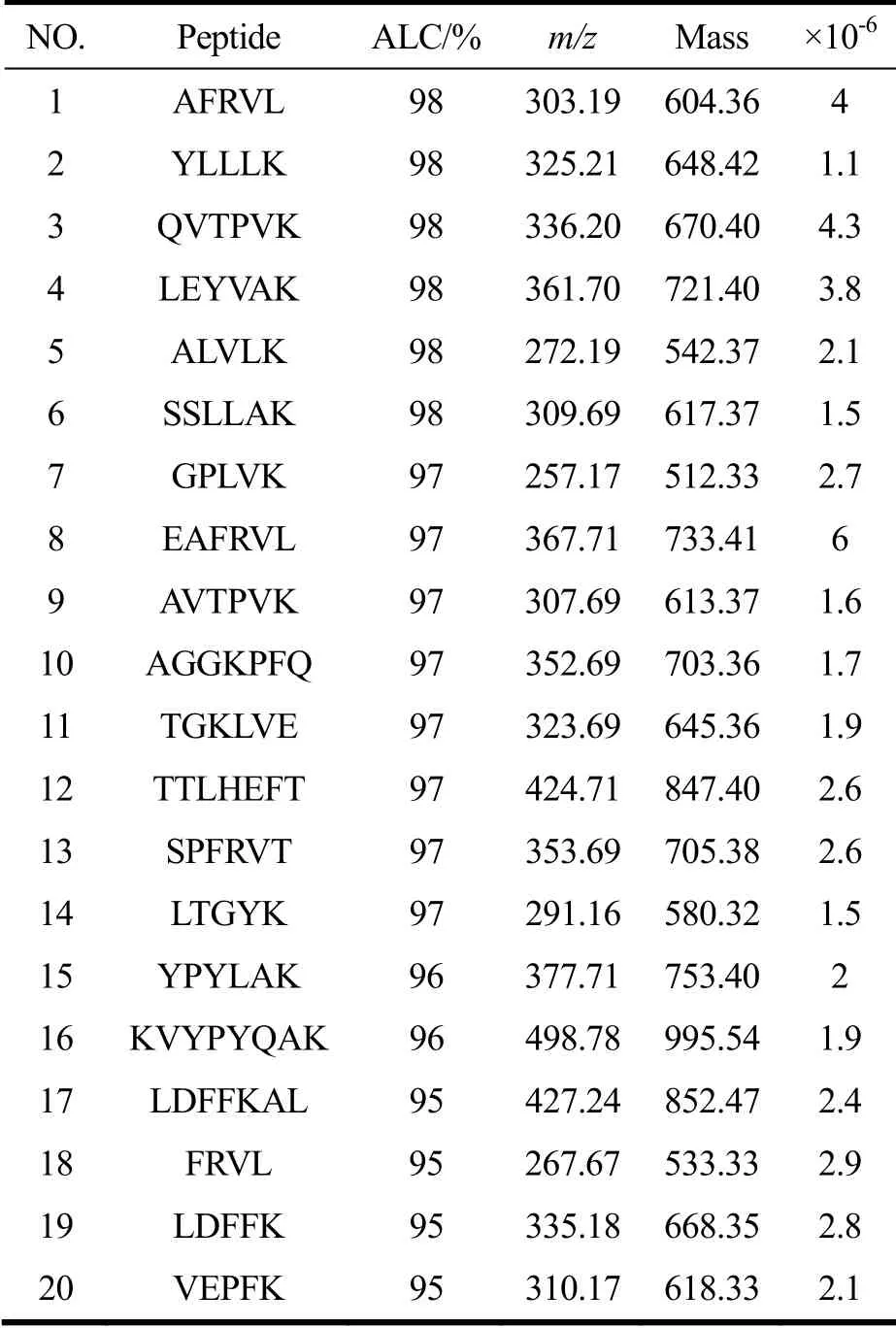
表3 De novo肽测序解析结果 Table 3 Peptide sequences determined by De novo
2.5 Peptide Ranker生物活性评价
利用Peptide Ranker平台对“ALC>95%”的20条低聚肽进行生物活性预测,按分数由高至低排列如下,Score>0.5的低聚肽共6条,占总数的30%,筛选出Score>0.5的低聚肽进行后续研究,肽序列分别为:LDFFK、LDFFKAL、FRVL、AFRVL、AGGKPFQ、SPFRVT。
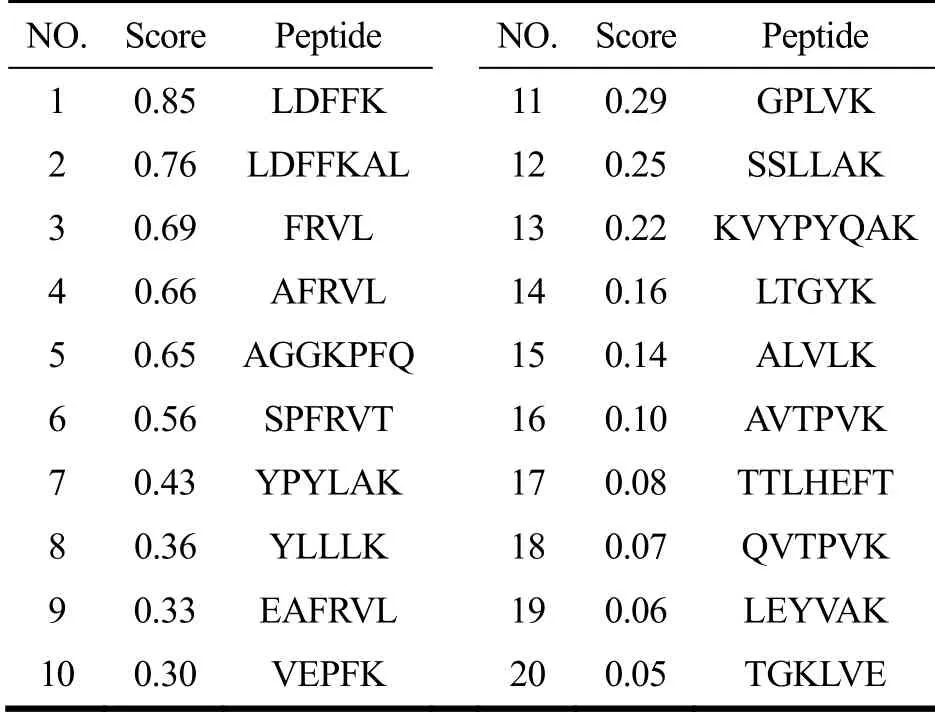
表4 肽序列的Peptide Ranker评分结果 Table 4 Peptide Ranker score of peptide sequences
2.6 龟肉低聚肽与S蛋白活性结构域的分子对接
S蛋白是存在于SARS-CoV-2病毒表面的蛋白结构域,S蛋白利用血管紧张素转换酶2(ACE2)作为细胞受体,在感染期间介导病毒和宿主细胞膜的融合,从而感染人体细胞[24]。由PDB(https://www.rcsb.org/)可知S蛋白的编号为7DWZ。该蛋白结构域由A、B、C三条低聚肽链组成,肽序列总长度为1283。利用HPEPDOCK服务器对“Peptide Ranker Score>0.5”的低聚肽进行分子对接,每个低聚肽的最佳对接模型如图7所示。
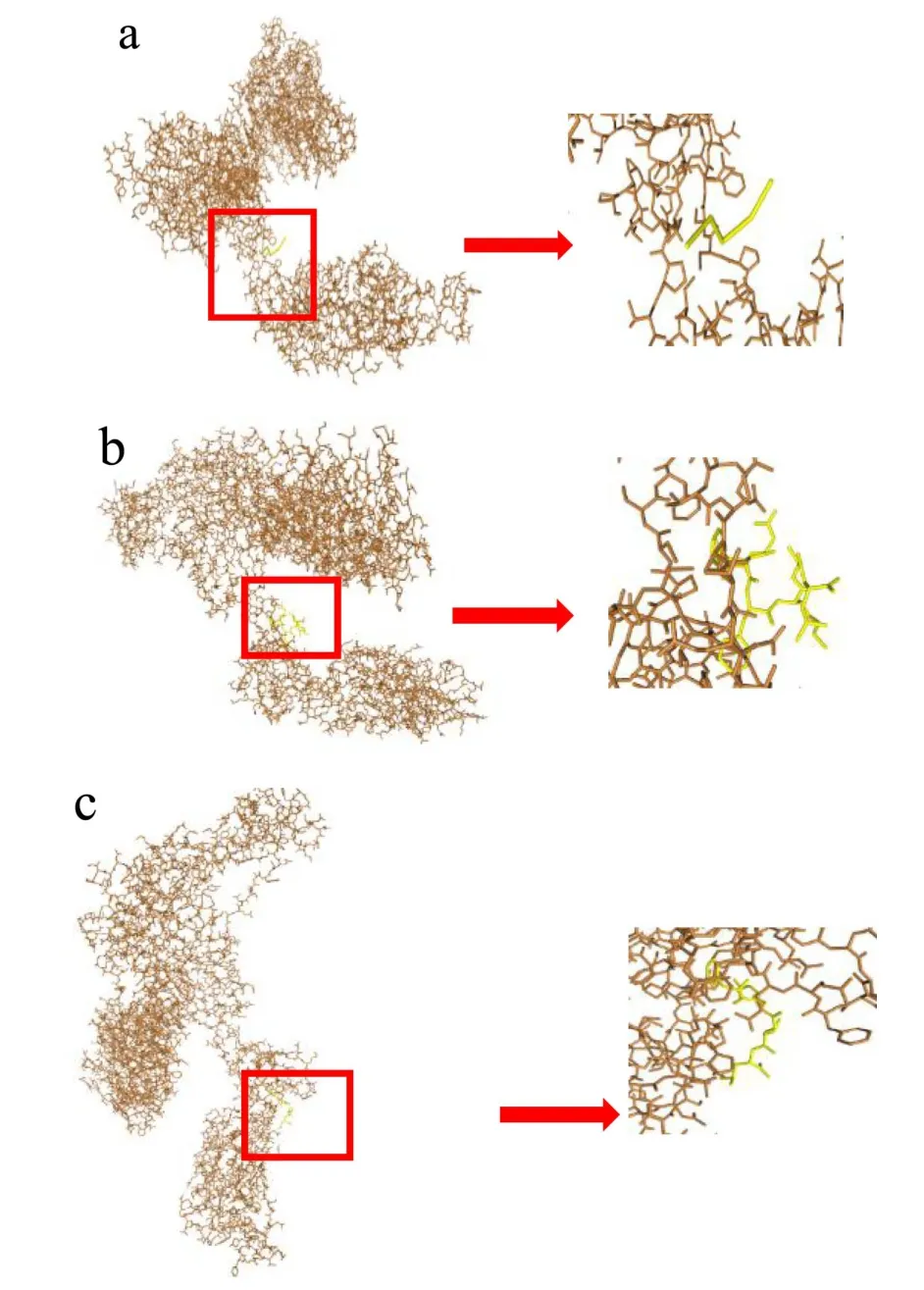

图7 肽序列与S蛋白分子对接构象 Fig.7 Docking image of peptides and S protein
龟肉低聚肽与S蛋白的分子对接能模拟龟肉低聚肽对S蛋白的结合方式,Docking Score是指该复合体的结合能,Docking Score越小,说明复合体越稳定,则该龟肉低聚肽对SARS-CoV-2 S蛋白的潜在抑制能力越强。6条低聚肽的Docking Score如表5所示,由表可知,6条低聚肽与S蛋白均有高亲和力(Docking Score<-100),其中LDFFK、LDFFKAL、FRVL、AGGKPFQ、SPFRVT与S蛋白具有极高亲和力(Docking Score<-140)。本团队前期以玉米、小麦、大豆、燕麦等7种植物为研究对象[25],仅发现与SARS-CoV-2病毒亲和力高的低聚肽(Docking Score<-140)14条,且亲和力最高的低聚肽VQVVN Docking Score仅为-152.4,其值高于本研究中的低聚肽LDFFKAL(Docking Score=-169.68),说明本研究的石金钱龟低聚肽抑制SARS-CoV-2病毒活性的潜能更大。
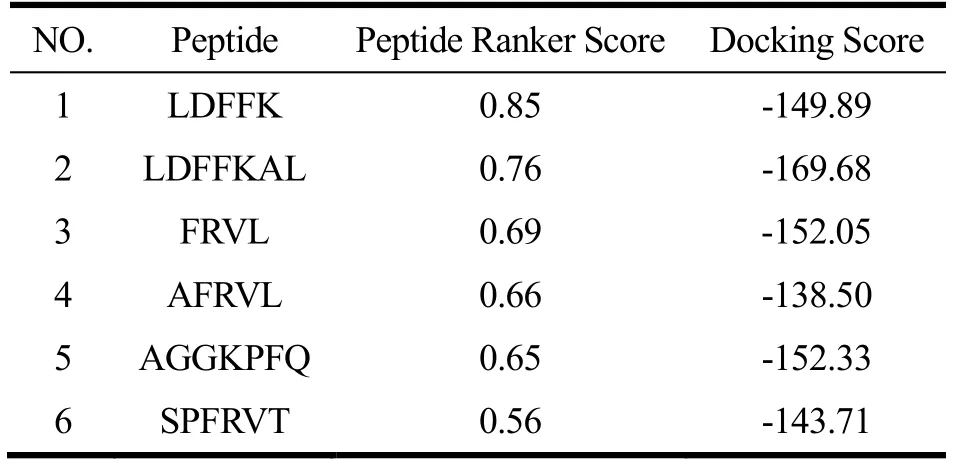
表5 肽序列的Docking Sore结果 Table 5 Docking Sore of peptide sequences
此前,很多学者也发现了能抑制某些病毒的低聚肽序列。如:SainZ等[24]对抑制肽的研究中指出,有Wimley-White界面疏水性的低聚肽可以防止非典型肺炎病毒(SARS-CoV)融合宿主细胞膜的糖蛋白融合;Struck等[26]明确指出,六肽“YKYRYL”可以抑制SARS-CoV病毒与ACE2受体结合,从而防止细胞被感染;Zhao等[27]发现多肽“NGAICWGPCPTA FRQIGNCGHFKVRCCKIR”有较好的对抗SARS-CoV病毒和MERSCoV病毒的活性。
3 结论
本研究首先通过单因素实验和正交实验摸索了石金钱龟龟肉蛋白的最佳酶解条件制备出了石金钱龟低聚肽,其最佳酶解条件为:风味蛋白酶:木瓜蛋白酶=7:3、加酶量为7%、pH为5.5、酶解时间为4 h,此时的水解度为42.56%,此水解度高于绝大多数同期的肉类水解的相关研究。然后,把石金钱龟低聚肽用HPLC-MS分离,结果导入Peaks Studio进行解析,可信度(ALC>95%)较高的低聚肽共20条,均为低聚肽。经过Peptide Ranker筛选得到6条低聚肽与SARS-COV-2棘突蛋白(S蛋白)进行分子对接,低聚肽序列分别是LDFFK、LDFFKAL、FRVL、AFRVL、AGGKPFQ、SPFRVT,其与S蛋白均表现出高亲和力(Docking Score<-100),Docking Score在-138.50~ -169.68之间。其中,LDFFKAL与S蛋白亲和力最高,Docking Score=-169.68。总的来说,经工艺优化后,本研究制得了水解度较高的石金钱龟龟肉酶解物,且从中筛选出的石金钱龟低聚肽与S蛋白的亲和力较高,有较强的抑制SARS-COV-2病毒作用的潜能,可作为SARS-COV-2病毒药物筛选的重点研究对象。
