玉米赤霉烯酮降解菌的筛选、鉴定及降解酶初步提取
2022-09-02刘晨谢岩黎曹荣耀程思忠
刘晨,谢岩黎,曹荣耀,程思忠
(河南工业大学粮油食品学院,河南省粮油食品安全检测与控制重点实验室,河南郑州 450001)
玉米赤霉烯酮(Zearalenone,ZEN)是一种类雌激素类真菌毒素,与动物内源性雌激素β-雌二醇结构相似,又称F-2毒素,是一种酚的二羟基苯酸的内酯结构[1,2]。ZEN不仅能够污染玉米,小麦和大豆等粮食作物,而且能够污染饲料,引发动物中毒,造成食品安全的问题。ZEN会造成生殖毒性、遗传毒性和免疫毒性等毒性作用,产生的毒性通过对机体的生殖功能和免疫机能等的抑制作用造成对动物与人类的健康的危害[3,4]。目前ZEN经常在食品和饲料中被检测出,因此找到一个安全、高效去除该毒毒性的方法尤为重要。
粮食在农田中、运输期间以及作为食品和饲料成品加工和储藏期间,都有可能出现被ZEN毒素污染的情况。在我国大部分地区农产品样品中,ZEN污染情况严重,检出率较高,而且由于ZEN热稳定性极强,不能通过常规处理完全清除[5]。因此ZEN可以在谷物类的成品食物中检测到,比如面包或馒头。武亭亭等[6]对粮食加工过程中ZEN的污染情况进行调查,检测结果显示玉米研磨加工中ZEN毒素检出率达34%;小麦粉中ZEN毒素检出率超出74%。
迄今为止,国内外对ZEN的脱毒方法主要包括物理法,化学法和生物法三大类[7,8]。物理法主要包括辐射法,特殊材料吸附法和色选法等,化学法主要是让ZEN与碱,氧化剂,有机试剂等发生化学反应,将ZEN转化成其他物质,降低毒性。目前化学法主要包括双氧水处理法,臭氧处理法,碳酸钠浸泡法等。虽然物理法和化学法可以达到一定的脱毒效果,但其仍然存在着一些不足比如脱毒产物不确定,脱毒效果不显著,也可能脱毒过程中损失许多重要营养物质,化学脱毒方法的缺点有脱毒不彻底,成本较高等等。生物法可以解决上述理化脱毒中存在的问题,生物法是在一种温和的环境下进行脱毒,不仅不会造成食品和饲料营养物质的损失,适口性的改变,也不会带来有毒有害的化学物质。生物法脱毒机理有两种方式:一种为微生物菌体吸附毒素,达到脱毒目的,其脱毒过程是微生物菌体可以吸附真菌毒素,形成稳定复合体,这一吸附方式的缺点是特异性较差,且过程是可逆的,受多种因素的影响;第二种脱毒方式是微生物在发酵过程中分泌了的代谢产物可以降解真菌毒素,微生物产生的代谢产物为胞内酶、胞外酶或次级代谢产物,可以使ZEN的毒性减弱甚至降解成为无毒的化合物。而且微生物生长速度很快,种类繁多,基因资源丰富,降解真菌毒素潜力巨大[9-11]。目前国内外已发现可降解ZEN的微生物主要有芽孢杆菌属[12-14]、酵母菌属[15]、乳酸菌属[16]和红球菌属[17]等菌株,对不动杆菌属降解ZEN鲜有报道。
目前常见的对蛋白质粗提取的方法为盐沉法。盐沉法最常见是逐步提高溶液中硫酸铵的浓度,使蛋白质的浓度逐步降低形成沉淀,以达到对蛋白质粗分离的目的。盐沉法的缺点使盐用量较大,容易造成蛋白失活。而单宁沉淀法是指单宁可以和蛋白质形成一种不溶于水的复合物,1 mol的单宁可以和12 mol的蛋白质结合[18],之后找到一种合适的解析剂将蛋白质从单宁-蛋白质的复合物中解析出来。通常会选择聚氧化乙烯、聚乙二醇和山梨糖醇作为解析剂实现蛋白质的解析。曲丽丽等[19]对微生物发酵液进行单宁沉淀后,使用了聚乙二醇作为解析液,成功的从沉淀中解析出了纤维素酶。
本研究旨在从微生物含量丰富的农田土壤中,分离、筛选出可以有效降解ZEN的菌株,初步探究降解机理,并使用单宁-聚乙二醇法进行粗蛋白的提取。为生物降解ZEN提供理论依据,为ZEN污染问题提供一种解决方案。
1 材料和方法
1.1 主要仪器和试剂
1.1.1 样品
采集河南省郑州市、濮阳市周边生长农作物的土壤,共计14份样品。
1.1.2 主要试剂和培养基
ZEN标准品纯度≥98%,上海源叶生物公司;单宁、聚乙二醇6000,上海生工生物工程股份有限公司;甲醇、乙腈色谱纯级,其余试剂均为国产分析纯;细菌微量生化反应管,杭州滨和微生物有限公司。
富集培养基:蔗糖10 g/L,磷酸二氢钾1.52 g/L,磷酸氢二钠2.44 g/L,硫酸镁0.20 g/L,硫酸铵0.50 g/L,胰蛋白胨5 g/L,琼脂20 g/L(固体培养基)pH 7.2。
初筛无机盐培养基:磷酸二氢钾1.52 g/L,磷酸氢二钠2.44 g/L,硫酸镁0.20 g/L,硫酸铵0.50 g/L,琼脂20 g/L(固体培养基)pH 7.2。
LB培养基:胰蛋白胨10 g/L,氯化钠10 g/L,酵母浸粉5 g/L,琼脂20 g/L(固体培养基)pH 7.2。
1.1.3 主要仪器设备
高效液相色谱,安捷伦科技有限公司;QL-861漩涡振荡器,海门市林贝尔仪器制造有限公司;LDZ立式高压蒸汽灭菌器,上海甲康疗器械厂;霉菌培养箱,上海齐客科学仪器;双功能气浴恒温振荡器,上海莱特实业发展有限公司;超声波细胞破碎仪,宁波新芝生物科技股份有限公司;氮吹浓缩装置,天津奥特赛思斯仪器有限公司;冷冻高速离心机,湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 ZEN的检测方法
样品中ZEN浓度经二氯甲烷提取回收后甲醇复溶,使用高效液相色谱法测定,色谱柱安捷伦ZORABX Ecliupse Plus 95A C18(4.6×250 mm,5 μm);流动相:(水:甲醇=20:80);流速:1.0 mL/min;柱温:35 ℃;进样量:20 μL;紫外检测器:波长236 nm。
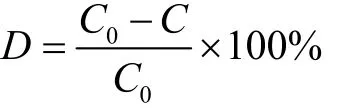
式中:
D——ZEN的降解率,%;
C0——空白对照组ZEN的浓度,μg/mL;
C——降解后ZEN浓度,μg/mL。
1.2.2 ZEN降解菌株的筛选
使用采集的土壤样品,称取10 g样品于锥形瓶中,加入90 mL无菌生理盐水,37 ℃恒温振荡3 h,取出后静置30 min。吸取1 mL上清液于10 μg/mL ZEN的液体富集培养基中,放置于37 ℃、160 r/min的恒温气浴振荡器培养48 h。吸取100 μL 10 μg/mL ZEN涂布至无机盐培养基中,待毒素晾干后,吸取100 μL富集培养后菌液涂布至含毒素的无机盐培养基,放置霉菌培养箱中37 ℃恒温培养,观察生长情况。将生长情况良好的菌落挑至LB固体培养基上,划线传代得到单一菌株。
将分离纯化出的单一菌株挑至LB液体培养基中,于160 r/min、37 ℃恒温发酵培养48 h,得到纯培养物的发酵液。移取发酵液950 μL于离心管中,加入50 μL 100 μg/mL ZEN毒素,涡旋30 s混合均匀,使降解体系中ZEN的终浓度定为5 μg/mL,以无菌培养基与ZEN混合作为空白对照。将离心管放置于恒温气浴摇床中培养,条件设为37 ℃、150 r/min、48 h,3组平行实验。取3倍体积二氯甲烷萃取,涡旋振荡2 min,弃去上层水相,将剩余二氯甲烷层放置于氮吹浓缩装置中37 ℃恒温缓慢吹干,吸取1 mL甲醇复溶残余物,涡旋振荡1 min,用0.22 μm有机相滤膜过滤,打入进样瓶中,使用高效液相紫外检测器检测。其中降解率最高的命名为A.lwoffi.Haut.1。
1.2.3 ZEN降解菌株的鉴定
形态及生化实验鉴定:将A.lwoffi.Haut.1在LB固体平板上划线,放置于37 ℃下培养24 h。观察其菌落的形态。沾取少量菌落,涂至载玻片上,对其进行革兰氏染色,于光学显微镜下观察菌体颜色及特征。使用无菌针挑取A.lwoffi.Haut.1的纯培养物,接种于不同种类的生化反应管中,于37 ℃培养48 h,测定糖、盐类、MR、VP、吲哚实验等12种生理生化指标,观察并记录结果。
16S rDNA鉴定:将A.lwoffi.Haut.1菌株划线分离出单一菌落,纯化培养后,对菌株的DNA进行提取与扩增。将得到的产物进行测序,测序得到的序列在NCBI数据库中进行比对分析,将比对分析出的数据使用Mega软件构建系统发育进化树。
1.2.4 ZEN降解菌株降解ZEN的动力曲线
取菌株发酵液950 μL与50 μL 100 μg/mL的ZEN混合,反应体系为1 mL,毒素终浓度为5 μg/mL。混合后于160 r/min、37 ℃培养,分别在0 h、6 h、12 h、24 h、36 h、48 h、60 h、72 h测定ZEN降解率。
1.2.5 ZEN降解菌株降解ZEN活性物质定位
将菌株发酵液在4 ℃、8000 r/min离心10 min,移取离心后的上清液于10 mL离心管中,放置4 ℃冰箱中保存,剩余沉淀菌体使用灭菌后的磷酸盐缓冲液(PBS)冲洗沉淀两次后,再次使用PBS缓冲液重悬,制成菌悬液。将菌悬液放置冰上,置于超声波细胞破碎器内,超声3 s,间隔3 s,持续15 min,然后12000 r/min冷冻离心20 min,取上清液用0.22 μm的抽滤器无菌抽滤得到滤液即为胞内提取物。分别取5 mL上清液进行121 ℃高温加热处理20 min,制得处理组1,加入蛋白酶K,浓度定为5 mg/mL,制得处理组2,加入5 mg蛋白酶K和0.05 g SDS制得处理组3,并对分别取950 μL菌株上清液、菌悬液、胞内提取物和处理组1、2、3与50 μL ZEN毒素标准液置于灭菌的10 mL离心管中,旋涡30 s,使ZEN终浓度为5 μg/mL。气浴摇床置于暗处,培养条件设置为150r/min、37 ℃、48 h,3组平行实验。反应结束后,测定降解率。
1.2.6 ZEN降解菌株降解酶的初步分离提取
取上清液100 mL于烧杯中,低温条件下缓慢加入研磨后的硫酸铵,硫酸铵最终浓度为60%,放入4 ℃冰箱过夜,12000 r/min冷冻离心10 min获得蛋白沉淀。沉淀重新溶解在5 mL磷酸(PB)缓冲液(20 mmol/L,pH 7.3)中,随后,样品用3 ku的透析袋4 ℃透析24 h,交换液为蒸馏水。取透析过的样品950 μL与50 μL ZEN毒素标准液置于灭菌的10 mL离心管中,旋涡30 s,使ZEN终浓度为5 μg/mL。反应48 h后,测定降解率。
分别吸取20 mL无细胞上清液于50 mL的离心管中,加入单宁使终浓度分别定为2、5、10、15、20 mg/mL,涡旋振荡2 min,静置提取2 h,4000 r/min冷冻离心10 min。取上清液950 μL与50 μL ZEN毒素标准液置于灭菌的10 mL离心管中,旋涡30 s,使ZEN终浓度为5 μg/mL。反应48 h后,测定降解率,确定出单宁沉淀的最佳浓度。选择最佳单宁浓度沉淀蛋白,然后分别加入6、8、10、12、14 mg/mL聚乙二醇溶液,涡旋振荡2 min,静置提取2 h,4000 r/min冷冻离心10 min。取上清液950 μL与50 μL ZEN毒素标准液置于灭菌的10 mL离心管中,旋涡30 s,使ZEN终浓度为5 μg/mL。反应48 h后,测定降解率,确定聚乙二醇解析单宁-蛋白质复合物的最佳浓度。
1.2.7 数据处理
采用Origin 2021软件进行分析
2 结果与分析
2.1 ZEN降解菌株的筛选
对14个土壤样品进行筛选,初筛得到14株菌株,可在ZEN为唯一碳源的培养基中生长,复筛得到6株菌株,可降解培养基中的ZEN。其中从河南省荥阳市小麦土壤中分离出的A.lwoffi.Haut.1降解率达到93.54%,其他菌株降解率如表1所示。图1为A.lwoffi.Haut.1降解ZEN的HPLC色谱对比图,由图1可知,该菌株与ZEN共同培养48 h后,ZEN峰(5.21 min)显著降低。因此,选择A.lwoffi.Haut.1进行后续的研究。
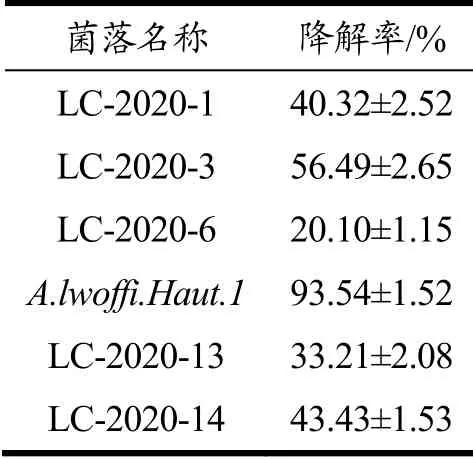
表1 分离来自不同样品的降解ZEN的菌株 Table 1 Isolation of ZEN degrading strains from different samples
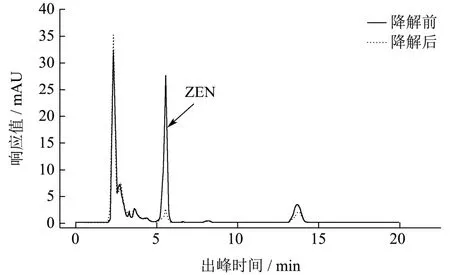
图1 A.lwoffi.Haut.1降解ZEN前后的HPLC色谱对比图 Fig.1 HPLC chromatographic contrast of A.lwoffi.Haut.1 before and after degradation of ZEN
2.2 ZEN降解菌株的鉴定
如图2所示,A.lwoffi.Haut.1在LB培养基上涂布培养24 h的菌落形态:菌落形状呈褶皱、低凸起、边缘波浪状,菌落颜色为不透明灰白色。革兰氏染色结果为阴性菌,在显微镜下,呈短棒状,符合不动杆菌形态。采用各种细菌微量生化反应管结果显示,A.lwoffi.Haut.1能够利用葡萄糖,其余葡萄糖酸盐、枸椽酸盐、甘露醇、木糖、山梨糖、蔗糖利用为阴性,过氧化氢酶实验、硝酸盐还原实验、VP实验、MR实验和吲哚实验为阴性。与鲁氏不动杆菌生理生化特征相似度很高[20]。
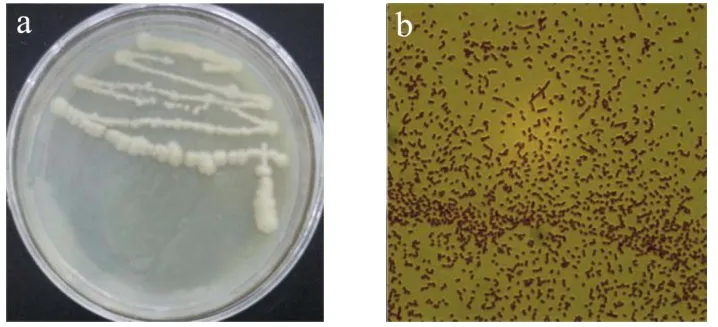
图2 A.lwoffi.Haut.1的菌落形态及革兰氏染色情况 Fig.2 Colony morphology and Gram staining of A.lwoffi.Haut.1
对A.lwoffi.Haut.1的16S rDNA基因序列进行扩增,序列如图3所示全长约为1300 bp,测序后,将得出的结果在NCBI数据库中进行BLAST分析比对,结果显示,该菌株与鲁氏不动杆菌的16S rDNA基因序列相似度高达99.90%。由图4所示,系统发育树中该菌株与鲁氏不动杆菌在同一分支上。通过生理生化特征和16S rDNA基因序列分析可初步鉴定A.lwoffi.Haut.1为鲁氏不动杆菌。
图3 A.lwoffi.Haut.1 16S rDNA PCR产物电泳 Fig.3 A.lwoffi.Haut.1 strain 16S rDNA PCR product electrophoresis

图4 A.lwoffi.Haut.1的系统发育树 Fig.4 Phylogenetic tree of A.lwoffi.Haut.1
2.3 ZEN降解菌株降解ZEN的动力曲线
由图5可知,随着时间的增加,菌株发酵液的ZEN降解率不断增大,在24 h时,降解率可达83.99%,在36、48、60和72 h时,ZEN降解率分别为90.46%、93.54%、94.06%和94.56%,在36 h之后,降解率稳定在90%以上。因此,最佳反应时间为36 h。
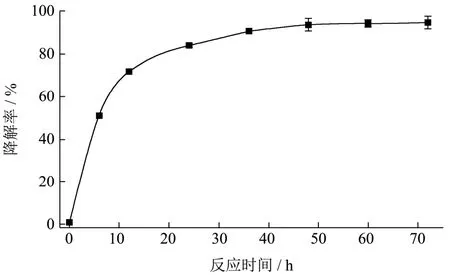
图5 A.lwoffi.Haut.1降解ZEN的动力曲线 Fig.5 Kinetic curve of ZEN degradation by A.lwoffi.Haut.1
2.4 ZEN降解菌株降解活性物质的定位
由图5可知,振荡培养48 h后,A.lwoffi.Haut.1菌液的降解率为93.54%,同批次菌液制备出的无细胞上清液、菌悬液和胞内提取物对ZEN的降解率分别为82.31%、21.33%和6.67%。对无细胞上清液进行加热(处理组1)、蛋白酶K(处理组2)和蛋白酶K+SDS处理(处理组3)。由图5可知,处理组1、2和3对ZEN降解率分别为20.10%、41.67%和18.68%。魏单平等[13]分离出一株解淀粉芽孢杆菌,菌株的发酵液和上清液对ZEN降解率为95.60%和68.93%,经加热、蛋白酶K和蛋白酶K+SDS处理后,上清液降解活性下降,推断降解活性物质主要为胞外酶。本研究结果说明,A.lwoffi.Haut.1的降解活性物质主要集中在无细胞上清液中。将无细胞上清液进行不同处理后,降解率均出现明显下降。因此推断无细胞上清液中的降解活性物质主要是菌体分泌到体外的某种蛋白,并具有一定的耐热能力。具体主要降解活性物质有待后续研究。
2.5 ZEN降解菌株降解酶的粗提取
盐沉法中使用60%的硫酸铵沉淀得到的蛋白中ZEN降解酶含量较少或活性丧失比较严重,降解率为20.30%。
由图6可知,随着单宁浓度的不断增加,单宁沉淀后的上清液对ZEN的降解率不断下降,当单宁浓度为15 mg/mL时,上清液降解率为12.33%,并在此之后降解率下降变的缓慢。结果说明,单宁浓度为15 mg/mL时,单宁对降解酶的沉淀最为完全。
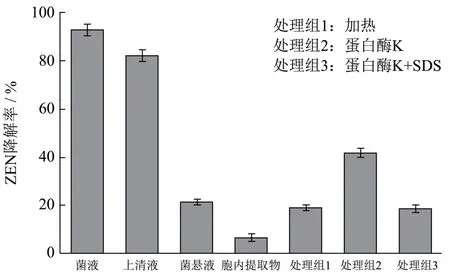
图6 A.lwoffi.Haut.1的菌液、培养上清液、菌悬液、胞内提取物和处理组1、2、3对ZEN的降解率 Fig.6 A. loffi.Haut.1, culture supernatant, suspension, intracellular extract and treatment groups 1, 2 and 3 to the degradation rate of ZEN
单宁沉淀时,选定最佳浓度15 mg/mL,沉淀采用不同浓度的聚乙二醇溶液解析。由图6可知,当聚乙二醇溶液浓度为10 mg/mL时,解析出的上清液降解率为64.33%,之后随着浓度增大,降解率出现了轻微下降的趋势。曲丽丽[19]使用硫酸铵沉淀法、单宁-聚乙二醇沉淀法和超滤法进行黑曲霉发酵液中纤维素酶的提取,对比结果显示,硫酸铵盐沉法容易导致酶失活,且盐用量较大,超滤法中膜易受污染,单宁-聚乙二醇法有着方便和快捷的优点,并且提取酶活率高达93.50%。本研究结果说明,硫酸铵盐沉法很容易造成A.lwoffi.Haut.1降解酶的失活,因此采用单宁-聚乙二醇沉淀法提取降解酶,当单宁浓度为15 mg/mL,聚乙二醇溶液浓度为10 mg/mL时,解析出的降解酶活性较高,随着浓度增大,出现降解率下降的现象,初步推断为,聚乙二醇的浓度过大导致影响降解酶的降解效果。
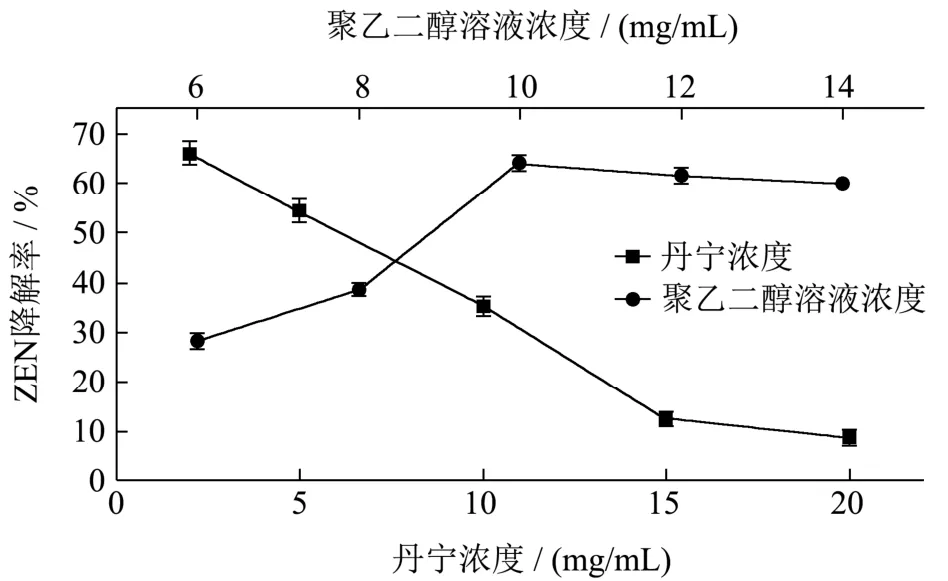
图7 不同单宁浓度沉淀后与不同聚乙二醇溶液浓度解析后上清液的降解率 Fig.7 Degradation rate of supernatant after precipitation with different tannin concentration and resolution with different polyethylene glycol solution concentration
3 讨论
相对比邓桃等[21]筛选出的一株对ZEN降解率最高为85.77%的醋酸钙不动杆菌,魏单平等[13]分离出一株解淀粉芽孢杆菌,菌株的发酵液和上清液对ZEN降解率为95.60%和68.93%,本研究获得的菌株对ZEN降解率最高为93.54%,降解效果较好,并且该菌株的无细胞上清液降解率为82.31%,证明上清液中胞外酶活性较高。因此,该菌株有利于后期对降解酶的提取。有研究表明不动杆菌具有代谢多种有机化合物的能力,被认为具有巨大的生物技术潜力[22-24],并且已知不动杆菌菌株通常容纳大量的可移动元素,包括不同大小的质粒[22]。质粒除了能够进行自我复制和传播编码模块外,还可以携带不同数量的基因,使宿主细胞能够在一种对生长具有致命性或限制性的环境中生存。
4 结论
本研究中所获得的鲁氏不动杆菌为玉米赤霉烯酮的生物脱毒提供了新的研究材料,在本研究的基础上,我们将进一步对降解产物进行结构鉴定和毒性研究,并且对降解粗蛋白进行分离纯化以及对降解基因进行挖掘研究。
4.1 本研究中从河南郑州市、濮阳市周边耕地的土壤样品中筛选出一株能够高效降解ZEN的菌株A.lwoffi.Haut.1,经形态、生理生化鉴定和16S rDNA鉴定为鲁氏不动杆菌。
4.2 该菌株在pH 7.2的LB培养基中37 ℃、150 r/min培养48 h后,对初始浓度为5 μg/mL的ZEN降解率为93.54%。
4.3 菌株的降解活性定位实验结果表明,该菌株的上清液具有较强的降解效果,通过对无细胞上清液的加热、蛋白酶K和蛋白酶K+SDS,无细胞上清液降解ZEN能力下降明显,结果表明,上清液中降解ZEN的活性物质是某种或者多种未知的酶。
4.4 使用单宁-聚乙二醇法和盐沉法对无细胞上清液进行降解粗蛋白的提取,结果表明,60%硫酸铵沉淀得到的蛋白,ZEN降解率为20.30%,提取出有活性的降解酶较少。当单宁浓度为15 mg/mL,聚乙二醇溶液浓度为10 mg/mL时,提取效果最好,提取出的上清液降解率为64.33%。在蛋白提取中,可能损失一定量的降解活性物质,本研究证明提取出粗蛋白的上清液降解率与无细胞上清液降解率相比出现了一定的下降。
