等离子体处理对小米内源酶活性及其品质的影响
2022-09-02秦嘉乐李重言刘茜张颖汪浪红曾新安
秦嘉乐,李重言,刘茜,张颖,汪浪红,2*,曾新安
(1.西北大学食品科学与工程学院,陕西西安 710069)(2.佛山科技学院广东省食品智能制造重点实验室,广东佛山 528225)(3.华南理工大学食品科学与工程学院,广东广州 510640)
小米(foxtail millet,Setaria italica)又名粟米,具有悠久的种植历史,目前是我国尤其是北方地区重要的杂粮作物之一[1]。小米营养成分丰富,富含膳食纤维、不饱和脂肪酸、矿物质、维生素和一些植物化学物质,有益健康[2]。据报道,小米具有多种健康功效,如健胃、促进消化吸收的作用,抗氧化、抗炎[3,4]。另外小米还可用于II型糖尿病和心血管疾病的治疗[5]。随着饮食观念的转变和营养知识的普及,小米等杂粮越来越受人们的青睐。
食用或者加工用的小米须经脱壳处理,然而失去外壳的小米储存稳定性严重下降,易褪色并产生陈化气味,严重影响其外观和营养价值。研究表明,小米陈化是外界环境与自身成分相互作用的结果,其中内源性的酶-脂肪酶与脂氧合酶催化脂质的水解与氧化是小米陈化过程中容易发生的问题之一[6,7]。小米中所含的脂质较高(>4%),且多不饱和脂肪酸的含量约占85%,远高于玉米和大米等作物的含量[8]。脂肪酶能够将小米中的脂肪分解成游离脂肪酸,进而降低小米的pH值,使其发生酸败出现酸涩味[9];脂氧合酶是一种含血红素铁的蛋白质,可氧化1-顺、4-顺戊二烯结构的多不饱和脂肪酸,通过催化小米中的亚油酸、亚麻酸等不饱和脂肪酸,并与共轭二烯形成氢过氧化物,同时释放出高活性的氧自由基偶联小米色素并使其氧化,从而导致小米褪色并产生陈化气味[10,11]。因此探究有效的处理方法钝化小米中的脂肪酶与脂氧合酶对于稳定小米在贮藏过程中的品质,促进小米产业的健康发展具有重要意义。
近年来,非热等离子体(Non-thermal Plasma)在食品加工过程中的运用被广泛关注[12-14]。等离子体主要由正离子和负离子、自由基、电子以及原子的激发态或基态组成,其中自由基等一些活性成分能够对食品中的酶和微生物具有杀灭和钝化作用[15-17]。例如等离子体能够钝化果蔬中的多酚氧化酶抑制其发生酶促褐变的程度[13,18]。然而该技术对小米中脂肪酶和脂氧合酶的活性及其品质的作用暂未见相关报道。本研究拟以陕西榆林米脂小米为原料,从脂肪酶与脂氧合酶活性变化、小米的外观包括色泽、形态和类胡萝卜素含量变化等角度,探究空气非热等离子体技术对小米内源酶活性及外观品质的影响,以期提供一种延缓小米陈化,稳定其品质的新手段,为实际运用提供理论依据和技术支持。
1 材料与方法
1.1 原料与试剂
陕西榆林米脂小米(秦谷4)为当年产,采购于当地市场。
亚油酸,美国Sigma公司;2,2-联苯基-1-苦基肼基(DPPH)和对硝基苯酚月桂酸,上海阿拉丁试剂;丙二醛(malondialdehyde,MDA)检测试剂盒,北京索莱宝科技有限公司。
1.2 主要的仪器与设备
CTP-2000 K等离子体设备(配有DBD-50反应器),南京苏曼有限公司;VS450非接触式色差仪,美国Xrite公司;UV-1800岛津紫外可见分光光度计,日本岛津公司;扫描电子显微镜,日本日立公司。
1.3 试验方法
1.3.1 小米的DBD-等离子体处理
选取大小颜色均匀、颗粒饱满的小米颗粒于不同电压(0、15、25和35 kV)下处理0、2、4、8和12 min,其中放电间距为7 mm。
1.3.2 脂氧合酶活性测定
脂氧合酶活性测定参照Tolouie等[19]的方法进行。取0.5 mL吐温-20溶解于pH 9.0的0.1 mol/L硼酸缓冲液10 mL中,逐步滴加0.5 mL亚油酸并充分混匀;加入1.3 mL 1.0 mol/L NaOH,搅拌,得到透明的溶液;加入90 mL硼酸缓冲液,用蒸馏水定容至200 mL,即为亚油酸底物溶液。
称取不同处理的小米粉样品1.0 g,加入5.0 mL 0.1 mol/L的磷酸缓冲液(pH 7.0)充分混合,置于摇床中室温下振荡2.0 h,然后在4 ℃条件下12000 r/min离心10 min,上清液即为粗酶提取液。取1.7 mL 0.1 mol/L磷酸缓冲液(pH值7.0)、0.2 mL亚油酸底物于试管中,30 ℃恒温水浴2 min;加入0.1 mL粗酶提取液,反应1 min后立即沸水浴3 min终止反应,于234 nm处测定不同样品的吸光度,并分析脂氧合酶相对活性的变化。
1.3.3 脂肪酶活性测定
根据Godoy等[20]报道的方法对小米中的脂肪酶进行提取。将1.0 g小米粉末转移到50 mL的离心管中,加入5.0 mL 0.1 mol/L磷酸缓冲液(pH 7.0)充分混合,置于摇床中室温下振荡2.0 h,离心收集上清液。在2.0 mL 420 μmol/L对硝基苯酚月桂酸底物溶液中加入1 mL提取的酶液,反应1 min后沸水浴3 min终止反应,并测定不同样品体系在410 nm波长下吸光度,根据处理前后组吸光度的变化,分析脂肪酶的相对活性变化。
1.3.4 小米色度的测定
采用非接触式色差仪测定小米色度。将小米装入已校准的色差仪样品盒中进行测量。试验采用L与b*值作为反映小米色度的指标。
1.3.5 小米黄色素的测定
将不同处理的小米进行充分碾磨,称取小米粉样品0.50 g于10 mL离心管中,加入6.0 mL水饱和正丁醇,置于室温下振荡2.0 h。将样品于8000 r/min条件下离心10 min,取上清液。用水饱和正丁醇作对照,测定样品在450 nm处吸光度[7]。
1.3.6 DPPH自由基清除测定
称取不同处理的小米粉样品6 mg溶解于2.0 mL 70%乙醇中,分别加入2.0 mL DPPH 0.1 mmol/L(以95%乙醇溶解),混匀,避光反应1 h,于517 nm处测定不同样品吸光度,同时以2.0 mL 70%乙醇加2.0 mL样品作空白对照,对照品的吸光度减去样品的吸光度,再除以对照品的吸光度,即得到清除DPPH自由基的百分比[19]。
1.3.7 丙二醛含量检测
采用丙二醛检测试剂盒(北京索莱宝科技有限公司)测定不同处理下小米中丙二醛含量。方法如下:0.1 g小米粉与1.0 mL提取液充分混合,冰水浴孵育30 min后,8000 ×g离心10 min,保留上清液,按说明书中的方法测定MDA浓度。
1.3.8 小米形态观察
等离子体处理前后的小米经固定、镀金后置于扫描电子显微镜下进行表面微观结构观察(图像倍数60)。
1.3.9 统计分析
所有数据均以Origin Pro 8作图,采用SPSS Statistics 22作数据分析分析,结果用平均值±标准差来表示,每组试验平行3次。
2 结果与讨论
2.1 等离子体处理对小米脂氧合酶和脂肪酶的钝化作用
由图1a可以看出,经空气等离子体处理,小米中脂氧合酶的相对活性随着等离子体处理的电压和时间逐步降低,具有显著性(p<0.05),例如处理电压为25 kV时处理2 min后,脂氧合酶相对活力为79.22%,当处理时间增加至4、8、12 min时,其活力降低至68.59%、58.22%和31.15%,说明等离子体处理对小米中的脂氧合酶具有显著的钝化作用。类似地,Amanpour等[21]发现空气等离子体处理能够钝化橄榄油中的脂氧合酶,例如处理2 min后,橄榄油中的脂氧合酶活性可降低42.90%,另外,Tolouie等[19]研究发现等离子体处理对小麦胚芽脂氧合酶也有一定的钝化作用,然而在该研究中脂氧合酶的活性较为稳定,例如24 kV处理条件下处理5 min后其失活率仅为7.70%;处理时间为25 min时,失活率可达50.02%,该结果可能与等离子体设备之间差异或者食品体系不同有关。
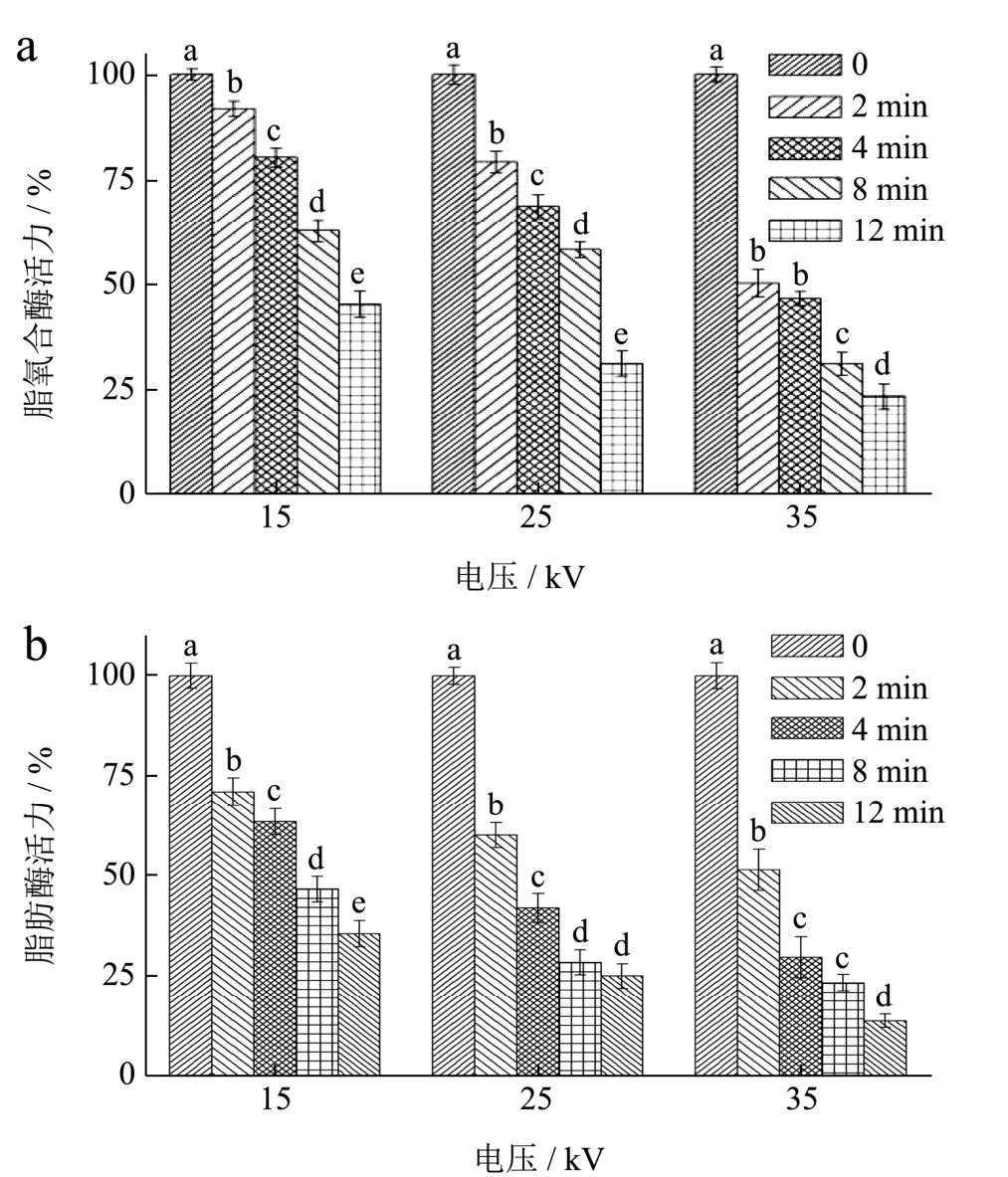
图1 等离子体在不同电压与处理时间下对米脂小米脂氧合酶(a)和脂肪酶(b)活力的影响 Fig.1 Effects of DBD-ACP on the activity of millet lipoxygenase (a) and lipase (b) under different voltage and treatment time
图2b为米脂小米脂肪酶在等离子处理下的失活作用。从图中可以看出,随着处理时间的增加,脂肪酶活力迅速下降(p<0.05)。此外,随着电压的增加,失活率也有所提升。例如经等离子处理4 min,小米脂肪酶的失活率在15、25和35 kV条件下分别为36.42%、57.84%和70.12%。通过图1和图2的结果可以看出,等离子体对小米的脂氧合酶与脂肪酶均具有良好的钝化作用。等离子体钝化这两种酶的潜在作用机理可能与处理过程产生的自由基物质有关,即空气中氧气和氮气经过电离会产生活性氧、活性氮等成分,它们能够与酶分子的侧链反应会进而引起其构象发生改变(α-螺旋结构损伤)[22,23]。值得注意的是等离子体对这两种酶的钝化作用显然不同,其中脂氧合酶的失活过程较为缓慢,在25 kV处理8 min和12 min后,失活率分别为41.78%和68.85%;相比之下,同样的电压和处理时间下,脂肪酶失活率可达71.73%和74.78%。Srivastava等[24]利用不同的方式(直接蒸干、滚筒干燥、流化床干燥)处理小麦胚芽,并且比较了这三种方式处理对脂氧合酶与脂肪酶的钝化作用,结果发现在这三种方式处理下,脂肪酶的失活率都显著高于脂氧合酶。由此可以推断这两种酶的稳定性可能存在一定的差异,其中脂氧合酶的结构可能比脂肪酶更为稳定,不易被失活。
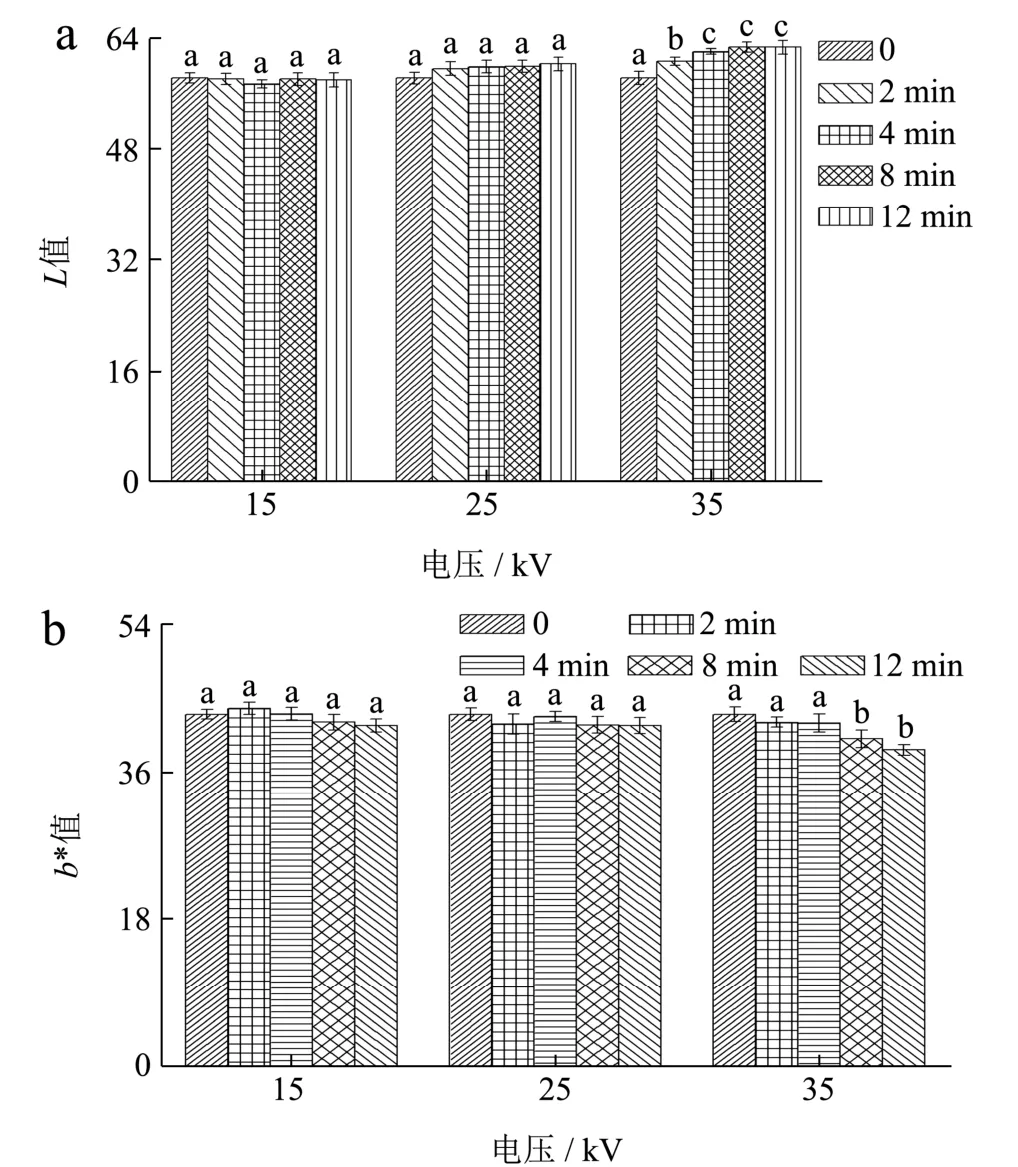
图2 等离子体对小米的L值(a)与b*值(b)的影响 Fig.2 Effects of DBD-ACP on L value (a) and b* value (b) of millet
2.2 等离子体处理对小米色度的影响
在CIELAB表色系统中,L和b*分别表示被测对象的亮度和彩色(黄色)指数。本实验中,小米样品的L值越大,表示小米外观越亮,反之越暗;b*越大则表示颜色越黄。图2a可以看出,等离子体在15 kV电压条件下随着处理时间的延长,小米的L值没有显著变化(p>0.05);当处理电压为25 kV时,随着时间的延长,L值出现轻微上升的趋势(58.27至60.35),差异不显著(p>0.05);同样,在15 kV和25 kV处理下,小米b*的变化也不显著(图2b)(p>0.05),说明15 kV和25 kV条件下处理2~12 min对小米的色度影响甚微。然而,在35 kV电压下,L值从58.31增加至62.74,b*值则从43.06降低至38.74,两者变化显著(p<0.05),表明处理电压过大可一定程度上影响小米的正常颜色。Gu等[25]研究发现香蕉片经等离子体处理(40 kV)后导致的L值增加,而b*未见显著变化,与本研究存在一定的差异性,表明等离子体在较高电压对色泽的影响与食品体系直接相关。
2.3 等离子体处理对小米黄色素的影响
类胡萝卜素是小米黄色素的主要成分,其具有很好的营养学功能,同时也是反应小米品质优劣的重要指标[26]。小米中黄色素在445 nm~450 nm吸光度最大,在此范围内的吸光度可以在一定程度上定性的反应其含量。图3为等离子体在不同处理电压与时间下小米黄色素吸光度的变化。从图中可以看出,在15 kV和25 kV条件下,随着电压与处理时间的延长,小米的黄色素吸光度变化不显著(p>0.05),说明此条件对小米黄色素的破坏较小;而当处理电压达到35 kV,小米的黄色素吸光度从0.65变化至0.52,显著降低(p<0.05),该结果与小米的色度变化具有一定的一致性,表明小米色素在一定程度上遭受了破坏。Paixão等[27]发现等离子可引起siriguela果汁中类胡萝卜素的降解,因此可以推测小米黄色素破坏与等离子体处理后产生的氧和氮自由基介导的类胡萝卜素的降解有关。
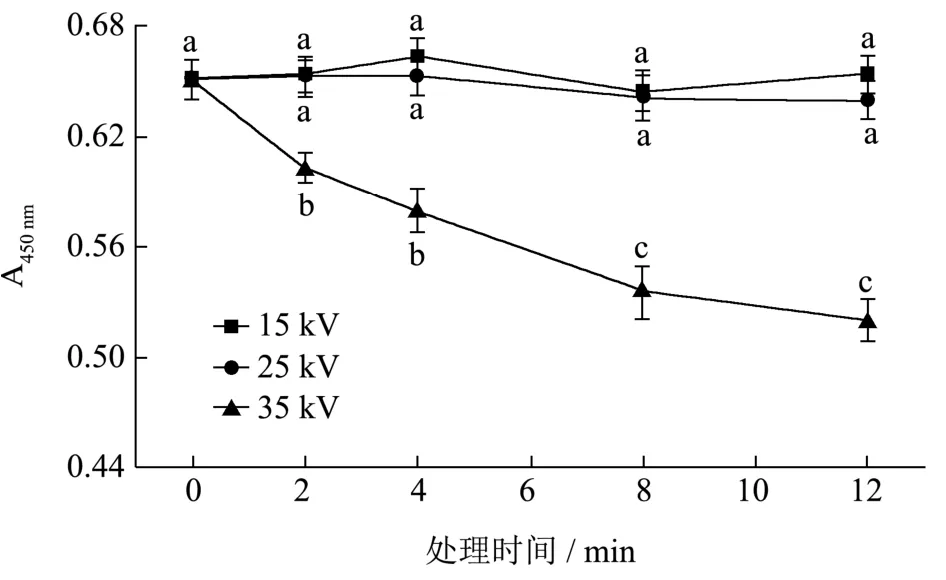
图3 不同处理下小米黄色素的影响 Fig.3 The effect of DBD-ACP on millet yellow pigment under different treatment voltage and time
2.4 等离子体处理对小米清除DPPH自由基的影响
图4表明了在等离子体处理过程中米脂小米与延安小米对DPPH自由基清除能力的变化趋势。从图中可以看出,小米对DPPH自由基的清除能力在等离子体处理(15、25 kV)变化不明显(p>0.05),分别维持在41%左右,表明该处理条件下小米的抗氧化能力基本保持不变。与Ramazzina等[28]的研究结果一致,即空气非热等离子体处理不会改变猕猴桃的抗氧化活性。此外,Amini等[29]也发现空气非热等离子体处理对新鲜核桃的抗氧化能力没有影响。然而,这一结果与等离子体处理电压有关。本研究发现,当处理电压为35 kV时,小米对DPPH自由基的清除能力有轻微下降的趋势(40.83至39.65),但不显著(p>0.05),表明处理电压超过一定的值时,小米中的抗氧化活性成分可能遭受一定程度的破坏,因此降低了小米抗氧化的能力。

图4 不同处理下小米清除DPPH自由基活力的影响 Fig.4 The effect of DBD-ACP on DPPH free radical scavenging activity of millet under different treatment voltage and time
2.5 等离子体处理对小米脂质氧化的作用
丙二醛的积累与脂质尤其是不饱和脂肪酸被氧化有关[30]。研究表明,等离子体产生的羟基自由基等能够使细胞膜脂质氧化产生丙二醛[31]。为了验证等离子体处理是否会引起小米脂质氧化,本实验采用丙二醛试剂盒检测小米经等离子体处理前后的所含丙二醛的含量变化。从图5中可以看出,等离子体在不同处理电压与时间下,小米中被检测的丙二醛含量几乎维持在同一水平,没有显著差异(p>0.05)。类似地,Los等[32]利用空气非热等离子体(80 kV,0.5~3 min)处理小麦,发现经处理的小麦中丙二醛的含量与对照组并无差异,说明等离子体处理对小米中的脂质成分没有产生直接且显著的脂质氧化作用。
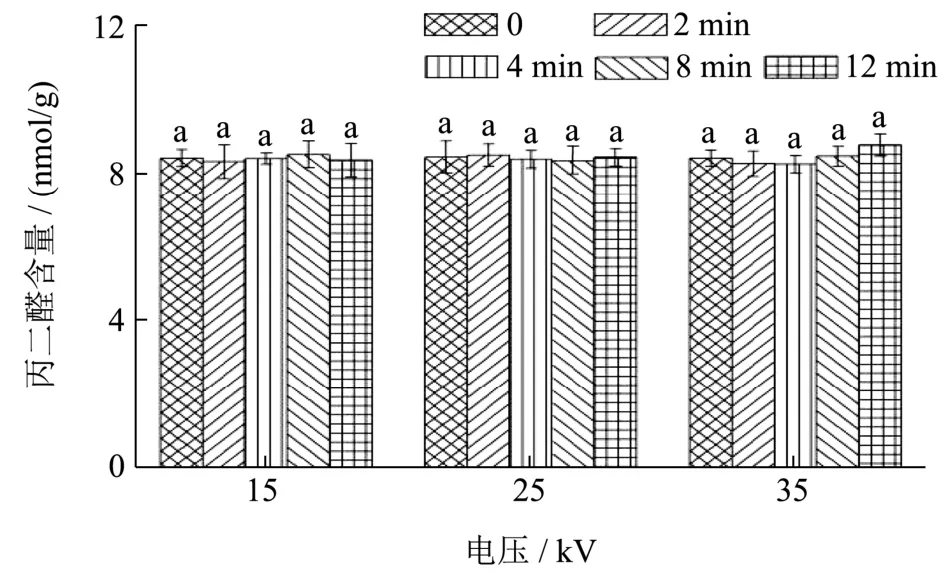
图5 等离子体对小米中丙二醛含量的影响 Fig.5 The production of MDA content on millet induced by DBD-ACP under different treatment voltage and time
2.6 小米表观形态分析
图6a~6d为等离子体在35 kV电压下处理不同时间(0、4、8和12 min)后扫描电镜下的小米表面形态。从图中可以看出,小米表面棱沟清晰可见,且出现一定的斑驳,这可能是由于小米在脱壳处理过程造成的。经处理后的小米在显微镜下的表面形态并未见明显改变,表明等离子体在该处理条件不会对小米表面产生损伤。与之不同的是,Thirumdas等[33]发现等离子体处理能够引起糙米出现一定的机械损伤,如使糙米表面出现裂缝,可能是由于大米和小米的质地不同而引起的。
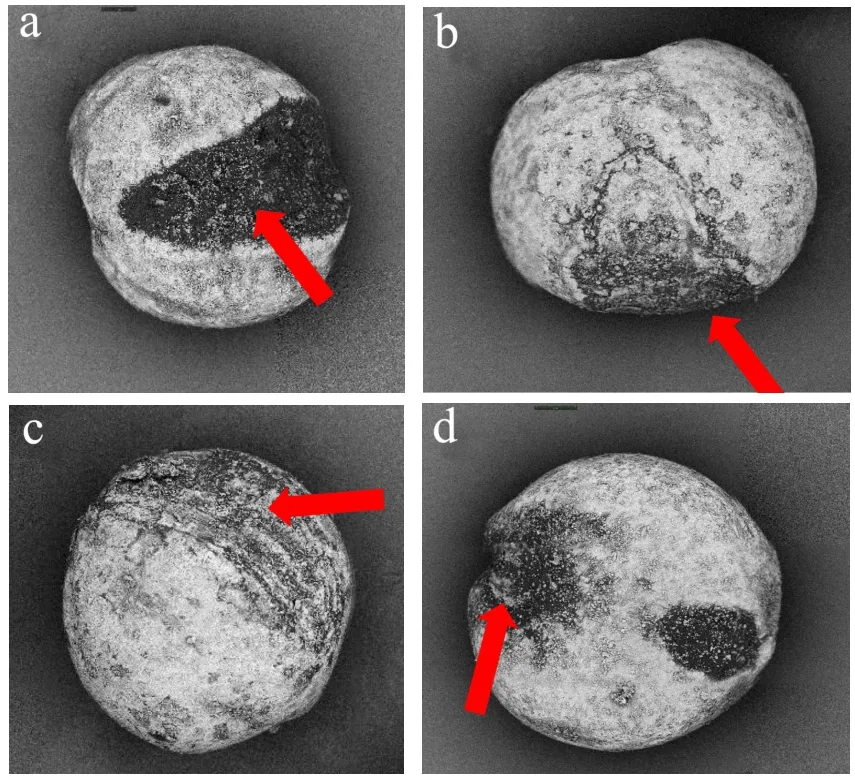
图6 小米经等离子体在35 kV处理不同时间后的表面形态变化 Fig.6 The morphological changes of foxtail millet before and after plasma treatment at 35 kV
3 结论
本研究探讨了介质阻挡放电-空气等离子体处理对小米外观品质、内源酶-脂氧合酶和脂肪酶活性的影响。结果表明该技术能够有效的钝化小米中的脂氧合酶与脂肪酶的活性,且电压越大和处理时间越长,效果越显著。相比于脂氧合酶,等离子体处理对脂肪酶的钝化作用更为有效。等离子体在相对较低的电压(15 kV和25 kV)处理下对小米的色度、黄色素含量和形态无显著影响,并且能够维持其应有的抗氧化活性。然而,当电压为35 kV且处理8~12 min时,等离子体一定程度上影响其色泽,并对类胡萝卜素产生降解作用,甚至一定程度上降低其抗氧化能力。基于本研究的结果可知,介质阻挡放电-空气等离子体在钝化与小米陈化相关的内源酶方面具有显著的作用,在延缓小米陈化和稳定其品质可能具有潜在的作用,但经处理后的小米在贮藏过程中的品质变化值得关注,因此该技术在延缓小米陈化的实际运用方面有待进一步研究。
