琥珀酸对产肠毒素大肠杆菌K88感染小鼠肠道炎症的影响及其机制研究
2022-09-01黄国文张若凡叶艳新朱伟云余凯凡
黄国文 张若凡 叶艳新 李 轩 朱伟云 余凯凡
(南京农业大学消化道微生物研究室,江苏省消化道营养与动物健康重点实验室,国家动物消化道营养国际联合研究中心,南京 210095)
在现代畜牧业集约化、规模化的生产环境下,很多细菌性感染疾病随之发生,其中,大肠杆菌性腹泻是畜牧业中发病率和传染性较高的疾病之一[1]。产肠毒素大肠杆菌(enterotoxigenicEscherichiacoli,ETEC)极易导致仔猪腹泻,并引起肠道炎症和肠道损伤[2]。ETEC主要通过粪口途径传播并侵入消化道内,ETEC的菌毛黏附素可促进仔猪肠上皮细胞的黏附,分泌的肠毒素导致液体电解质紊乱和酸碱失衡[3-4]。抗生素[5]和重金属化合物[6]如氧化锌和硫酸铜在养猪业中广泛用于治疗大肠杆菌感染。然而,抗生素耐药性细菌和重金属污染问题引起了人们的强烈关注。因此,寻找替代性抵抗与治疗大肠杆菌的方法对畜牧生产至关重要。
琥珀酸是宿主细胞三羧酸循环的中间代谢物,在线粒体基质[7]中参与细胞呼吸途径,同时,也可由肠道微生物代谢产生。近年来对琥珀酸的研究发现,琥珀酸通过抑制脯氨酸羟化酶(prolyl hydroxylase domain,PHD)的活性稳定缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α),HIF-α介导炎症因子白细胞介素-1β(interleukin-1β,IL-1β)的表达,从而影响炎症的发生[8]。有研究表明,琥珀酸在小肠内能够通过促进簇状细胞和杯状细胞增生,进而激活Ⅱ型免疫来起到抗菌和抗寄生虫感染的作用[9-10]。但琥珀酸对大肠杆菌诱导的肠道损伤的影响尚未见报道。因此,本研究通过在饮水中添加琥珀酸,从肠道形态、炎症和肠道屏障等方面来评估琥珀酸对小鼠肠道炎症的保护作用效果。
1 材料与方法
1.1 试验设计
试验动物为购自南京青龙山动物繁殖场的7周龄C57BL/6J雄性小鼠40只,随机分为4组:正常对照组(NC组)、琥珀酸组(SUC组)、大肠杆菌组(ETEC组)和琥珀酸+大肠杆菌组(SUC+ETEC组),每组10只小鼠,单笼饲养。4组小鼠均饮用去离子水,SUC和SUC+ETEC组小鼠在饮水中添加20 mmol/L的琥珀酸。试验第4天,ETEC和SUC+ETEC组每天灌胃浓度1×1010CFU/mL的ETEC K88菌液0.2 mL,持续3 d,恢复1 d。4组小鼠均饲喂常规饲粮,自由采食和饮水,适应期7 d,试验期8 d。整个试验期每天称小鼠的体重和观察小鼠的状态。
1.2 菌株及其培养方法
ETEC K88由本实验室前期从猪粪样中分离得到,并保种储存。从-20 ℃冰箱取出保存的ETEC K88,于37 ℃复苏。用接种环蘸取复苏的菌种到装有液体LB培养基的试管中,37 ℃,120 r/min条件下振荡培养16 h得到菌种复苏液。从菌种复苏液中吸取10 μL到1 mL的液体LB培养基中,37 ℃,120 r/min条件下培养5 h,得到细菌悬液。然后再进行扩大培养,吸取200 μL的细菌悬液至40 mL的培养基中,培养4 h后,在4 ℃,3 500×g条件下离心15 min,再用磷酸盐缓冲液(PBS)稀释至一定浓度,最后根据小鼠体重计算出菌液添加量。
1.3 空肠组织切片和苏木精-伊红(HE)染色
截取1 cm左右无食糜的空肠组织,放入4%多聚甲醛固定。再经过脱水、浸蜡、切片、脱蜡、染色、脱水和封固之后得到完整的切片。最后使用虚拟显微镜(Simon-01,Olympus Corporation,日本)观察切片和拍照,并记录绒毛高度和隐窝深度。
1.4 炎症因子浓度的测定
血浆和空肠中促炎因子[肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6)]和抗炎因子[白细胞介素-10(interleukin-10,IL-10)和白细胞介素-4(interleukin-4,IL-4)]浓度采用酶联免疫吸附测定(ELISA)法测定,试剂盒购自南京建成生物工程研究所,具体的试验步骤参照试剂盒说明书。空肠组织中炎症因子浓度需先测定其中蛋白质的浓度,然后用炎症因子浓度值与蛋白质浓度比值表示。
1.5 血浆中内毒素、二胺氧化酶(diamine oxidase,DAO)和D-乳酸(D-lactic acid,D-LA)浓度的测定
血浆中内毒素、DAO和D-LA浓度采用试剂盒测定,试剂盒购自南京建成生物工程研究所,根据试剂盒的说明书步骤,稀释成合适的浓度进行检测,通过酶标仪(Spark 10M,TECAN公司,瑞士)检测相应的光密度(optical density,OD)值,最后计算出最终的浓度。
1.6 肠上皮屏障相关蛋白表达水平的测定
肠上皮屏障相关蛋白表达水平通过免疫组化分析紧密连接蛋白闭锁小带蛋白(zonula occludens-1,ZO-1)、密封蛋白-1(Claudin-1)和咬合蛋白(Occludin)的平均OD值来反映。所有的试验操作均在武汉赛维尔生物科技有限公司进行,具体的试验步骤如下:首先经过切片、脱蜡和抗原修复步骤,再经过血清封闭、一抗孵育和二抗孵育,然后经过PBS洗涤后进行染色和复染,最后通过脱水和封片成型。使用虚拟显微镜(Simon-01,Olympus Corporation,日本)进行观察和拍照。
1.7 数据统计分析
所有试验数据经SPSS 20.0软件进行单因素方差分析(one-way ANOVA),并采用LSD法分析各组间的差异显著性,结果用平均值±标准误表示,P<0.05为差异显著。使用GraphPad Prism 8.0软件制作数据图。
2 结 果
2.1 琥珀酸对ETEC K88感染小鼠体重和器官指数的影响
由表1可见,各组之间初始体重无显著差异(P>0.05)。与NC组相比,ETEC组小鼠造模后体重显著降低(P<0.05);与ETEC组相比,SUC+ETEC组造模后体重显著升高(P<0.05)。各组之间肝脏指数和脾脏指数无显著差异(P>0.05)。与NC组相比,SUC组和SUC+ETEC组小肠长度显著增加(P<0.05)。

表1 琥珀酸对ETEC K88感染小鼠体重和器官指数的影响
2.2 琥珀酸对ETEC K88感染小鼠空肠组织形态的影响
空肠组织切片HE染色结果显示,ETEC K88感染对空肠组织中黏膜、上皮细胞的损伤不明显(图1)。由表2可见,与NC组相比,ETEC组空肠绒毛高度和绒毛高度/隐窝深度降低,但差异不显著(P>0.05)。与ETEC组相比,SUC+ETEC组空肠绒毛高度和绒毛高度/隐窝深度显著升高(P<0.05)。各组之间空肠隐窝深度无显著差异(P>0.05)。

图1 小鼠的空肠组织形态

表2 琥珀酸对ETEC K88感染小鼠空肠组织形态的影响
2.3 琥珀酸对ETEC K88感染小鼠血浆炎症因子浓度的影响
由表3可见,与NC组相比,ETEC组血浆中促炎因子TNF-α和IL-6浓度显著提高(P<0.05),抗炎因子IL-10和IL-4浓度显著降低(P<0.05);与ETEC组相比,SUC+ETEC组血浆中促炎因子IL-6浓度显著降低(P<0.05),但抗炎因子IL-10和IL-4浓度无显著差异(P>0.05)。
2.4 琥珀酸对ETEC K88感染小鼠空肠炎症因子浓度的影响
由表4可见,NC组、SUC组和SUC+ETEC组空肠中促炎因子TNF-α和IL-6浓度显著低于ETEC组(P<0.05),而抗炎因子IL-10浓度显著高于ETEC组(P<0.05)。NC组和SUC组空肠中抗炎因子IL-4浓度显著高于ETEC组和SUC+ETEC组(P<0.05);SUC+ETEC组IL-4浓度高于ETEC组,但差异不显著(P>0.05)。

表4 琥珀酸对ETEC K88感染小鼠空肠炎症因子浓度的影响
2.5 琥珀酸对ETEC K88感染小鼠血浆内毒素、DAO和D-LA浓度的影响
由表5可见,与NC组相比,ETEC组血浆中内毒素、DAO和D-LA浓度显著升高(P<0.05);与ETEC组相比,SUC+ETEC组血浆中内毒素和D-LA浓度显著降低(P<0.05)。
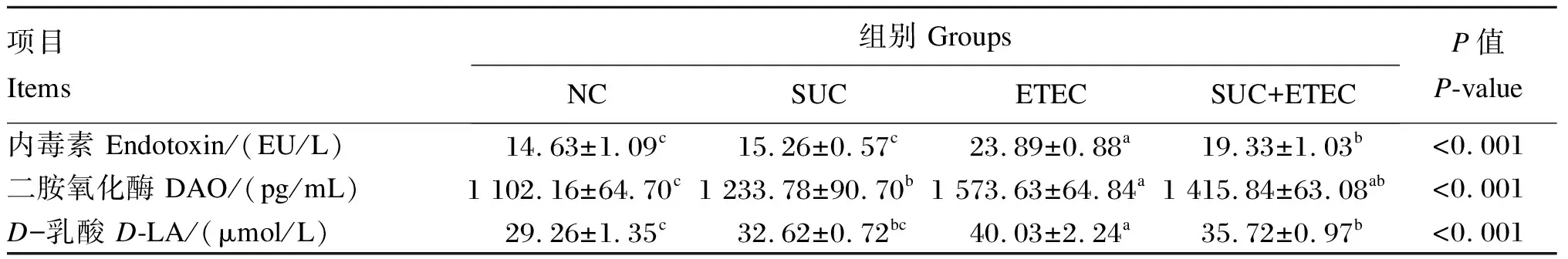
表5 琥珀酸对ETEC K88感染小鼠血浆内毒素、DAO和D-LA浓度的影响
2.6 琥珀酸对ETEC K88感染小鼠的肠道屏障相关蛋白表达的影响
ZO-1、Claudin-1与Occludin免疫组化染色图如图2所示。由表6可见,与NC组相比,ETEC组空肠组织中紧密连接蛋白Claudin-1和Occludin的表达水平显著降低(P<0.05);与ETEC组相比,SUC+ETEC组空肠组织中紧密连接蛋白Claudin-1和Occludin的表达水平显著升高(P<0.05)。各组之间空肠组织中紧密连接蛋白ZO-1的表达水平无显著差异(P>0.05)。

图2 ZO-1、Claudin-1与Occludin免疫组化染色图

表6 琥珀酸对ETEC K88感染小鼠空肠紧密连接蛋白表达的影响
3 讨 论
3.1 琥珀酸对ETEC K88感染小鼠生长状况的影响
ETEC是畜牧生产中主要的病原菌之一,其在仔猪上致病性的产生依赖于宿主特异性的菌毛黏附素和分泌的肠毒素。有研究表明,在小鼠模型上,ETEC K88感染主要通过激活Toll样受体2/4(Toll-like receptor 2/4,TLR2/4)信号通路,促进肠道炎症因子的分泌和表达,引起小鼠肠道损伤和腹泻的产生[11]。ETEC K88感染小鼠的特征主要是改变紧密连接蛋白的完整性和破坏细胞旁离子通道,导致体重下降和腹泻[12]。本研究发现,ETEC K88感染降低了小鼠的体重,表明ETEC K88感染小鼠造模成功。Han等[13]研究表明,灌胃乳杆菌能够降低ETEC诱导的小鼠体重下降,改善肠道炎症和微生物失调。本研究中,菌群代谢产物与宿主代谢中间体——琥珀酸对肠道炎症的影响结果表明,饮水添加琥珀酸能够缓解ETEC K88感染引起的体重下降。
3.2 琥珀酸对ETEC K88感染小鼠肠道组织形态的影响
琥珀酸作为微生物代谢产物,参与调节肠道与机体代谢。有研究表明,给肥胖小鼠灌胃琥珀酸产生菌狄氏副拟杆菌,可增加肠道中琥珀酸浓度,减少体重的增加,并调节胆汁酸代谢,缓解机体代谢紊乱[14]。本研究发现,饮水添加琥珀酸缓解了ETEC K88感染引起的小鼠体重下降,并且添加琥珀酸改善了小鼠空肠组织形态,提高了空肠绒毛高度和绒毛高度/隐窝深度。而肠道形态的完整性对肠道物理屏障功能的发挥起到至关重要的作用,与营养物质的消化吸收息息相关[15],绒毛高度、隐窝深度和绒毛高度/隐窝深度作为评估肠道形态完整性的重要组成部分,是衡量肠道发育和吸收功能的重要指标[16]。绒毛高度升高,单位面积的细胞数增加,则消化吸收功能增强;隐窝深度反映了隐窝干细胞的分化程度,隐窝变浅,相应细胞分化增强,消化吸收能力增强[17]。我们前期在猪上的研究也发现了一致的结果,饲粮添加1%琥珀酸显著提高了空肠绒毛高度和绒毛高度/隐窝深度,并降低了隐窝深度[18]。类似地,其他菌群代谢物也被证明可以改善肠道形态结构和功能,如灌胃短链脂肪酸增加了仔猪小肠绒毛高度和绒毛高度/隐窝深度,降低了细胞凋亡的百分比,进而促进了仔猪肠道发育[19-20]。
3.3 琥珀酸对ETEC K88感染小鼠肠道免疫功能的影响
琥珀酸缓解ETEC K88感染引起的小鼠肠道损伤可能是其调节了免疫应答反应。研究表明,琥珀酸在炎症区域积聚,通过调节巨噬细胞和成纤维细胞中促炎细胞因子的表达来调节肠道炎症和纤维化[21]。并且,琥珀酸通过激活簇状细胞上化学信号元件,导致簇状细胞和杯状细胞增生,激活Ⅱ型免疫反应,进而调节炎症反应[9]。在小肠上皮细胞中,簇状细胞可以调节肠道Ⅱ型先天性淋巴细胞(ILC2)-上皮反应回路,参与宿主抵抗病原体感染,进一步介导免疫反应[22]。本研究中,饮水添加琥珀酸有效地降低了血浆和肠道组织中促炎因子TNF-α和IL-6浓度,增加了抗炎因子IL-10和IL-4浓度,缓解了大肠杆菌感染导致的肠道炎症的发生。IL-10在胃肠道中也可以由ILC2产生[23],促进机体的免疫应答和组织修复。IL-4作为2型免疫特征细胞因子,在寄生虫感染情况下促进肠道簇状细胞和杯状细胞增生,进一步增强肠道免疫应答[24]。类似地,在巨噬细胞中琥珀酸也可能通过琥珀酸受体(succinate receptor 1,SUCNR1)的方式调节机体抗炎反应[25]。Keiran等[26]研究发现,琥珀酸-SUCNR1轴促进了巨噬细胞的抗炎表型,并增强了巨噬细胞对包括IL-4在内的2型细胞因子的反应,进而调节肥胖相关的代谢反应。
3.4 琥珀酸对ETEC K88感染小鼠肠道屏障相关蛋白表达的影响
肠上皮细胞暴露于促炎细胞因子如TNF-α,会影响黏蛋白的分泌,并导致上皮屏障的损伤[27]。肠道屏障的完整性能维持肠腔内外的物理平衡。在健康的小鼠体内,血浆中内毒素、DAO和D-LA浓度处于较低状态;当肠道受损时,大量的内毒素、DAO和D-LA在血浆中累积。本研究中,反映肠道通透性的指标如内毒素、DAO和D-LA在血浆中的浓度均因ETEC K88感染增加,而饮水添加琥珀酸能降低它们的浓度。虽然已有文献表明,在肥胖患者中,血浆内琥珀酸的循环水平与肠道通透性呈正相关[28]。但Osuna-Prieto等[29]研究发现,这种相关性与琥珀酸产生菌和利用菌种类之间没有关联,可能更多与细胞反应相关。而本研究通过饮水添加琥珀酸增强肠道通透性可能是通过直接作用影响肠道上皮屏障功能。此外,细胞间的紧密连接蛋白在维持肠道屏障完整性和肠道通透性中发挥了重要作用[30]。例如,ZO-1有利于肠道黏膜损伤的修复[31];Claudin-1的表达能够以Notch依赖的方式诱导肠上皮细胞增殖,从而增强肠道屏障的功能[32];Occludin则被认为是紧密连接组装和发挥功能的调节因子[33]。因此,上调紧密连接蛋白的表达能够增强肠道上皮的功能。本研究发现,在ETEC K88感染的情况下,饮水添加琥珀酸上调了紧密连接蛋白Claudin-1和Occludin的表达。总的来说,饮水添加琥珀酸降低了肠道通透性,提高了肠上皮之间的紧密连接蛋白的表达,进而增强了肠上皮屏障的功能。
4 结 论
饮水中添加琥珀酸可显著改善ETEC K88感染引发的小鼠空肠形态结构,调节血浆和肠道组织炎症因子的分泌和表达,降低肠道通透性,并促进肠道组织紧密连接蛋白的表达,从而缓解ETEC K88感染引起的肠道炎症。
