鸡坏死性肠炎的致病机理及益生菌干预
2022-09-01童狄清高春起
童狄清 钟 晨 高春起
(华南农业大学动物科学学院,广东省动物营养调控重点实验室,广州 510642)
鸡坏死性肠炎(necrotic enteritis)是家禽常见的肠道疾病,每年给全球家禽业带来约60亿美元的经济损失[1]。虽然急性鸡坏死性肠炎死亡率高达50%,生产中更多的是以亚临床鸡坏死性肠炎(subclinical necrotic enteritis,SNE)的形式存在,其严重影响家禽的生长性能和饲料转化效率。饲粮添加抗生素是防治鸡坏死性肠炎的有效措施,但随着我国全面禁止抗生素作为促生长类饲料添加剂的使用,鸡坏死性肠炎的防治面临巨大挑战。2001年,益生菌被定义为“通过摄取适当的量时对宿主身体健康能发挥有效作用的活菌”[2]。益生菌及其代谢产物尤其是短链脂肪酸(short-chain fatty acids,SCFAs)、次级胆汁酸(secondary bile acids,SBA)和色氨酸(Trp)等,具有维持肠道上皮物理屏障、稳定肠道微生物区系、调节宿主免疫功能、促进胃肠蠕动和抑制有害菌在肠上皮黏附侵袭等功能[3]。本文主要综述了鸡坏死性肠炎致病的重要毒力因子及益生菌对其干预方面的最新研究进展,为通过益生菌防治鸡坏死性肠炎提供参考。
1 鸡坏死性肠炎及其致病机理
1.1 鸡坏死性肠炎的诱发因素及症状
鸡坏死性肠炎主要是由产气荚膜梭菌(Clostridiumperfringens)感染引起的肠道组织坏死性疾病。单一的产气荚膜梭菌感染并非是导致坏死性肠炎的必然结果,还需其他诱发因素的共同作用,如高密度饲养带来的应激、含鱼粉的高蛋白质饮食等,均会导致鸡坏死性肠炎[4]。产气荚膜梭菌定植的主要场所为小肠部位[5]。鸡坏死性肠炎病变主要表现为:1)组织层面。小肠大部分融合性黏膜坏死,肠内覆盖有黄褐色或胆汁染色的假膜,典型的特征有黏膜表面凹陷溃疡,坏死组织和活组织间界限清晰[5-6]。2)细胞水平。肠道血管内皮细胞成孔死亡,坏死处嗜异性粒细胞聚集,大量的免疫细胞浸润到固有层[7]。3)分子水平。胞间紧密连接分子被破坏[8],胞内促炎因子表达水平显著提高,并诱导坏死因子的高表达[9]。
1.2 鸡坏死性肠炎的致病机理
1.2.1 分泌毒素
产气荚膜梭菌是革兰氏阳性、厌氧菌,且革兰氏阳性菌的细胞壁主要成分为肽聚糖(peptidoglycan)。肽聚糖可作为病原相关分子模式(pathogen-associated molecular patterns,PAMPs)被肠上皮细胞模式识别受体(pattern recognition receptors),包括核苷酸寡聚化结构域(nucleotide-binding oligomerization domain,NOD)样受体或Toll样受体(Toll-like receptors,TLRs)所识别,进而激活核转录因子-κB(nuclear factor-kappa B,NF-κB)信号通路所介导的炎症反应[10-11]。产气荚膜梭菌可分泌20多种毒素[6],引起疾病相关的毒素主要包括α(CPA,编码基因plc或cpa)、β(CPB)、ε(编码基因etx)、ι(编码基因iap和ibp)、CPE(编码基因cpe)和NetB(编码基因netB)毒素[12]。根据毒素的类型,产气荚膜梭菌被分为A~G型[13]。编码α毒素的plc基因存在于细菌染色体的稳定区域,可在所有产气荚膜梭菌菌株中表达[12];β毒素会引起肠毒血症并可在细胞膜上成孔。最新研究发现,CD31是内皮细胞上特异性结合CPB的膜受体,膜外近端的的结构域免疫球蛋白6(Ig6)足以引起结合β毒素后产生的细胞损伤[14],这可能是β毒素引起鸡肠道黏膜出血的重要原因。由F型产气荚膜梭菌分离出的CPE(与CPB毒素结构类似),是分子量为35 kDa的多肽单体,其C末端结构域(cCPE)结合集序和闭合蛋白(claudins,CLDNs)家族结合形成寡聚体,并将CLDNs分解,而且CLDNs中NPLVA153基序(该基序穿透cCPE-β链之间的凹槽)的第3位亮氨酸能显著提高其结合亲和力[8,15]。NetB毒素是由G型产气荚膜梭菌分泌的一种成孔毒素(与β毒素功能类似),鸟类红细胞对其具有高度敏感性[16],能够在敏感细胞膜上形成内径为26 Å的七聚体孔[17],并且该孔对阳离子有强烈的偏好性。另外,对肠道基底膜(basement membranes)的破坏涉及到产气荚膜梭菌分泌的一种微生物胶原酶(由colA基因编码),该酶能够分解胶原蛋白质破坏基底膜的完整性并加重肠上皮组织的坏死[6]。
1.2.2 黏附定植
细菌的黏附定植与其自身的菌毛或鞭毛结构以及分泌的黏附素密切相关,能防止物理性的移位,这也是绝大多数细菌致病前提。产气荚膜梭菌与许多革兰氏阳性菌不同,其缺乏运动型鞭毛但具有与独立鞭毛不同的Ⅳ型菌毛(T4P)的滑行功能,且Ⅳ型菌毛系统有多种生物功能,如细菌生物膜的形成和黏附[18],这可能是其具有黏附定植能力的主要原因。产气荚膜梭菌中高度保守的VR-10B基因座编码7个基因,大部分被预测为黏附菌毛样蛋白[19],其中黏附素编码基因cnaA缺失突变体无法诱导肉鸡坏死性肠炎的发生,且对Ⅳ型胶原蛋白的黏附及破坏能力显著下降[20],这表明cnaA基因是决定产气荚膜梭菌黏附定植的关键基因;Ⅳ型胶原蛋白是肠基底膜的主要成分,基底膜在组织结构和功能维护中发挥重要作用[21]。研究表明,强毒性产气荚膜梭菌菌株失去编码带有netB的NELoc-1基因座,其毒力显著下降,单独引入netB基因后对体外细胞的毒性可恢复至野生型,但攻击鸡后却没有完全恢复毒力作用,因为NELoc-1上仍然编码着预测的毒力因子,比如黏附素[22]。这些研究提示,产气荚膜梭菌需要在宿主上黏附定植后才具有完整的毒力作用,可能潜在介导产气荚膜梭菌黏附定植后刺激宿主并造成损伤的途径,但具体机制有待解析。
1.2.3 群体感应(quorum sensing,QS)系统
QS系统是细菌之间通过信号肽(signaling peptide)分子来实现交流的重要方式,不同细菌种间和种内能够通过QS系统调节彼此的生长及基因表达[23]。近年来的研究表明,辅助基因调节(accessory gene regulator,AGR)系统是产气荚膜梭菌最主要的QS调节系统,对其毒素分泌和调节发挥关键作用[24-25],这也可能是益生菌通过QS系统抑制产气荚膜梭菌分泌毒素的重要途径之一。AGR系统是QS系统的一种,由4个共转录基因(agrA、agrB、agrC和agrD)组成,agrD编码的自诱导肽(autoinducing peptide)前体被agrB转运蛋白加工成活性自诱导肽后分泌到环境中,然后被VirS/VirR(VirS/R)双组分调节系统(two-component regulatory systems,TCRS)识别并且调节毒素[α、β、NetB和PFO(θ)等]的基因表达[26-27]。最新研究证实,VirS膜受体蛋白主要是细胞外环与信号肽进行识别结合[28]。值得一提的是,属于QS系统的2型自诱导信号分子(autoinducer-2)在革兰氏阳性菌及革兰氏阴性菌均有表达[23,29],2型自诱导信号分子是否能够被AGR系统识别尚不清楚,也可能是益生菌抑制产气荚膜梭菌分泌毒素或降解酶表达的潜在生物因子。
1.2.4 诱导肠上皮细胞坏死性凋亡
肠上皮细胞坏死是鸡坏死性肠炎标志特征,且上皮细胞程序性坏死与受体互相作用蛋白激酶1/3(receptor interacting protein kinase 1/3,RIPK1/3)结合形成的坏死复合体有关。Shrestha等[9]研究表明,特异性RIPK1/3抑制剂能够减少CPE毒素诱导的混合谱系激酶结构域样假激酶(MLKL)的寡聚化和Caco-2细胞凋亡,说明RIPK1、RIPK3和MLKL是促进CPE诱导细胞坏死性凋亡的重要信号分子。然而,CPE诱导的细胞死亡途径在不同类型细胞间存在差异。另一项研究发现,Parkin蛋白质(由PARK2基因编码的一种蛋白质)通过抑制RIPK3的磷酸化和RIPK1/3复合体的形成来负调控细胞坏死性凋亡而非自噬,且Parkin蛋白质的E3泛素连接酶活性是抑制细胞坏死所必要的,这种调节可能是诱导肠上皮组织坏死和炎症的重要机制[30]。
2 益生菌对坏死性肠炎的干预效果及机理
2.1 维持肠道结构和功能完整性
肠绒毛高度/隐窝深度(V/C)值是衡量肠道消化吸收功能的重要指标。Shanmugasundaram等[31]研究指出,通过给感染坏死性肠炎的鸡口服复合益生菌(罗伊乳酸杆菌、粪肠球菌、动物双歧杆菌和乳酸片球菌)的共培养上清液,逆转了V/C值的降低,改善了肠道结构的完整性。这可能与复合益生菌中的乳酸菌能够产酸有关,因为当pH低于5.1时,对酸度敏感的产气荚膜梭菌增殖能力大幅下降[32]。肠道上皮细胞间的紧密连接(tight junction)是肠道机械屏障主要的物理防御,其中闭锁蛋白(occludin,OCLN)和CLDNs是紧密连接的2类关键蛋白,能够维持肠上皮结构的完整性,防止外界有害因子跨过肠道屏障进入黏膜层甚至基底膜,进而对肠道组织造成严重损伤[33]。脂多糖(LPS)处理人脑微血管内皮细胞(hCMEC/D3)后OCLN的表达显著下调,p38丝裂原活化蛋白激酶(p38 mitogen activated protein kinases,p38 MAPK)的磷酸化显著增加[34],这可能是机体对屏障损伤的代偿机制。微生物的代谢产物SCFAs具有提高组织紧密连接蛋白表达、维持肠道甚至大脑屏障的功能[35-36]。Gharib-Naseri等[37]研究表明,鸡患坏死性肠炎时补充解淀粉芽孢杆菌CECT 5940可显著上调CLDN-2和OCLN蛋白的表达,丁酸梭菌可通过剂量依赖方式上调宿主肠道CLDN-1和CLDN-2的mRNA丰度[38],可能是其代谢产物丁酸盐通过促进肠道紧密连接蛋白的表达所致(图1)[27,38-39]。
2.2 提高肠道抗氧化能力
肠黏膜的抗氧化能力对肠道健康至关重要,而抗氧化能力的降低是坏死性肠炎对宿主肠道损伤、降低生产性能的重要途径。Zhao等[40]研究表明,饲粮添加地衣芽孢杆菌H2可显著提高患坏死性肠炎鸡回肠的超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性和总抗氧化能力(T-AOC),表明地衣芽孢杆菌H2能够有效增强肠道组织的抗氧化能力,缓解坏死性肠炎引起的肠道氧化损伤。Wang等[39]研究发现,饲粮添加约氏乳杆菌BS15可显著提高坏死性肠炎鸡小肠过氧化氢酶(CAT)、SOD和GSH-Px的活性以及降低丙二醛(MDA)的含量,提高抗氧化能力。Eeckhaut等[41]研究表明,饲粮添加一种可以高效产生丁酸盐的益生菌,可有效降低因坏死性肠炎导致的死亡鸡的数量。上述结果表明,益生菌能够提高感染坏死性肠炎动物肠道的抗氧化能力,减少肠道氧化损伤程度,降低动物的死亡率。
2.3 改善肠道微生物区系平衡
肠道菌群的失衡易导致疾病的发生,感染坏死性肠炎的肠道中有益菌及菌群结构的丰度均受到不同程度的改变。感染坏死性肠炎后保守的肠道菌群改变表现为:梭菌科的减少和乳杆菌科及其他种类的相对增加,菌群结构变化或许可作为评价鸡坏死性肠炎的重要指标之一。研究显示,梭菌科如未分类的梭状芽胞杆菌科、念珠菌节杆菌、未分类的SMB53和未分类的消化链球菌和链球菌丰度均显著降低,这些都是产气荚膜梭菌感染前肠道中高度丰富的原生菌群,且原生的梭状芽孢杆菌由感染前胃肠道占比的40%下降到10%[42],土著细菌丰度的降低表明产气荚膜梭菌在宿主肠道中夺取生态位以及营养物所致的竞争性抑制。产气荚膜梭菌会抑制有益菌的增殖,患有坏死性肠炎鸡的盲肠中魏氏乳酸菌和布氏瘤胃球菌的数量均显著下降[43]。魏氏乳酸菌VP30是一种高产胞外多糖(EPS)的有益菌[44],EPS是益生菌产生的功能(抗炎、抗氧化和抗肿瘤)物质;布氏瘤胃球菌是高效的抗性淀粉降解菌[45],同样是人肠结肠中关键的抗性淀粉的关键物种[46],而抗性淀粉和纤维有利于肠道重要的微生物代谢产物SCFAs的产生,因此补充具有分泌EPS或强分解抗性淀粉功能的益生菌可能有助于预防或缓解坏死性肠炎对肠道微生物区系平衡的破坏。
益生菌的补充能抑制宿主肠道中产气荚膜梭菌的增殖,促进有益菌的繁殖,进而改善肠道微生物区系。感染坏死性肠炎后添加丁酸梭菌,能够增加泰国外丝菌、临时未分类外丝菌和乳酸片球菌等有益菌的丰度[38]。植物乳杆菌和多黏类芽孢杆菌能够恢复坏死性肠炎导致的肠道菌群失调,增加枯草杆菌、乳球菌、假黄杆菌和口腔杆菌等有益菌的丰度[47]。给患有坏死性肠炎鸡饲粮补充凝结芽孢杆菌,其盲肠内容物中大肠杆菌和产气荚膜梭菌的数量显著下降,乳酸杆菌和双歧杆菌数量显著上升,说明凝结芽孢杆菌有利于增强有益菌的生态位,维持肠道菌群稳态[48]。上述研究表明,肠道稳态可保证宿主机体营养物质的稳定供应,坏死性肠炎会破坏肠道稳态并导致营养物质吸收失衡,而益生菌的外源补充能修复肠道稳态,增强肠道对坏死性肠炎的抵抗能力。
2.4 增强宿主肠道免疫功能
鸡坏死性肠炎导致宿主肠道炎症反应增强,益生菌可通过抑制促炎因子、促进抗炎因子的表达水平,进而提高肠道免疫功能,缓解坏死性肠炎诱导的肠道损伤。白细胞介素-17(IL-17)是一种由辅助性T淋巴细胞17(Th17)分泌产生的促炎因子,p38 MAPK介导Th17细胞在诱导组织炎症中具有特异性调控作用[49]。Gong等[50]研究表明,枯草芽孢杆菌可下调肠道IL-17的表达,缓解因葡聚糖硫酸钠(DSS)诱导的小鼠炎症性肠炎。相反,白细胞介素-10(IL-10)是一种重要的抗炎因子,几乎由所有的白细胞亚群产生,包括树突状细胞、巨噬细胞、树突状细胞、自然杀伤(NK)细胞、T和B淋巴细胞等[51],其通过激活JAK激酶和信号转导及转录激活蛋白(STAT)转录因子途径发挥作用,且STAT3是该通路不可或缺的信号分子[52]。发生炎症反应时,IL-10对Th17细胞的抑制作用是必要的[53],且细菌及代谢产物可激活TLRs及其下游信号通路调节IL-10基因表达[54]。Li等[55]研究表明,嗜酸乳杆菌的补充上调了IL-10的mRNA的表达和抑制坏死性肠炎诱导的干扰素-γ(IFN-γ)大量产生。微生物可通过其代谢产物调控肠道免疫功能,如微生物代谢产物SCFAs能调节细胞促炎因子和抗炎因子的表达。Huang等[38]研究发现,饲粮添加丁酸梭菌可显著上调IL-10和抑制IL-17A(IL-17家族的一员)的表达,这可能与其代谢产物丁酸盐通过介导p38 MAPK的磷酸化进而促进产IL-10的B10细胞生成有关[56]。在结肠炎和多发性硬化症的小鼠模型中,戊酸盐可通过诱导效应T和B淋巴细胞上调IL-10的分泌,并抑制组蛋白乙酰化酶活性[57];脱氧胆酸(DCA)以剂量依赖方式缓解坏死性肠炎诱导的肠道炎症和体重损失[7]。以上研究说明,益生菌及其代谢产物通过TRLs和p38 MAPK介导激活下游信号通路调节IL-10和IL-17表达,缓解炎症反应,增强宿主自身免疫功能,改善产气荚膜梭菌诱导的肠道炎症损伤。
重组益生菌能够作为表达无毒抗原的载体,激活机体特异性免疫。Alimolaei等[58]研究发现,通过将产气荚膜梭菌α毒素的C末端结构域(cpa247-370)整合到干酪乳杆菌ATCC 393获得的重组LC-α菌株可作为口服疫苗,有效刺激宿主肠道特异性免疫机能,并产生高水平的分泌型免疫球蛋白A(sIgA),注射致死剂量的α毒素后,添加重组LC-α治疗组小鼠对α毒素的抗性显著增强。益生菌对产气荚膜梭菌损伤动物肠道健康的缓解效应见表1。
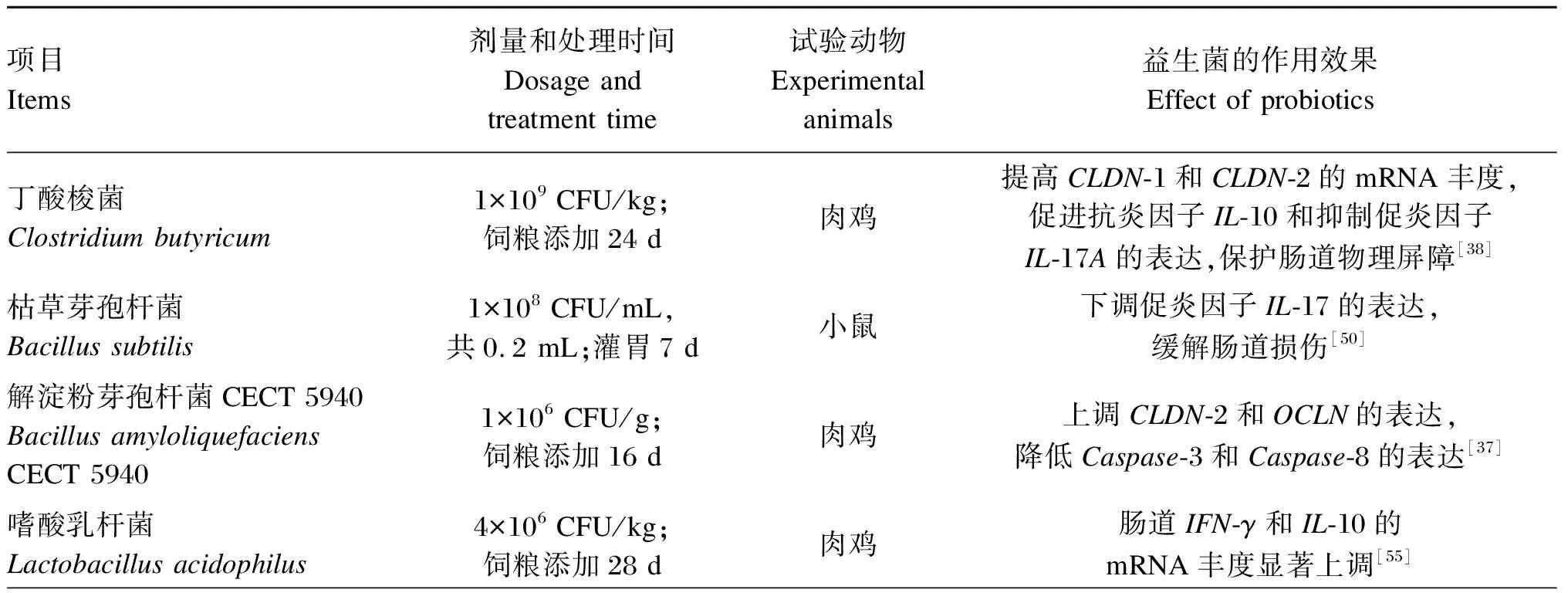
表1 益生菌对产气荚膜梭菌损伤动物肠道健康的缓解效应
2.5 抑制肠上皮细胞凋亡
产气荚膜梭菌可通过诱导肠上皮细胞凋亡,破坏宿主肠道机能;益生菌可缓解宿主炎症反应,抑制细胞凋亡。促凋亡蛋白B细胞淋巴瘤蛋白2相关X蛋白(Bax)和抗凋亡蛋白B细胞淋巴瘤蛋白2(Bcl-2)的平衡被破坏后,线粒体膜的通透性增加,导致线粒体膜的细胞色素C(cytochrome C)释放到胞质中,激活半胱天冬酶-3(Caspase-3)介导的凋亡途径引起细胞凋亡[59]。研究表明,患有坏死性肠炎鸡的肠组织中Bax/Bcl-2表达比值显著提高,说明坏死性肠炎可能诱导线粒体介导的细胞凋亡过程,而添加约氏乳杆菌BS15能够抑制细胞凋亡程度[39]。解淀粉芽孢杆菌CECT 5940能够抑制鸡坏死性肠炎导致Caspase-3和Caspase-8表达上调,从而抑制细胞凋亡[37]。另外,p53是一种多功能蛋白,能够通过促进凋亡前基因(如Bax)的表达来诱导凋亡,抑制抗凋亡基因[如存活素(survivin)]表达,从而激活半胱天冬酶依赖性途径,最终触发凋亡[60]。复合益生菌能够抑制坏死性肠炎模型p53信号通路介导的细胞凋亡[47]。因此,益生菌能抑制鸡坏死性肠炎肠细胞线粒体介导的凋亡途径,与其参与调控p53、Bax和Bcl-2的基因表达有关。
3 小 结
产气荚膜梭菌可通过自身或其分泌的毒素破坏鸡肠道物理屏障、化学屏障和微生物屏障,导致鸡坏死性肠炎的发生。而益生菌可改善坏死性肠炎引起的肠道损伤,恢复肠道微生物区系平衡,提高肠道免疫功能等。但是鸡坏死性肠炎的致病机理和益生菌对其的干预机制仍待进一步阐明,如产气荚膜梭菌毒素激活RIPK1/3介导的细胞坏死的确切机制尚不完全清楚;益生菌缓解产气荚膜梭菌诱导细胞损伤和凋亡的分子机制是什么;益生菌是否可通过QS系统抑制产气荚膜梭菌毒素的分泌,这些问题的解决可为鸡甚至人坏死性肠炎的防治提供理论参考。另外,靶向缓解产气荚膜梭菌诱导产生坏死性肠炎的功能益生菌的筛选需要制定统一评价标准,进而为绿色新型饲料添加剂的开发提供有效的营养干预策略。
