洛铂与顺铂新辅助序贯同步放化疗治疗ⅡB~ⅢB期宫颈癌的疗效分析
2022-09-01鲍瑜钱江朱立建
鲍瑜, 钱江, 朱立建
宫颈癌是妇科常见恶性肿瘤,其发病率、死亡率均较高[1]。由于宫颈癌早期缺乏特异性的临床症状,造成部分患者确诊时已进展至局部晚期甚至晚期[2]。目前宫颈癌尚无标准的化疗方案,国际上主要采用以铂类为基础的联合化疗方案进行治疗,新辅助化疗能有效提高中晚期宫颈癌患者的生存质量,可广泛应用于宫颈癌的治疗[3]。目前,紫杉类联合铂类仍是治疗ⅡB~ⅢB期宫颈癌的常用方案,临床控制率较高,但顺铂能引起骨髓抑制、恶心等不良反应[4]。洛铂作为第3代铂类抗癌药物,其毒性与第2代卡铂类药物类似,抗癌活性与顺铂相当,且其与顺铂无交叉耐药性[5]。国内有研究采用洛铂与顺铂同步放化疗治疗ⅡB~ⅢB期宫颈癌患者,结果显示二者疗效相当[6]。但目前国内有关洛铂与顺铂新辅助序贯同步放化疗治疗ⅡB~ⅢB期宫颈癌的研究尚少,本研究选取84例宫颈癌患者,均分成两组,分别采用顺铂新辅助序贯同步放化疗与洛铂新辅助序贯同步放化疗治疗,通过比较两种方法的临床疗效,以期为宫颈癌的临床诊治提供依据。
1 资料与方法
1.1 一般资料
选择2019年1月至2020年12月池州市人民医院收治的84例宫颈癌患者为研究对象,纳入标准:①符合宫颈癌的诊断标准[7],且经组织病理学确诊;②国际妇产科学联盟(International Federation of Gynecology and Obstetrics,FIGO)[8]分期为ⅡB~ⅢB期;③卡氏评分(Karnofsky,KPS)≥70分;④预计生存期>3个月;⑤病灶可测量;⑥年龄18~72岁;⑦签署知情同意书。排除标准:①既往接受新辅助序贯同步放化疗者;②妊娠期或哺乳期女性;③心、肝、肾等重要脏器功能异常者;④既往有盆腔放疗史者;⑤合并其他部位原发性恶性肿瘤者;⑥有严重内、外科疾病者;⑦有远处转移者;⑧对本研究治疗药物过敏者。本研究已获得医院伦理委员会批准(批准号:2022-ky-01)。采用随机数字表法将本组84例患者分为观察组(n=42)与对照组(n=42)。两组基线资料差异无统计学意义(P>0.05,表1),具有可比性。
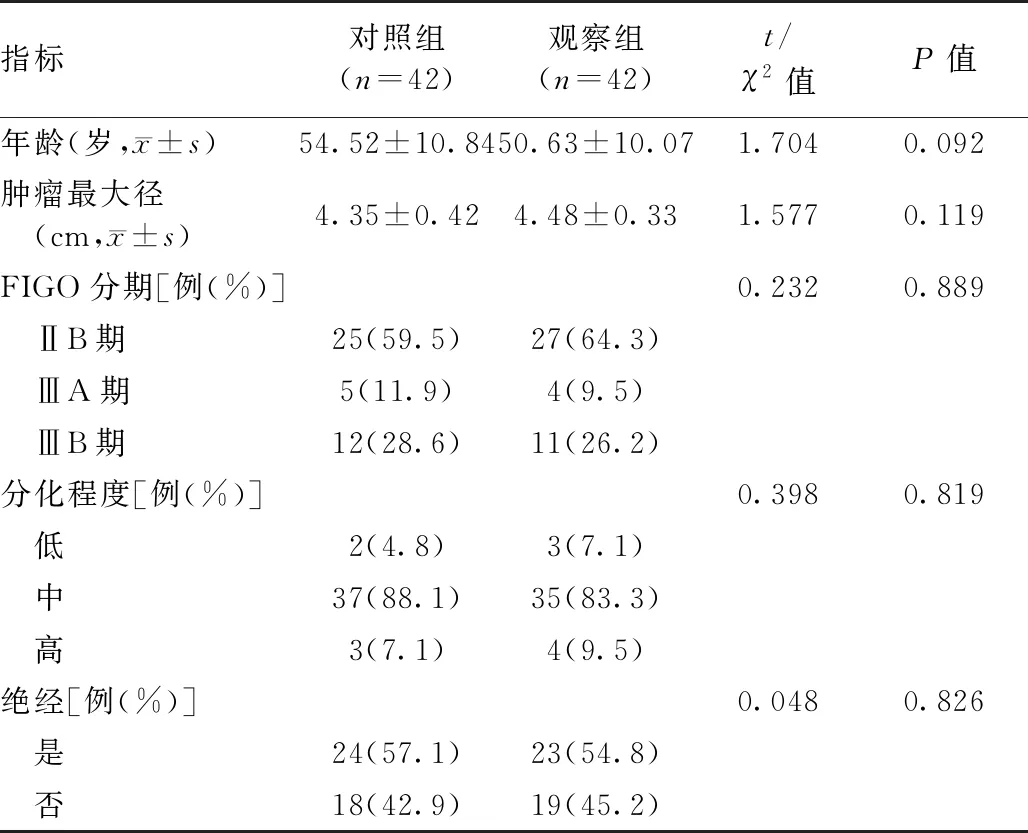
表1 两组基线资料比较
1.2 方法
1.2.1 对照组 采用顺铂新辅助序贯同步放化疗。新辅助化疗:紫杉醇(国药准字H20073210,山东辰欣药业股份有限公司)175 mg/m2,第1天静脉滴注;顺铂(国药准字H20040813,江苏豪森药业集团有限公司)25 mg/m2,第1~3天静脉滴注,1个周期为21 d,共治疗2个周期。同步放化疗:采用Varian Clinac IX6597医用直线加速器进行调强放疗外照射联合腔内照射模式治疗。转移盆腔淋巴结剂量为50.4~54.0 Gy,计划靶区剂量为45.0~50.4 Gy,完成调强放疗外照射实施腔内照射治疗,照射源为192Ir,放射剂量为5~7 Gy/次,总剂量为30~40 Gy。放疗间期采用静脉滴注洛铂10 mg/m2化疗,1周1次。
1.2.2 观察组 采用洛铂新辅助序贯同步放化疗。新辅助化疗:紫杉醇175 mg/m2,第1天静脉滴注;洛铂(国药准字H20050308,海南长安国际制药有限公司)30 mg/m2,第1天静脉滴注,1个周期为21 d,共2个周期。同步放化疗:采用Varian Clinac IX6597医用直线加速器进行调强放疗外照射联合腔内照射模式治疗。转移盆腔淋巴结剂量为50.4~54.0 Gy,计划靶区剂量为45.0~50.4 Gy,完成调强放疗外照射实施腔内照射治疗,照射源为192Ir,放射剂量为5~7 Gy/次,总剂量为30~40 Gy。放疗间期采用静脉滴注顺铂40 mg/m2化疗,1周1次。两组均持续治疗6个周期。
1.3 观察指标
①临床疗效:治疗6个周期后,参照实体肿瘤的疗效评价标准(RECIST)1.1版评估临床疗效。无新病灶出现或病灶消失记为完全缓解(complete response,CR);病灶消退>50%记为部分缓解(partial response,PR);病灶增大不超过25%或病灶缩小不足50%记为疾病稳定(stable disease,SD);病灶增大超过25%记为疾病进展(progressive disease,PD)。临床控制率=(CR+PR+SD)例数/总例数×100%[9]。②肿瘤标志物:采用酶联免疫吸附法检测两组血清癌胚抗原(carcino embryonic antigen,CEA)及鳞状上皮细胞癌抗原(squamous cell carcinoma,SCC)水平,试剂盒购自武汉菲恩生物科技有限公司。③免疫功能:采用Attune NxT流式细胞仪(北京昊诺斯科技有限公司)检测两组外周血T淋巴细胞亚群(CD4+/CD8+)及自然杀伤(NK)细胞水平;④不良反应:参照抗癌药物急性与亚急性不良反应及分级标准[10],记录两组治疗期间血小板减少、中性粒细胞减少、恶心、呕吐、腹泻等不良反应发生情况。⑤无进展生存时间:以电话或门诊复诊方式随访,每3个月随访1次,随访1年,随访截至2021年12月31日,终点事件为随访进展(死亡)事件发生或随访时间截止。
1.4 统计学方法

2 结果
2.1 观察组与对照组临床疗效比较
两组临床控制率比较差异无统计学意义(P>0.05),见表2。
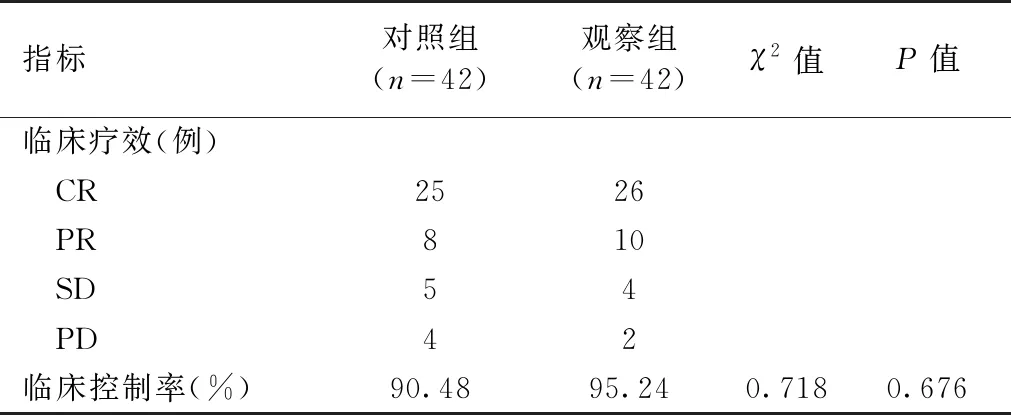
表2 观察组与对照组临床疗效比较
2.2 观察组与对照组治疗前后血清肿瘤标志物水平比较
治疗前、治疗后,两组血清CEA、SCC水平差异均无统计学意义(P>0.05);两组治疗后的血清CEA、SCC水平均较治疗前降低,差异有统计学意义(P<0.05);但两组血清CEA、SCC水平治疗前后差值差异无统计学意义(P>0.05),见表3。

表3 观察组与对照组治疗前后血清SCC、CEA水平比较
2.3 观察组与对照组治疗前后CD4+/CD8+及NK细胞水平比较
治疗前,两组CD4+/CD8+及NK细胞水平差异无统计学意义(P>0.05);治疗后,两组CD4+/CD8+及NK细胞水平均较治疗前降低(P<0.05),且观察组高于对照组(P<0.05),观察组CD4+/CD8+及NK细胞水平治疗前后差值均低于对照组,差异有统计学意义(P<0.05),见表4。
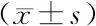
表4 观察组与对照组治疗前后CD4+/CD8+及NK细胞水平比较
2.4 观察组与对照组不良反应比较
两组治疗期间血小板减少、中性粒细胞减少、恶心、呕吐、腹泻Ⅰ~Ⅳ级不良反应发生率比较差异均无统计学意义(P>0.05),见表5。

表5 观察组与对照组不良反应发生率比较 [例(%)]
2.5 两组无进展生存时间比较
随访1年,两组患者各有1例丢失,随访率为97.62%(82/84)。观察组与对照组无进展生存时间分别为7.15(95%CI:4.21~11.14)个月、5.92(95%CI:3.91~10.79)个月,两组无进展生存曲线比较,差异无统计学意义(Log-rankχ2=3.112,P=0.079),见图1。
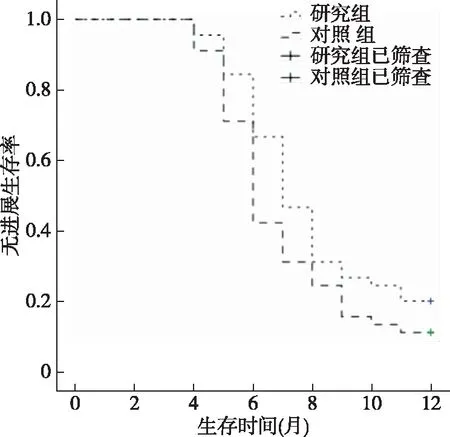
图1 两组患者无进展生存曲线比较
3 讨论
新辅助化疗能够缩小宫颈癌患者肿块,达到降期的目的,为患者后续放化疗提供有利条件[11]。目前,同步放化疗与新辅助化疗为局部晚期宫颈癌患者的常用化疗方案,但新辅助化疗的具体方案并不统一,临床常用的方案为紫杉醇联合铂类,取得了良好的疗效[12-13]。洛铂具有与顺铂相似甚至更强的抑制肿瘤效果,无耳毒性、肾毒性,对正常细胞存在一定的保护与识别效应,并且通常不需要水化处理。
为寻求一种有效的化疗方案,本研究对ⅡB~ⅢB期宫颈癌患者分别采用洛铂与顺铂新辅助序贯同步放化疗,结果显示,观察组与对照组的临床控制率、治疗前后的血清SCC、CEA水平及治疗期间Ⅰ~Ⅳ级不良反应发生率均差异无统计学意义,但治疗后两组血清CEA、SCC水平较治疗前降低,观察组的CD4+/CD8+及NK细胞水平高于对照组,观察组CD4+/CD8+与NK细胞水平治疗前后差值均低于对照组,提示对ⅡB~ⅢB期宫颈癌采用洛铂与顺铂新辅助序贯同步放化疗的临床疗效确切,洛铂新辅助序贯同步放化疗可减少对免疫反应的干扰。本研究进行Kaplan-Meier生存分析显示,两组1年无进展生存情况比较差异无统计学意义,提示采用洛铂与顺铂新辅助序贯同步放化疗对ⅡB~ⅢB期宫颈癌无进展生存期无明显影响。顺铂作为一种细胞周期非特异性抗肿瘤药,具有对乏氧细胞有效、抗瘤谱广等优势,目前已广泛应用于宫颈癌等多种恶性肿瘤的治疗[14]。洛铂具有烷化作用,对宫颈癌等多种恶性肿瘤细胞株具有明确的细胞毒作用,与顺铂的抗瘤作用相似,甚至更强,对于耐顺铂的细胞株仍具有一定的细胞毒作用[15]。研究表明,新辅助序贯方案如紫杉醇联合洛铂在宫颈癌新辅助化疗中应用广泛,临床控制率较高,且治疗期间不良反应无需特殊处理即可自行缓解[16]。国外有研究对207例ⅡB~ⅢB期宫颈癌患者采用以卡铂或顺铂为基础的新辅助化疗后,客观缓解率为56.50%[17]。McCormack等[18]采用新辅助化疗序贯顺铂每周同步放化疗,客观缓解率为85%,本研究客观缓解率为78.57%(33/42),低于上述研究,可能与纳入患者的FIGO分期不同等因素有关。Zhu等[19]研究指出,以铂类为基础的同步化疗中,在一定范围内,顺铂剂量峰值有利于增加放化疗的协同性,表现为较高的5年生存率及较低的局部复发率。国内有研究针对ⅡB~ⅢB期宫颈癌采用洛铂联合紫杉醇新辅助化疗序贯同步化放疗,结果显示,FIGO分期为ⅢA+ⅢB期、有淋巴结转移、同步化疗2个周期数为是影响患者总生存时间及无进展生存时间的独立危险因素[20]。
综上所述,洛铂与顺铂新辅助序贯同步放化疗治疗ⅡB~ⅢB期宫颈癌患者的临床疗效相当,安全可靠,对无进展生存期无影响,但洛铂新辅助序贯同步放化疗可减少对免疫反应的干扰。本研究选取病例数及随访时间有限,后续仍需要延长随访时间,并增大样本量来验证本研究的结论。
