乳腺癌内乳区淋巴结转移危险因素的Meta分析
2022-09-01刘金钊李依飞张玮芳崔国忠刘运江
刘金钊, 李依飞, 张玮芳, 崔国忠, 刘运江
乳腺癌是女性最常见的恶性肿瘤,并且现已超过肺癌成为全球发病率最高的癌症[1]。内乳区淋巴结(internal mammary lymph node,IMN)是乳腺癌淋巴引流的重要组成部分,大约10%~40%的乳腺癌患者发生内乳区淋巴结转移(internal mammary lymph node metastasis,IMNM)[2-3]。IMNM不仅是乳腺癌分期的重要依据,也是乳腺癌的独立预后指标[4]。一些研究发现,IMNM患者无法从IMN清扫中获益,但内乳区放疗可以降低乳腺癌的复发率及死亡率[5-6]。然而,在精准医疗的时代,仍然无法确定哪些患者最大程度地受益于内乳区放疗。2016年NCCN指南[7]指出,腋窝淋巴结(axillary lymph node,ALN)转移≥4枚作为内乳区放疗的1类证据,1~3个淋巴结转移的患者作为2A类证据,考虑内乳区放疗。Huang等[8]对2 269例乳腺癌患者扩大根治术进行分析发现,在≥4枚ALN转移的患者中,仅有36.8%的患者发生IMNM,然而在IMNM的患者中,仍然有15%的患者ALN阴性。对IMNM的不准确预测可能导致内乳淋巴结治疗过度或不足。因此,识别与乳腺癌患者IMNM相关的危险因素至关重要,能够帮助临床医生更准确地把握肿瘤分期、评估预后以及指导治疗,从而进一步降低复发风险、改善生存。虽然一些研究报告了预测乳腺癌IMNM的临床病理学特征,但是这些研究的样本量相对适中且结果存在一定的差异。因此我们进行了一项系统评价和Meta分析,旨在全面分析影响IMNM的风险因素。
1 资料与方法
本研究根据系统评价和荟萃分析首选报告项目(PRISMA)声明[9]提出的指南进行。
1.1 文献检索
在Medline、Embase以及Cochrane library数据库中进行了系统检索,以查找截至2021年1月29日发表的相关文章。检索的关键字是“breast cancer”、“lymph node metastasis”、“internal mammary lymph node OR internal mammary lymph chain OR intramammary lymph node”和“risk”。本研究的两位作者根据纳入标准对潜在合格文章的标题和摘要进行独立筛选,保留两位作者初步筛选的重复文章,存在分歧或不确定的文章通过协商解决。
1.2 文献纳入与排除标准
纳入标准:①有关乳腺癌IMNM风险的原创文章;②前瞻性或回顾性病历对照研究;③所有患者均经病理证实;④完整的病历可用于数据提取。排除标准:①会议摘要、案例报告、社论和综述;②非病例对照研究;③重复报道或缺乏完整临床数据的文章。
1.3 数据提取
使用标准化数据提取表从所有符合纳入条件的研究中提取以下数据:第一作者、发表年份、研究国家、研究日期、病例总数、IMNM发病率。以下可能的危险因素和相应的患者数量被独立记录:年龄、肿瘤大小、左右侧肿瘤、肿瘤位置、脉管瘤栓、组织学分级、雌激素受体(estrogen receptor, ER)状态、孕激素受体(progesterone receptor, PR)状态、人类表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)状态、ALN转移。
1.4 统计学方法
所有统计学分析均采用Review Manager 5.3软件进行。结果以优势比(oddsratio,OR)和95%置信区间(confidence interval,CI)表示,P≤0.05被认为差异具有统计学意义。采用Cochran’s Q统计量进行异质性检验,P<0.10表示异质性,并用I2统计量量化异质性程度(I2>50%表示高度异质性)[10]。当P<0.10、I2>50%时,将选择随机效应模型进行分析,否则,采用固定效应模型。纽卡斯尔-渥太华量表(newcastle-ottawa scale,NOS)用于评估纳入研究的偏倚风险,评分在6分或更高的研究被认为是高质量的。采用Begg’s漏斗图评估是否存在发表偏倚[11],漏斗图不对称意味着结果受研究之间的报告或发表偏倚的影响,而对称意味着无明显的发表偏倚。
2 结果
2.1 纳入文献的基本特征
检索发现2 732篇相关文献,通过严格筛选后共13项研究符合纳入标准,将7个不同国家/地区涉及5 484例乳腺癌患者纳入Meta分析。采用NOS对纳入研究进行质量评价,所有纳入研究的NOS评分均≥6分,质量均较高。纳入文献的基本特征,见表1。
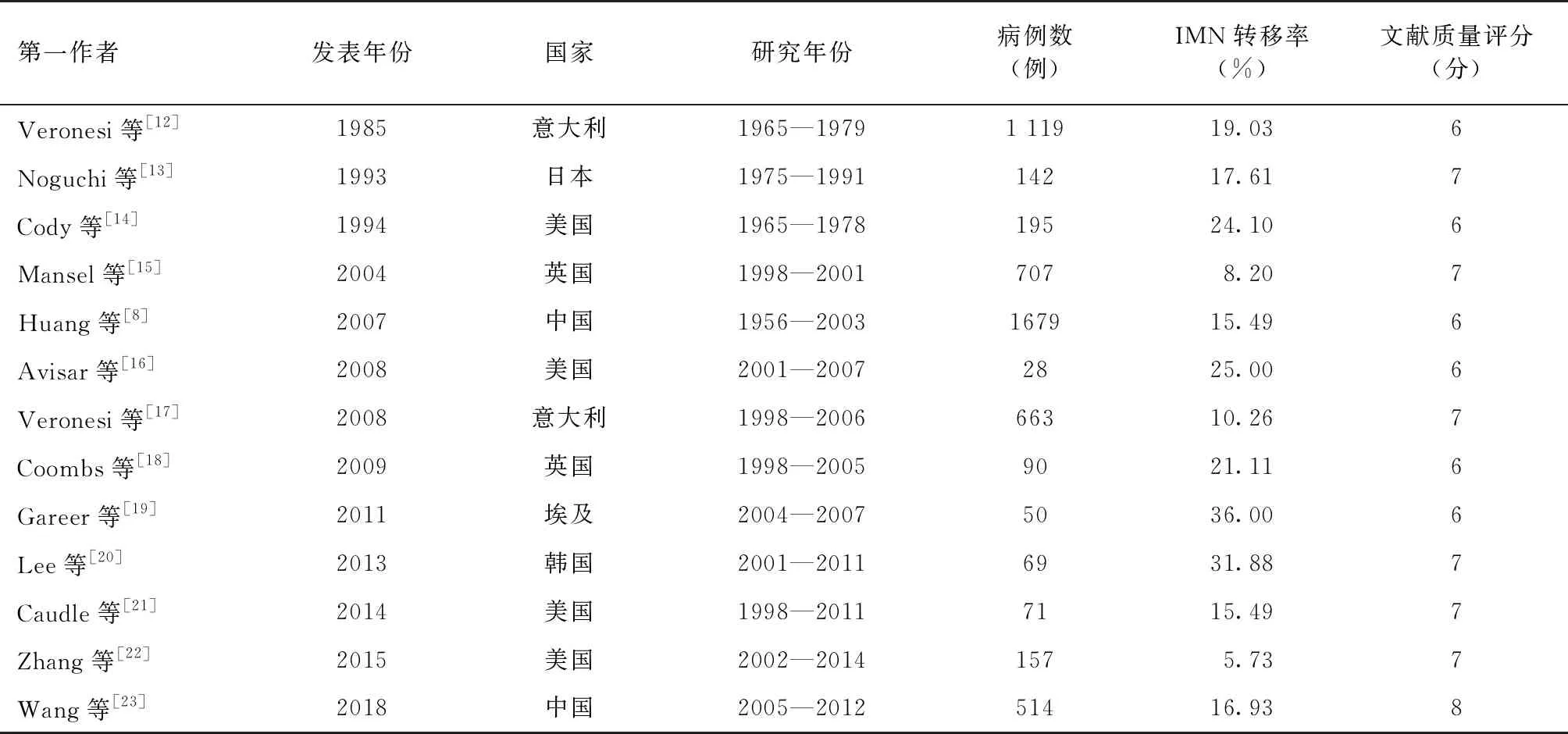
表1 纳入Meta分析文献一般特征
2.2 乳腺癌IMNM危险因素的Meta分析
2.2.1 年龄 8项研究报告了年龄与IMNM之间的关系。然而,在这8项研究中使用了不同的年龄区间。采用固定效应模型分析4项报告年龄≤35岁研究的数据(P=0.27,I2=24%)。年龄≤35岁发生IMNM的患者明显多于>35岁的乳腺癌患者(OR=1.83,95%CI=1.33~2.51,P<0.01)(图1)。采用随机效应模型确定年龄≤40岁是否是IMNM的危险因素(P=0.08,I2=55%)。30.36%年龄≤40岁的患者发生IMNM,然而仅有16.97%年龄>40岁的患者IMN存在转移,提示年龄≤40岁是IMNM的重要危险因素(OR=2.93,95%CI=1.16~7.41,P=0.02)(图2)。
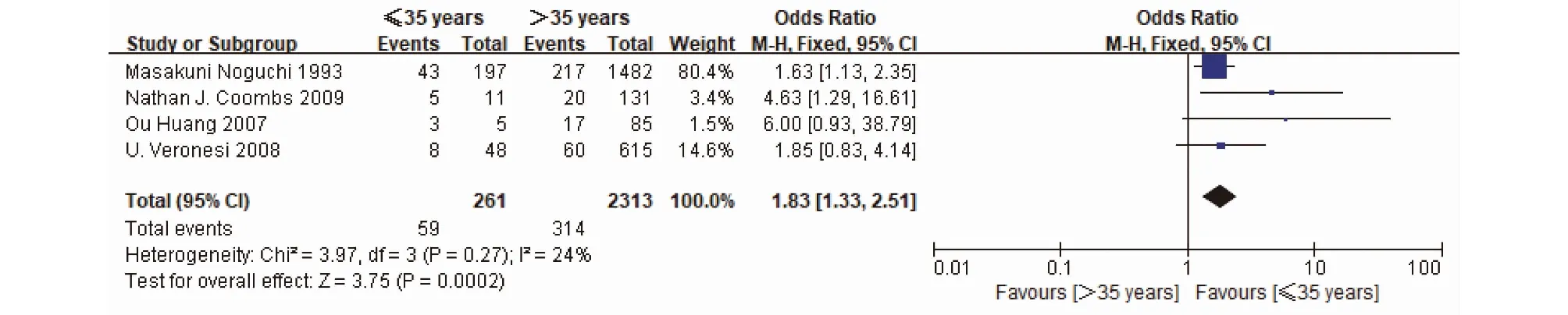
图1 年龄(≤35岁vs.>35岁)与IMNM关系的森林图

图2 年龄(≤40岁vs.>40岁)与IMNM关系的森林图
2.2.2 肿瘤位置采用固定效应模型对涉及4 488例患者的10篇文献进行分析以确定肿瘤位置是否影响IMNM的发生率。17.67%的内侧或中心肿瘤患者发生IMNM,高于外侧肿瘤患者(P=0.12,I2=37%),表明肿瘤位于内侧或中心位置对IMNM有预测作用(OR=1.32,95%CI=1.11~1.57,P<0.01)(图3)。
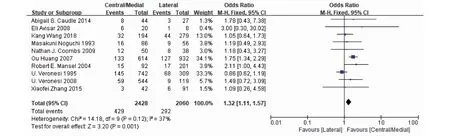
图3 肿瘤位置与IMNM关系的森林图
2.2.3 肿瘤大小 11篇涉及4 920例患者的文献采用随机效应模型(P=0.002,I2=64%)分析了肿瘤大小与IMNM之间的关系。18.34%肿瘤直径>2 cm的患者和12.11%肿瘤直径≤2 cm的患者IMNM。这表明肿瘤直径>2 cm与IMNM相关(OR=1.65,95%CI=1.14~2.41,P=0.009)(图4)。此外,我们研究了当肿瘤直径>5 cm时是否存在差异,使用固定效应模型分析了8项研究(P=0.09,I2=43%)。IMNM在肿瘤直径>5 cm的乳腺癌患者中更常见(OR=1.58,95%CI=1.25~2.00,P=0.000 2)(图5)。
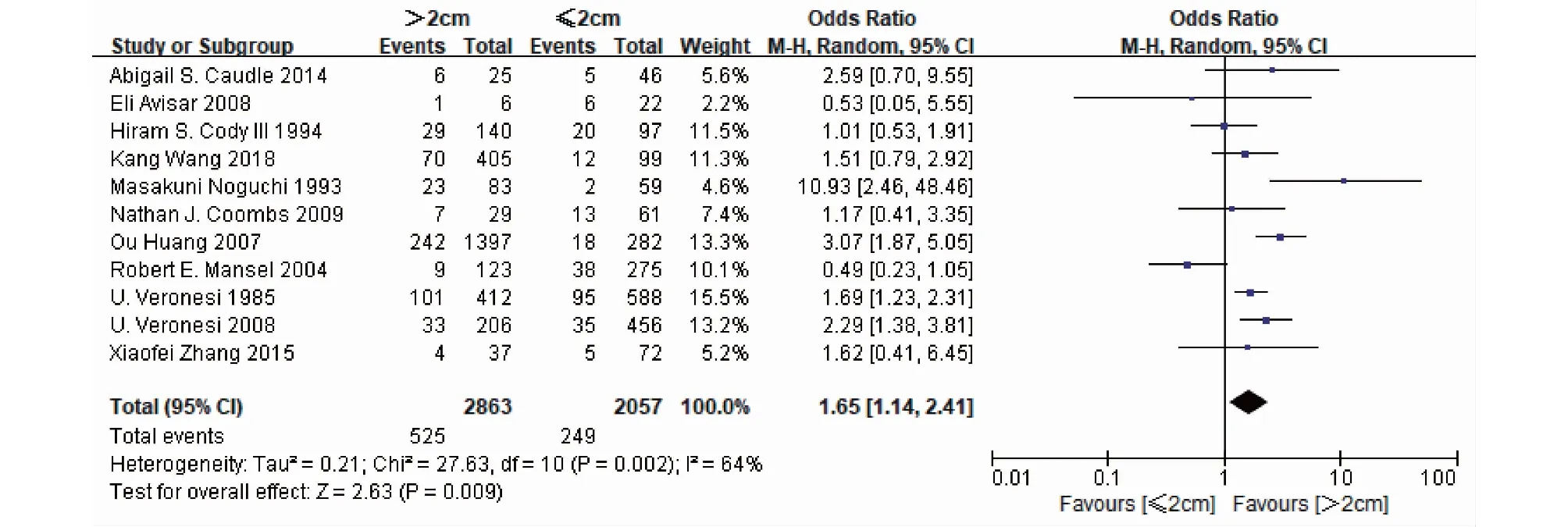
图4 肿瘤大小(>2 cm vs.≤2 cm)与IMNM关系的森林图
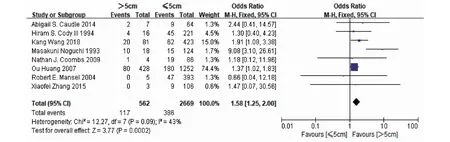
图5 肿瘤大小(>5 cm vs.≤5 cm)与IMNM关系的森林图
2.2.4 ALN转移 用随机效应模型来分析数据(P=0.02,I2=55%)。27.80%的ALN阳性患者和6.51%的ALN阴性患者有IMNM。这表明IMNM在ALN阳性患者中更常见(OR=5.27,95%CI=3.72~7.47,P<0.000 01)(图6)。根据ALN转移的数量,采用固定效应模型(P=0.63,I2=0)对4篇文献进行分析表明,ALN转移数量≥4枚是IMNM的最强预测因素(OR=6.49,95%CI=5.12~8.23,P<0.000 01)(图7)。
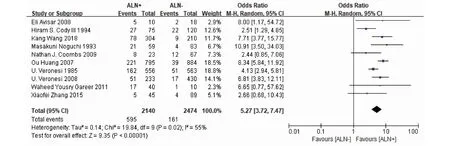
图6 腋窝淋巴结转移与IMNM关系的森林图
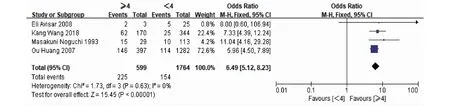
图7 腋窝淋巴结转移数目(≥4枚vs.<4枚)与IMNM关系的森林图
2.2.5 孕激素受体状态 采用固定效应模型评价PR状态对IMNM的影响(P=0.14,I2=37%)。在PR阴性的患者中IMNM的发生率较高,表明PR阴性是IMNM的危险因素(OR=1.35,95%CI=1.00~1.84,P=0.05)(图8)。

图8 孕激素受体状态与IMNM关系的森林图
2.2.6 其他危险因素 我们还研究了其他临床病理学因素与IMNM的关系。然而,我们发现左右侧肿瘤、组织学分级、脉管瘤栓、ER状态和HER2状态对乳腺癌患者IMNM的影响差异无统计学意义(P>0.05)(表2)。

表2 IMNM危险因素的Meta分析
2.3 发表偏移分析
将每个危险因素对应的文献逐个进行发表偏倚分析,乳腺癌IMNM危险因素的漏斗图均基本对称,表明Meta分析结果的稳定性较好。
3 讨论
乳腺癌的总体预后良好,但IMNM患者生存率低,且易发生远处转移[24]。对没有病理证实IMNM的患者进行内乳区放疗仍是一个有争议的问题。EORTC 22922-10925试验[25]15年的随访结果和MA.20[26]的10年随访结果均发现:与未接受内乳区放疗的患者相比,接受放疗患者的乳腺癌死亡率和乳腺癌复发率降低,但总体生存率并未明显改善。Taylor等[27]发现,由于乳腺癌放疗会导致心脏和肺等器官获得额外剂量,将提高非乳腺癌死亡率的风险(尤其对于长期吸烟的患者)。随着乳腺癌诊疗技术的不断进步,调强放疗(intensity modulated radiation therapy,IMRT)、容积弧形调强放疗(volumetric intensity modulated arc therapy,VMAT)、深呼吸屏气(deep inspiration breath hold,DIBH)等放疗技术的广泛应用可以降低患者的心肺剂量,减少心肺器官的并发症及继发性恶性肿瘤的发生[28]。虽然在新型技术的支持下内乳区放疗水平得到了进一步改善,但目前我们面临的挑战是如何准确地对乳腺癌患者进行风险分层,避免不必要的放疗毒性,从而定制个体化的辅助放疗决策。因此,准确预测评估IMN状态对于确定肿瘤分期以及选择合适的治疗至关重要。
本研究是评估乳腺癌患者发生IMNM相关危险因素的系统回顾和Meta分析。在本研究中确定的10个临床病理学因素中,年轻女性、内侧或中央肿瘤、较大的肿瘤、ALN转移、PR阴性与IMNM相关。然而左右侧肿瘤、组织学分级、脉管瘤栓、ER状态、HER2状态与IMNM无关。ALN转移、内侧或中央肿瘤和较大肿瘤已被普遍接受为与IMNM相关的变量[29]。Meta分析再次证实这些变量是预测乳腺癌患者发生IMNM中重要的危险因素。在IMNM的所有风险因素中,≥4枚阳性ALN在研究中显示出最高的OR(OR=6.49,95%CI=5.12~8.23),验证了阳性ALN在指导内乳区放疗中举足轻重的地位。IMN是内侧或中央乳腺癌第一个淋巴侵袭部位[30]。多项研究[23,31]称,内侧或中央肿瘤是乳腺癌IMNM的危险因素。本研究中,我们得出相同的结果,内侧或中央乳腺癌患者更易发生IMNM。众所周知,ALN阳性的乳腺癌患者可以从内乳区放疗中获益。然而,Courdi等[32]对1 630例ALN阴性乳腺癌患者回顾性分析发现,ALN阴性且肿瘤位于内侧或中央的乳腺癌患者接受内乳区放疗后总体存活率增加。一些研究表明内象限乳腺癌患者的存活率可能低于外象限肿瘤患者,其中最重要的原因很可能是由于IMNM的诊断不足和可能导致的治疗不足[33-34]。因此,肿瘤位置在预测内乳淋巴结转移及指导内乳区放疗中发挥的作用不容忽视。
淋巴结转移可以通过肿瘤大小来预测[35-36],我们的数据分析也得出了一致的结论,当肿瘤直径> 2 cm时,IMNM的风险升高,即使我们将数值调整至直径>5 cm时,这个结论仍然有效。原发性乳腺肿瘤的转移能力随着肿瘤的增大而增加[37-38],但本研究向以往理论提出了质疑,我们发现肿瘤直径>5 cm患者发生IMNM的风险比肿瘤直径>2 cm的患者略有所下降。Sopik等[39]通过对819 647例乳腺癌患者进行分析表明,浸润性乳腺癌患者的肿瘤大小与淋巴结转移之间呈非线性关系。Foulkes等[40]认为,肿瘤较小的乳腺癌可能含有固有的侵袭性细胞则易发生转移,常见于基底样型和BRCA1突变乳腺癌。因此,肿瘤大小需要通过结合乳腺癌亚型预测IMNM,为内乳区放疗的选择提供更准确的参考价值。
年轻女性具有较差的预后、较高的复发率,其中影响年轻患者预后重要的原因之一为淋巴结转移[41-43]。Huang等[8]在一项回顾性研究中发现:年轻的乳腺癌患者具有较高IMNM的风险。在本研究中,我们分析获得了类似的结果:≤35岁与≤40岁的年轻女性IMNM的发病率较高。Narod[44]指出,在年轻乳腺癌患者中,较小的肿瘤就呈现扩散的倾向。尽管年轻患者的发病率较低,但乳腺癌仍然是年轻女性最常见的恶性肿瘤[45]。我们应该更加关注这类特殊人群,为指导其治疗、提高预后提供依据。
分子标志物不仅在乳腺癌治疗决策中具有重要地位,而且在评估预后及治疗效果中发挥着关键性作用。分子标志物在预测乳腺癌区域淋巴结转移的影响同样不容忽视。从我们研究的汇总分析中首次发现,PR阳性与乳腺癌患者IMNM的发生率显著降低有关。有争议的是,Wang等[23]认为HER2阳性乳腺癌与IMNM相关,与HR状态无关。与本研究类似,该研究为多中心研究,我们无法完全控制由于多个中心的组织病理学技术不同所导致的偏倚。然而,由于多中心之间病理诊断的差异,这些发现必须谨慎解释。需要进一步研究分子标志物在预测IMNM中的潜在作用。
本研究具有一定的局限性。首先,这项Meta分析所选定的研究均为回顾性研究,由于回顾性队列研究收集数据的真实性和可靠性的降低可能会影响结果的质量。其次,我们的研究存在一定的异质性,可能归因于患者类型、研究时代、手术方式和病理学诊断技术的差异。最后,由于纳入的研究中缺乏影像学资料,未能明确辅助检查在预测IMNM所发挥的作用,因此影像学检查与IMNM相关的风险因素需要进一步评估。
综上,乳腺癌内乳区淋巴结转移危险因素Meta分析的结果表明,ALN转移、内侧或中央肿瘤、较大肿瘤、年轻女性和PR阴性是IMNM相关的重要危险因素。结合1项或多项危险因素可以潜在地识别哪些患者将受益于内乳区放疗。我们期望这些结果可以指导乳腺癌患者的个体化治疗。
