牛源二肽基肽酶-IV的高效制备及性质
2022-09-01赵嘉妮陈寅格张凌晶张志刚林家仕曹敏杰
赵嘉妮,陈 宏,陈寅格,翁 凌,张凌晶,张志刚,林家仕,曹敏杰,,*
(1. 集美大学体育学院,福建 厦门 361021;2. 集美大学食品与生物工程学院,福建 厦门 361021;3. 肉食品安全生产技术国家重点实验室,福建 厦门 361100)
随着我国国民生活方式的改变,2型糖尿病(type 2 diabetes,T2DM)患病率急剧上升。据《中国2型糖尿病防治指南(2020年版)》显示,我国成人糖尿病患病率升至11.2%,其中T2DM占90%以上。T2DM及其并发症是严重危害人类健康的慢性疾病,《2013年全球疾病负担研究》已将糖尿病确定为预期寿命缩短的第九大原因。胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)是一种肠道来源的肠促胰岛素激素,可刺激胰岛素并抑制胰高血糖素分泌,二肽基肽酶IV(dipeptidyl peptidase-IV,DPP-IV)活性抑制剂就是一种可增强肠促胰岛素作用的药物,可用于T2DM的治疗。第一种DPP-IV抑制剂类药物西格列汀,已在2006年获得美国食品和药物管理局批准。接着,沙格列汀在2009年也被批准用于治疗T2DM。
DPP-IV又称T细胞表面抗原CD26,是细胞表面的一种丝氨酸蛋白酶,约由766 个氨基酸组成,可在肝、肠、胰腺、胎盘、胸腺等多种组织和细胞类型中表达。此外,在血浆中也发现了这种酶的可溶形式。DPP-IV不仅在T2DM中起调节作用,在包括免疫、炎症、中枢神经系统和内分泌功能在内的生理过程中也起着重要作用。基于它的结构特性,DPP-IV还具有一定的氨肽酶功能。
DPP-IV能特异性地从肽底物氨基端切去第2个位置为Pro或Ala的二肽。具有这种氨基酸序列的生理肽包括神经肽Y、循环肽激素YY、GLP-1和胰高血糖素样肽-2、胃抑制肽以及旁分泌趋化因子RANTES。其中,GLP-1不仅能够刺激胰岛素的分泌,还与胰腺β细胞和心血管系统的保护作用、减少食物摄入、促进胃排空及体重减轻有关,在降低糖尿病的形成中起着重要作用。然而,GLP-1在体内可被DPP-IV迅速降解,超过一半进入门静脉循环的GLP-1在进入体循环之前已经被DPP-IV分解,半衰期极短。因此,抑制DPP-IV活性可防止GLP-1的降解,从而增强肠促胰岛素的作用。更有研究表明,T2DM患者体内的DPP-IV活性会增强。基于以上的生理特性,DPP-IV 被作为治疗糖尿病的靶点。DPP-IV抑制剂类药物已被证明可以降低糖化血红蛋白水平,而不会增加低血糖和体质量的风险,具有良好的耐受性和安全性。该类药物也对心血管疾病患者起到保护作用,并且可用于T2DM伴随肾功能减退的患者。
目前,以DPP-IV为靶点酶进行DPP-IV抑制肽的研究受到越来越多的关注。尽管早在1966年,DPP-IV就已经在小鼠肝脏中被发现,迄今为止也已从多种动物组织中分离纯化了DPP-IV。然而,纯化过程繁琐,酶活力低、纯度不高等问题时常发生,而商品化DPP-IV大多为重组蛋白且价格昂贵(某公司重组人DPP-IV的价格为5 972.3 元/10 μg)。经对比分析发现,牛DPP-IV的氨基酸序列与人DPP-IV的氨基酸序列同源性高达88.6%,具有高度相似的酶学性质。因此,从牛组织中纯化天然DPP-IV对于其抑制剂的研究有重要的实际价值。本研究以牛肾为原料,探索以较为快捷的方法分离得到高纯度DPP-IV,并对其性质进行分析,旨在为DPP-IV及其抑制剂的深入研究提供基础材料。
1 材料与方法
1.1 材料与试剂
新鲜牛肾脏购于厦门市集美区菜市场。
Superdex 200 Increase 10/30GL凝胶柱 美国GE Healthcare公司;荧光底物Gly-Pro-MCA 日本Peptide Institute公司;其他试剂均为国产分析纯。
1.2 仪器与设备
PT-2100组织捣碎机 瑞士Kinematic公司;Avanti J-26高速冷冻离心机 美国Beckman公司;恒温水浴锅德国Memmert公司;AKTA Basic UPC 10蛋白纯化装置 美国GE Healthcare公司;G:BOX凝胶成像仪英国Syngene公司;Chirascan圆二色谱仪 英国Applied Photophysics公司;NanoDrop-100微量蛋白核算测定仪美国Thermo Fisher Scientific公司;FP-8200荧光分光光度计 日本Jasco公司;Powerpac Basic电泳仪 美国Bio-Rad公司;M200 PRO酶标仪 瑞士Tecan公司。
1.3 方法
1.3.1 DPP-IV的分离纯化
1.3.1.1 样品前处理
从新鲜牛肾中分离皮质(约100 g),切碎,加入300 mL的超纯水,用组织捣碎机进行捣碎后,4 ℃、10 000×离心30 min,取上清液即为粗酶液。
1.3.1.2 酸沉淀
向粗酶液中加入曲拉通(Triton X-100)至体积分数为0.1%,充分搅拌均匀后,用6.0 mol/L盐酸将粗酶液的pH值调至3.8。先在60 ℃水浴加热20 min,再于37 ℃水浴加热2 h。冰水冷却后,4 ℃、10 000×离心30 min,取上清液。
1.3.1.3 硫酸铵盐析
将上述上清液经60%~85%硫酸铵溶液盐析后,用少量20 mmol/L Tris-HCl溶液(pH 8.0)复溶沉淀,再用100 kDa浓缩管进行浓缩,去除外液。
1.3.1.4 Superdex 200 Increase 10/300 GL凝胶柱
使用AKTA蛋白纯化系统,将浓缩好的样品上样于预先经20 mmol/L Tris-HCl(pH 8.0)平衡好的Superdex 200 Increase 10/300 GL凝胶过滤柱。上样结束后,用相同缓冲液进行流洗,流速0.3 mL/min,收集流洗液,0.5 mL/管,分别测定各组分蛋白含量及酶活力。
1.3.2 蛋白质浓度测定
DPP-IV纯化过程中蛋白质浓度用微量蛋白核酸测定仪测定,以样品在280 nm波长处吸光度表示。
1.3.3 DPP-IV活力的测定
酶活力测定以Gly-Pro-MCA为底物,参照陈宏等的方法略作修改。方法如下:将50 μL酶与900 μL缓冲液充分混合,加入50 μL浓度为10 μmol/L的底物,37 ℃加热30 min后立即加入1.5 mL终止液(甲醇-异丙醇-超纯水35∶30∶35(/))终止反应。用FP-8200荧光分光光度计测定反应释放的7-氨基-4-甲基香豆素(7-amino-4-methylcoumarin,AMC)荧光强度,测定的激发波长为380 nm,发射波长为450 nm。一个酶活力单位(U)定义为每分钟释放1 nmol AMC所需要的酶量。
1.3.4 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)
浓缩胶为5%,分离胶为10%,电泳结束后用考马斯亮蓝R250进行染色,之后用脱色液脱色至蛋白条带清晰,用凝胶成像系统记录。
1.3.5 质谱鉴定
对纯化的酶进行SDS-PAGE,切下目的条带并装入洁净的Eppendorf管中。样品委托深圳市微纳菲生物技术有限公司进行基质辅助激光解吸电离飞行时间质谱鉴定。
1.3.6 糖蛋白鉴定
“不仅是机械设备的零件坏了,我们会提供技术的帮助。有些大型农机车,几个小时就需要更换润滑油,我们都会带着技术人员为他们第一时间更换。”张文兴说。
使用过碘酸雪夫染色(periodic acid-Schiff staining,PAS)试剂盒,鉴定DPP-IV是否为糖蛋白。
1.3.7 2D-PAGE
参考唐逸的方法,将2 mg/mL DPP-IV与水合液(7 mol/L尿素、2 mol/L硫脲、2% CHAPS)、1 mol/L二硫苏糖醇(-dithiothreitol,DTT )、两性电解质和溴酚蓝混合,将混合液和胶条置于电泳槽中,用矿物油覆盖,在150 V电压下进行等电聚焦电泳,直至结束。之后将胶条分别置于2% DTT和2.5%碘乙酰胺缓冲液中平衡20 min,再进行SDS-PAGE。
1.3.8 非还原条件下SDS-PAGE
取蛋白样品(2 mg/mL)加入等体积的溴酚蓝上样缓冲液混匀,10 000×离心5 min,取上清液即为样品,之后进行凝胶电泳。
1.3.9 二级结构分析
在室温下,利用圆二色谱仪对纯化的DPP-IV(0.4 mg/mL)进行扫描,扫描波长为195~255 nm,再在10~90 ℃(以5 ℃为间隔)范围内以1 ℃/min加热速率测定不同温度下DPP-IV的二级结构,利用CDNN软件计算该酶的热变性温度()。
1.3.10 DPP-IV热稳定性分析
参照Pascual等的方法并略作修改。将纯化的DPP-IV溶液(稀释至200 倍)分别置于55、60、65 ℃和70 ℃水浴锅加热,加热时间分别为5、10、20、30、40、50 min和60 min,取出置于冰上,取3 μL酶与67 μL缓冲液于96 孔黑色荧光板中充分混合,加入30 μL 10 μmol/L的底物,置于37 ℃反应20 min,立即用酶标仪测定酶活力。将不加热酶的活力定义为100%,其他温度下为其相对酶活力。
参照Pascual等的方法并略作修改。用不同pH值(3.0~6.0)缓冲液将纯化的DPP-IV溶液稀释至200 倍后,4 ℃下分别放置1、2、3、4、5 h和6 h后参照1.3.3节方法测定酶活力。将用20 mmol/L Tris-HCl溶液(pH 8.0)稀释的酶活力定义为100%,计算出其他pH值下的相对酶活力。
1.3.12 金属离子对DPP-IV活力的影响
参照酶活力测定方法,将DPP-IV溶液与不同浓度金属离子共孵育5 min后,测定其酶活力,不加金属离子的酶活力定义为100%,计算出金属离子存在下的相对酶活力。
1.4 数据处理
所有实验均设3 组平行,运用SPSS 21.0进行数据分析。
2 结果与分析
2.1 牛肾皮质DPP-IV的分离纯化
为除去粗酶液中所含的部分杂蛋白及色素,在得到粗酶之后,对样品进行酸沉淀和硫酸铵盐析。再利用凝胶过滤层析的方法,除去剩余的杂蛋白,分离得到纯化的DPP-IV(图1)。如图2所示,SDS-PAGE结果表明,在经过一系列纯化过程之后,得到分子质量约为106 kDa的单一条带。凝胶过滤层析得到2 个蛋白峰,其中一个蛋白峰与酶活力峰相重合。纯化过程如表1所示,从100 g牛肾皮质中纯化得到2.9 mg蛋白,得率为9.5%,纯化倍数为169.9 倍。
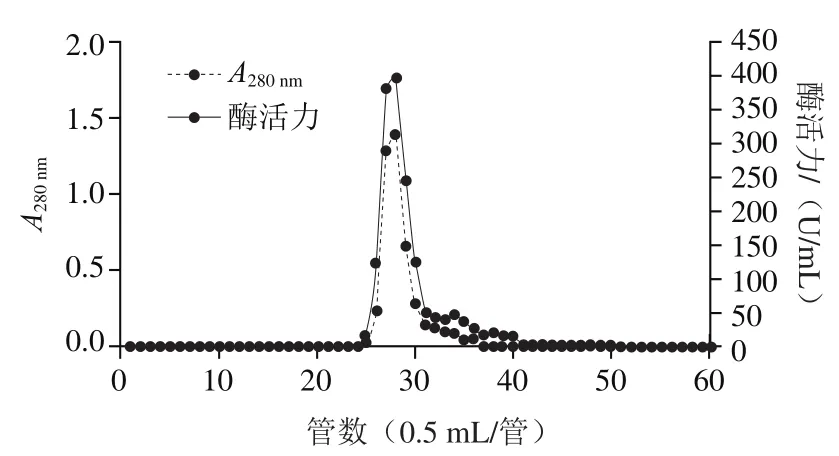
图1 DPP-IV的Superdex 200 Increase 10/300 GL凝胶过滤层析Fig. 1 Gel filtration chromatogram of DPP-IV on Superdex 200 Increase 10/300 GL
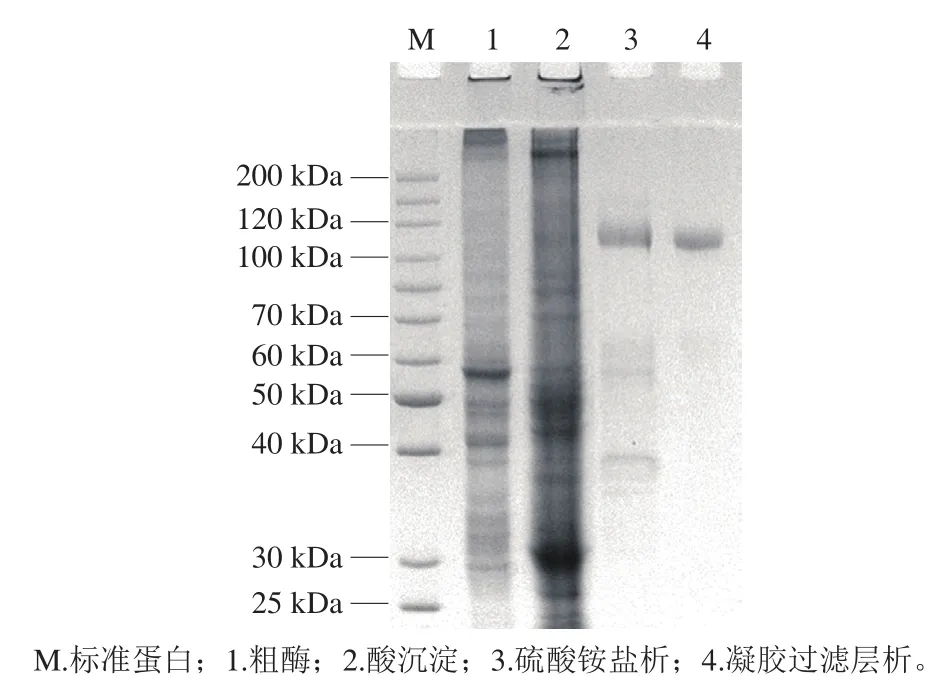
图2 DPP-IV的SDS-PAGE(还原条件)分析Fig. 2 Reducing SDS-PAGE analysis of DPP-IV
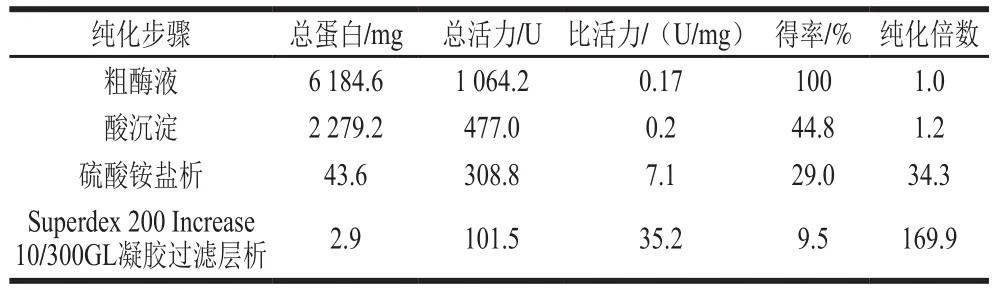
表1 牛肾皮质DPP-IV纯化过程Table 1 Summary of purification of DPP-IV from bovine kidney
2.2 DPP-IV的质谱鉴定
将纯化的DPP-IV进行SDS-PAGE后切胶回收,经基质辅助激光解吸电离飞行时间质谱鉴定。图3为DPP-IV肽质量指纹一级图谱结果。表2显示,鉴定得到12 个肽段,共517 个氨基酸残基。图4是肽段与家牛DPP-IV的序列比对结果,将质谱检测数据与NCBI数据库比对发现,其与牛()(gi:27806655)DPP-IV的氨基酸序列高度匹配,证明纯化蛋白为牛DPP-IV。
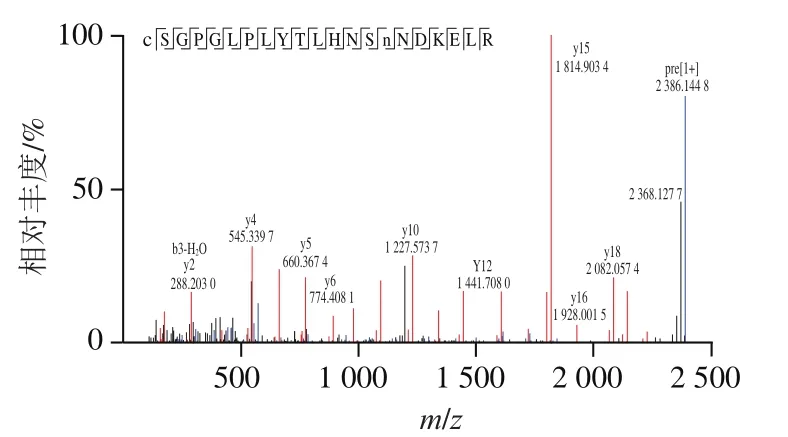
图3 牛肾DPP-IV特有肽段一级质谱图Fig. 3 Mass spectrum of DPP-IV from bovine kidney

表2 牛肾DPP-IV肽段序列Table 2 Peptide sequences of DPP-IV from bovine kidney

续表2

图4 肽段与家牛DPP-IV的序列比对Fig. 4 Peptide fragment alignment of DPP-IV from bovine kidney with that from B. taurus
2.3 牛肾皮质DPP-IV的酶学性质分析
2.3.1 PAS染色
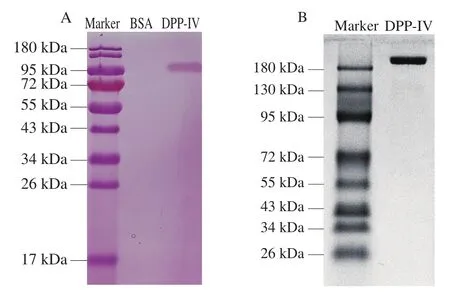
图5 DPP-IV的PAS染色(A)及非还原条件下的SDS-PAGE分析(B)Fig. 5 PAS staining (A) and non-reducing SDS-PAGE analysis (B) of DPP-IV
对纯化的DPP-IV进行PAS染色,结果如图5A所示。DPP-IV能被PAS试剂染色,而阴性对照牛血清白蛋白(bovine serum albumin,BSA)不能被染色,表明DPPIV为糖蛋白。
2.3.2 非还原条件下SDS-PAGE
对DPP-IV进行非还原条件下SDS-PAGE分析,结果如图5B所示,纯化的DPP-IV分子质量约为210 kDa,相当于还原条件下SDS-PAGE蛋白质分子质量(106 kDa)的2 倍,故推测DPP-IV在天然条件下以二聚体的形式存在。该结果与人重组DPP-IV在非还原条件下分子质量约为240 kDa,即同样是以二聚体的形式存在一致。
2.3.3 2D-PAGE
对DPP-IV进行双向电泳分析,结果如图6所示。电泳凝胶上显示出单一的点,其等电点约为pH 5.8,分子质量较SDS-PAGE结果略高,推测是由于DPP-IV是糖蛋白的原因影响迁移。
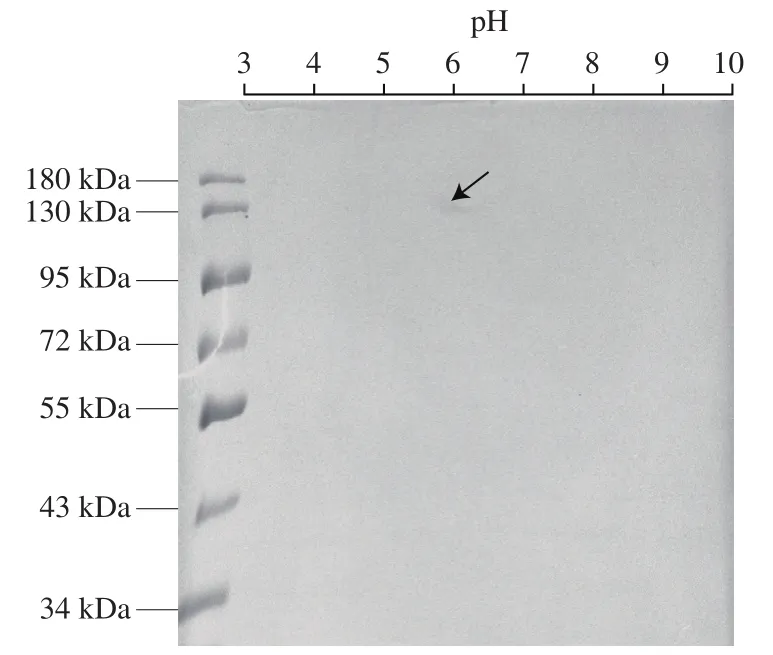
图6 牛肾DPP-IV的2D-PAGE分析Fig. 6 2D-PAGE analysis of DPP-IV from bovine kidney
2.3.4 DPPIV二级结构分析
圆二色谱扫描结果如图7A所示,DPP-IV具有明显的-折叠构象。当温度在70 ℃以下时,圆二色谱的特征吸收峰未发生明显变化,随温度升高,正负吸收峰强度均增大。通过CDNN软件分析DPP-IV二级结构在不同温度下相对含量变化。在70 ℃时,DPP-IV二级结构含量无明显变化,当温度达到80 ℃及以上时,DPP-IV二级结构中,-螺旋占比逐渐升高,-折叠占比逐渐减少,DPP-IV的二级结构发生改变(表3)。图7B显示,DPP-IV热变性温度为(72.7±0.3)℃,说明该酶具有良好的热稳定性。
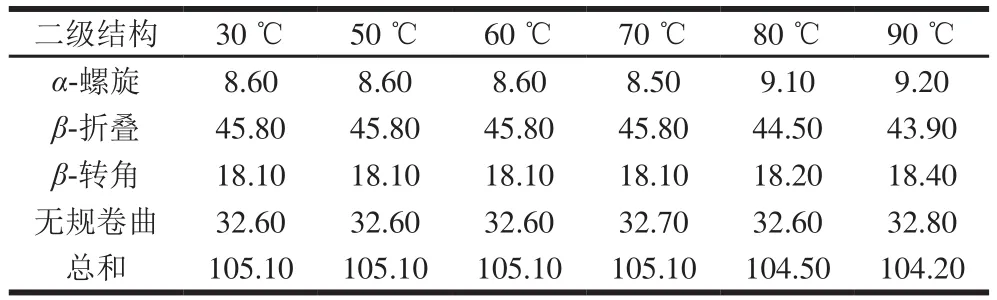
表3 DPP-IV二级结构占比分析Table 3 Secondary structure composition of DPP-IV%
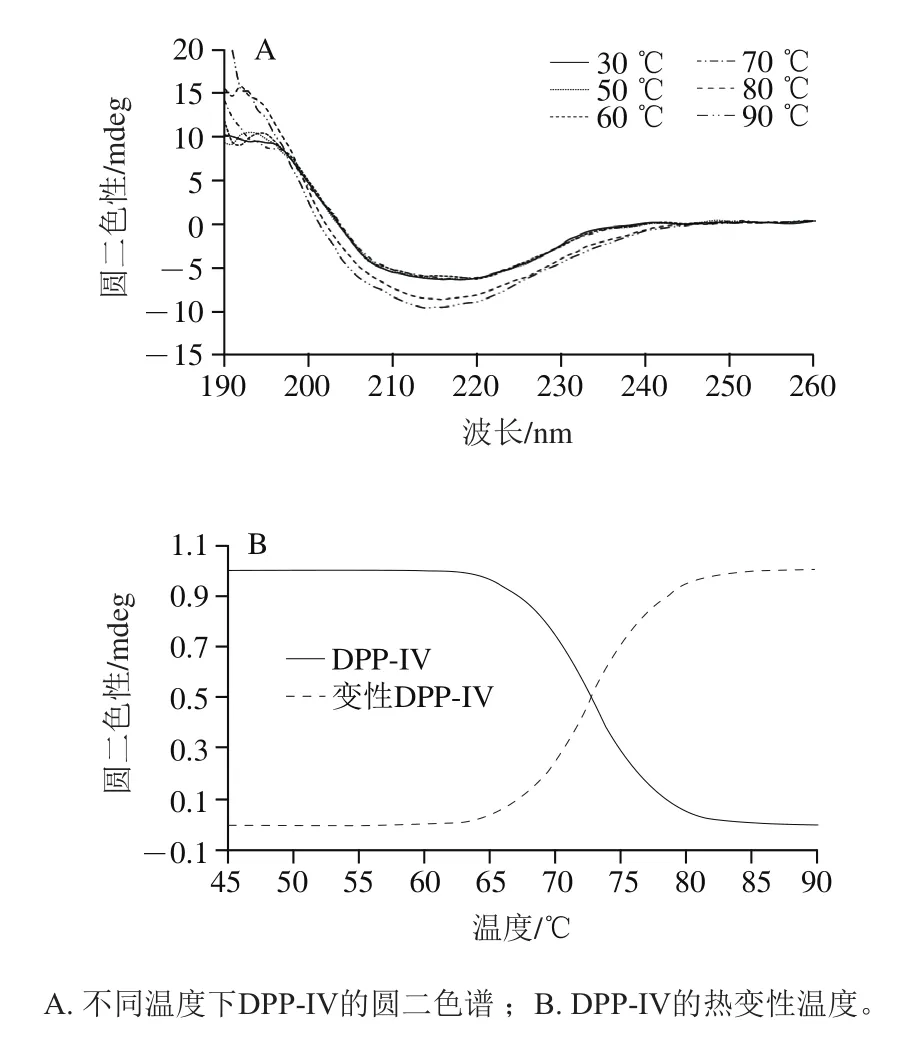
图7 DPP-IV的二级结构分析Fig. 7 Circular dichroism spectra of DPP-IV at different temperatures and determination of its denaturation temperature
2.3.5 DPP-V热稳定性分析
如图8所示,当温度在55 ℃时,随时间延长,DPPIV活力基本保持不变,60 ℃时酶活力略有下降,但仍能保持在80%以上。在65 ℃时,酶活力降低速度加快,70 ℃加热20 min后,酶活力几乎为零。说明该酶在60 ℃以下能保持相对较高的活性,当温度超过60 ℃时,DPP-IV活力逐渐降低,70 ℃时DPP-IV迅速失活,表明DPP-IV在60 ℃以下能够保持较为稳定的酶活力。
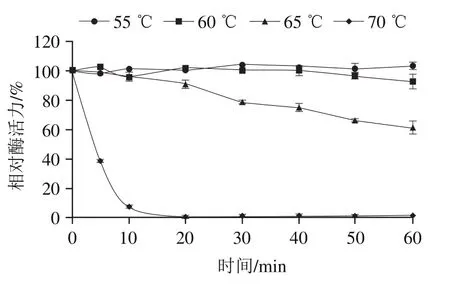
图8 DPP-IV的热稳定性分析Fig. 8 Thermal stability of DPP-IV
2.3.6 DPP-IV的pH值稳定性分析
pH值对酶促反应速率的影响,主要是由于pH值的改变导致酶的催化基团以及底物分子的解离状态改变,或者导致酶蛋白的变性。如图9所示,DPP-IV在pH 4.0、5.0、6.0时能保持较高的酶活力,在pH 3.0时,随时间延长,酶活力略有下降,但仍能保持在80%左右,说明DPP-IV具有较好的pH值稳定性。
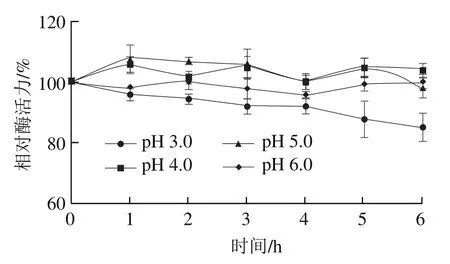
图9 DPP-IV的pH值稳定性Fig. 9 pH stability of DPP-IV
2.3.7 金属离子对DPP-IV活力的影响
将DPP-IV与不同金属离子于37 ℃下共孵育5 min,之后以 Gly-Pro-MCA为底物,测定其剩余酶活力。图10结果表明,Zn对DPP-IV具有强烈的抑制作用,且随着浓度的增高抑制作用随之增强,在浓度为1 mmol/L时,抑制率达到98%,其次是Fe和Fe,在1 mmol/L下对DPP-IV的抑制率接近80%。其他离子对DPP-IV的抑制作用相对较弱,即使在1 mmol/L浓度下,抑制率也都不超过40%。
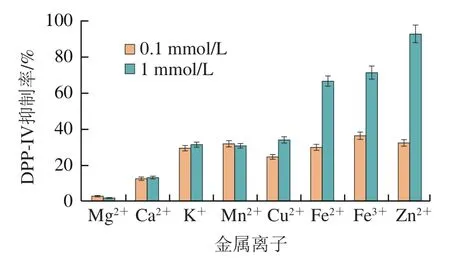
图10 不同浓度金属离子对DPP-IV活力的影响Fig. 10 Effect of different concentrations of metal ions on DPP-IV activity
3 讨 论
以牛肾为原料,分离得到纯度较高的DPP-IV,经质谱鉴定发现其与家牛DPP-IV的氨基酸序列相对应,同源性为100%,证明纯化的蛋白为DPP-IV。
对于DPP-IV的纯化,Iwaki-Egawa等以人血清为原料,经DEAE-Cellulose DE-52、DEAECellulofine A-800、Sephacryl S-300 HR、Butyl-Toyopearl 650S纯化得到人血清DPP-IV,但需要过4次柱层析,过程繁琐;De Meester等利用DEAE Sepharose和ADA Sepharose分别从人精浆和前列腺小体中分离得到DPP-IV。但由于人源DPP-IV的原料难以获得,更多的研究选择其他哺乳动物为原料进行。先前对于哺乳动物DPP-IV的分离纯化研究,大都需要使用多根色谱柱进行,过程复杂。如以牛肾脏为原料,通过CM-cellulose、Sephadex G-200和3 次DEAE阴离子交换柱才纯化得到DPP-IV。本研究通过1 次柱层析就可高度分离纯化出牛肾DPP-IV,过程简单,耗时短且纯度较高。纯化过程中,酸沉淀、热处理和硫酸铵盐析等步骤除去大部分杂蛋白,之后通过100 kDa的超滤浓缩膜进一步除去小部分杂质和低分子质量蛋白,最后通过凝胶过滤层析纯化得到DPP-IV。本研究从牛肾中分离纯化DPP-IV的得率为9.5%,高于从牛肾脏(3.1%)和猪肾脏(8.3%)中纯化的得率。
DPP-IV作为一种膜结合的糖蛋白,其胞外主要是由N端的一个8叶-螺旋结构域和C端的一个/水解结构域组成,螺旋桨结构域与水解酶结构域相重叠,催化三联体(S630、H740和D708)位于这两个结构域的界面上。圆二色谱结果说明DPP-IV具有典型的-折叠构象,当温度超过70 ℃时,-折叠占比减少,-螺旋占比增加,说明DPP-IV的-折叠构象遭到破坏,二级结构发生改变。非还原条件下的SDS-PAGE结果显示,DPP-IV是由2 个相同亚基组成的二聚体,与此前报道的膜结合的DPP-IV以同源二聚体的形式存在于细胞表面相对应。二聚体结构有利于DPP-IV的催化活性,而单体不具有催化活性。
2D-PAGE结果表明,DPP-IV等电点约为5.8,略高于Buckley等报道的牛血清样DPP-IV(4.74)和Brownlees等报道的牛肾DPP-IV(4.25),与陈宏报道的猪肾DPP-IV(6.1)接近。在金属离子对DPP-IV活力的影响中,Zn的影响最为强烈,这与报道Zn可作为DPP-IV的抑制剂一致。今后,有必要对Zn、Fe及Fe对DPP-IV活力及二级结构的影响作进一步细化研究。
4 结 论
以牛肾皮质为原料,通过酸沉淀、硫酸铵盐析和凝胶过滤层析纯化得到高纯度DPP-IV。DPP-IV是分子质量为106 kDa的糖蛋白,等电点为5.8,易形成二聚体,具有典型的-折叠结构。DPP-IV的热稳定性和pH值稳定性较好,Zn对它具有较强的抑制作用。本研究简化了DPP-IV的纯化步骤,提高了纯化效率,为低成本制备DPP-IV并应用于抑制肽筛选提供了参考。
