银耳多糖与大豆分离蛋白的相互作用及流变性能
2022-09-01朱叶力滕建文
龙 慧,李 祎,朱叶力,滕建文,夏 宁
(广西大学轻工与食品工程学院,广西 南宁 530004)
多糖和蛋白质是生物体系中最重要的两种生物活性大分子,对保持食品品质和发挥食品功能特性有重要意义。蛋白质和多糖在溶液中可通过静电相互作用形成复合凝聚体,这受蛋白质和多糖的种类、蛋白与多糖的浓度、比例、电荷密度、分子质量、pH值、离子强度和温度等因素的影响。研究表明复合凝聚体具有比单独的蛋白质或多糖更好的功能活性,在稳定乳液、活性物质的包埋与保护、新型复合材料等领域得到了广泛应用。由于蛋白质和多糖结构的复杂性和多样性,不同蛋白质和多糖形成复合凝聚的条件往往不同,因此对不同来源的蛋白质与多糖相互作用的研究是这一领域的热点。
大豆分离蛋白(soybean protein isolate,SPI)作为一种优质的植物蛋白,具有凝胶性、乳化性和发泡性等多种功能活性。其中,含量最多的7S和11S亚基与SPI功能活性紧密相关。SPI在食品加工等领域应用广泛,但其对pH值较为敏感,在等电点附近稳定性较差。以植物蛋白为体系的饮料在生产和贮藏过程中最常见的问题是蛋白沉淀等不稳定现象,严重影响产品品质。蛋白质与多糖的静电相互作用可改变蛋白质的等电点,提高体系的稳定性。Huang Guoqing等发现SPI与壳聚糖的复合凝聚能使SPI热稳定性提高38~43 ℃。Niu Fuge等发现卵白蛋白与阿拉伯胶发生相互作用后,体系的电荷中和点从pH 4.59偏移至pH 3.76。因此,通过控制蛋白质与多糖静电相互作用的强度可以改变体系的质构,赋予体系新的功能特性,使其满足生产加工的需要。
目前,来源于天然原料的亲水性胶体(魔芋、刺槐豆胶、瓜尔豆胶等)应用在蛋白饮料中,在满足食品清洁标签的同时,也改善产品增稠稳定的特性。银耳中富含的银耳多糖(polysaccharide,TFP)除了以上特点,还具有较好的持水性和乳化稳定性。研究发现TFP还具有抗肿瘤、抗氧化、降血糖、免疫调节等多种生物活性。因此,将TFP应用到富含蛋白的饮料体系中,不仅能达到增稠稳定的目的,还能增加产品的功能活性。然而,目前鲜有关于TFP与蛋白质相互作用的研究。本实验旨在通过对TFP与SPI相互作用的条件和影响因素的研究,探讨两者的相互作用机制,为实现新功能性多糖在植物蛋白饮料中的应用提供一定理论基础。
1 材料与方法
1.1 材料与试剂
TFP 上海辉文生物技术股份有限公司;低温脱脂豆粕 湖北兴恒业科技有限公司。
NaOH、HCl、NaCl 成都市科龙化工试剂厂;罗丹明B 上海麦克林生化科技有限公司;上述试剂均为分析纯。
1.2 仪器与设备
Infinite M200 Pro型光栅型多功能微孔板检测仪奥地利TECAN公司;NANO ZS90型纳米粒度仪 英国马尔文仪器公司;F-7000/4600型荧光分光光度计 天美(中国)科学仪器有限公司;Nicolet iS10型傅里叶变换红外光谱仪、HAAKE-MARS4型流变仪 赛默飞世尔科技(中国)有限公司;LEICA-TCS-SP8MP型激光共聚焦显微镜 德国徕卡公司。
1.3 方法
1.3.1 SPI制备
参照Qi等的碱溶酸沉法并稍作修改。将低温脱脂豆粕与去离子水按1∶10(g/mL)混合,用2 mol/L NaOH溶液调节pH值为8.0,同时匀速搅拌2 h。4 ℃、8 000 r/min离心20 min,取上清液。用2 mol/L HCl溶液将上清液pH值调至4.5,8 000 r/min离心10 min,弃上清液。用去离子水复溶沉淀,用2 mol/L NaOH溶液调pH值至7.0,4 ℃透析48 h。将透析液进行真空冷冻干燥,得到SPI粉末。通过凯氏定氮法对SPI粉末的蛋白质含量进行测定。
1.3.2 TFP成分测定
采用凯氏定氮法测定蛋白质含量,采用苯酚硫酸法测定总糖含量和3-苯基酚显色法测定糖醛酸含量。
1.3.3 SPI和TFP储备液制备
分别称取1 g的SPI和TFP,溶解于100 mL去离子水中,常温下用磁力搅拌器匀速搅拌3 h后,置于4 ℃冰箱中过夜以充分水合,分别得到质量浓度为1 g/mL的SPI和TFP储备液。重复上述步骤,用5、20、50 mmol/L和200 mmol/L NaCl溶液分别溶解SPI和TFP,得到不同盐离子浓度的SPI和TFP离子储备液。
1.3.4 SPI-TFP混合液制备
将SPI和TFP储备液按10∶1、5∶1、4∶1、3∶1、2∶1、1∶1、1∶2和1∶3(/)混合,同时用磁力搅拌器混合均匀,得到不同质量比的SPI-TFP混合液。重复上述步骤,分别将相同盐离子浓度的SPI和TFP离子储备液按1∶1(/)混合,得到不同盐离子浓度的SPI-TFP离子混合液。后续实验用1 mol/L HCl溶液和1 mol/L NaOH溶液调节混合液pH值。
1.3.5 浊度测定
参考Niu Fuge等方法。调节待测样品的pH值至7.0。用0.1 mol/L HCl溶液对SPI储备液、TFP储备液、不同质量比的SPI-TFP混合液(3∶1、2∶1、1∶1、1∶2和1∶3)和不同盐离子浓度的SPI-TFP离子混合液进行酸化(pH 7.0~2.0),同时在磁力搅拌器上用pH计跟踪体系pH值的变化。整个体系的pH值每变化0.1~0.2时取出样品,在多功能微孔板检测仪上测定600 nm波长处的光密度值,同时记录样品对应的pH值。
1.3.6 粒度和Zeta电位测定
参考Souza等方法。调节待测样品的pH值至7.0。用相同的溶剂将SPI储备液、TFP储备液、不同质量比的SPI-TFP混合液(3∶1、2∶1、1∶1、1∶2和1∶3)和不同盐离子浓度下的SPI-TFP离子混合液分别稀释10 倍(质量浓度为0.1 g/mL)后,通过纳米粒度仪测定样品在酸化过程中(pH 7.0~2.0)的粒度分布和Zeta电位。
1.3.7 微观结构观察
参考Xiong Wenfei等方法。调节待测样品至特定pH值。采用激光共聚焦显微镜观测SPI储备液和SPI-TFP混合液(1∶1,/)在不同pH值下(pH 3.0、5.0、6.0和7.0)的微观结构。在1 mL样品溶液中加入20 μL、质量分数0.2%的罗丹明B荧光染料,用于标记蛋白质。取55 μL样品于载玻片上,确保没有气泡后用盖玻片压紧备用。采用20 倍物镜,在552 nm波长处激发罗丹明B,在561~700 nm波长处采集发射信号,用LAS AF Lite软件进行图像分析与数据处理。
1.3.8 荧光光谱测定
参照El Rassi方法。调节待测样品至特定pH值。在室温下使用荧光分光光度计测量不同pH值(2.0~9.0)下SPI储备液和SPI-TFP混合液(1∶1,/)的荧光强度。激发电压为400 V,激发波长为295 nm,狭缝宽度为5 nm,扫描速度为1 200 nm/min。
1.3.9 傅里叶变换红外光谱测定
参照邢永娜等方法。调节待测样品至特定pH值。将不同pH值下(pH 3.0、5.0和6.0)的SPI储备液和SPITFP混合液(1∶1,/)进行真空冷冻干燥,将干燥后的样品与溴化钾按质量比1∶100充分混合后压片。扫描次数为32,分辨率为4 cm,扫描范围4 000~400 cm。
1.3.10 流变特性测定
参考Wang Chenying等方法。调节待测样品至特定pH值。采用流变仪对不同pH值下(pH 2.0~7.0)的SPI储备液和不同质量比的SPI-TFP混合液(1∶1、2∶1、4∶1、5∶1和10∶1)的黏度进行测定,选择直径40 mm的锥板,测量间距为1 mm,测定温度为25 ℃,系统平衡3 min后在0.1~100 s剪切速率范围内对溶液的黏度进行测定。
设置应变为1%,测定pH 3.0的SPI储备液、TFP储备液、不同质量比SPI-TFP混合液(3∶1、2∶1、1∶1、1∶2和1∶3)和不同NaCl浓度SPI-TFP混合液在0.1~10 Hz下的黏弹性,得到弹性模量(’)和黏性模量(”)。
1.4 数据处理与分析
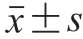
2 结果与分析
2.1 SPI和TFP的组成
实验测得SPI的蛋白质相对含量为93.32%。在TFP中,总糖、糖醛酸和蛋白质的相对含量分别为93.96%、25.53%和0.23%。
2.2 SPI-TFP复合凝聚相行为分析
2.2.1 pH值对SPI-TFP复合凝聚的影响
在蛋白质-阴离子多糖体系中,当多糖和蛋白质带相反电荷时,两者会由于静电引力产生复合凝聚现象。由图1可知,随着pH值降低,TFP储备液的浊度保持不变,原因是强静电斥力抑制TFP阴离子多糖分子产生聚集。SPI储备液的浊度随着pH值降低而变化,这是由SPI的聚集引起的,并在等电点(pH 4.6)左右出现了最大值。由图1可知,与其他蛋白质-多糖体系一样,SPITFP混合液(1∶1,/)在酸化过程中由于浊度的变化产生了4 个离散相。根据浊度滴定曲线,可确定复合体系的可溶性复合点(pH)和不可溶性复合点(pH)。pH为浊度曲线斜率首次出现变化时的pH值,pH为浊度曲线斜率突然增大时对应的pH值,pH为浊度最大时对应的pH值,pH为浊度曲线斜率降到稳定时对应的pH值。利用复合体系的pH、pH及蛋白质等电点可将复合体系分为4 个区域:I)共溶区:当pH值大于pH(6.4)时,SPI和TFP都带负电荷,两者由于静电排斥作用而各自以单分子形态稳定存在于溶液中,从而不能形成复合凝聚体。II)可溶性复合凝聚体区:当pH值降至pH时,复合体系的浊度开始逐渐增大,表明SPI-TFP复合凝聚体开始形成。在pH 5.8~6.4,SPI和TFP均带负电荷,此时复合凝聚体的形成是由于SPI上与TFP电荷相反的局部斑块间的络合。在大麻分离蛋白与阿拉伯胶相互作用的研究中也有类似发现。III)不溶性复合凝聚体区:当pH值降至pH(5.8)时,不可溶性复合凝聚体的出现使体系发生宏观的相分离。随着酸化的进行,SPI和TFP的静电相互作用在pH(4.3)和pH(3.3)处达到最强。SPI主要组成蛋白包括7S球蛋白和11S球蛋白,其等电点分别为4.8和6.4,这与2 次浊度峰值的出现有关。表明在SPI-TFP复合凝聚体中,SPI与TFP质量比为1∶1时,TFP能分别与这2 种球蛋白发生相互作用,使其分别在pH 4.3和pH 3.3处产生最大的聚集。IV)共溶区:随着pH值降低,复合凝聚体逐渐解离。在pH(2.2)时,SPI和TFP相互作用终止,复合凝聚体完全发生解离,体系的浊度降低且保持不变。
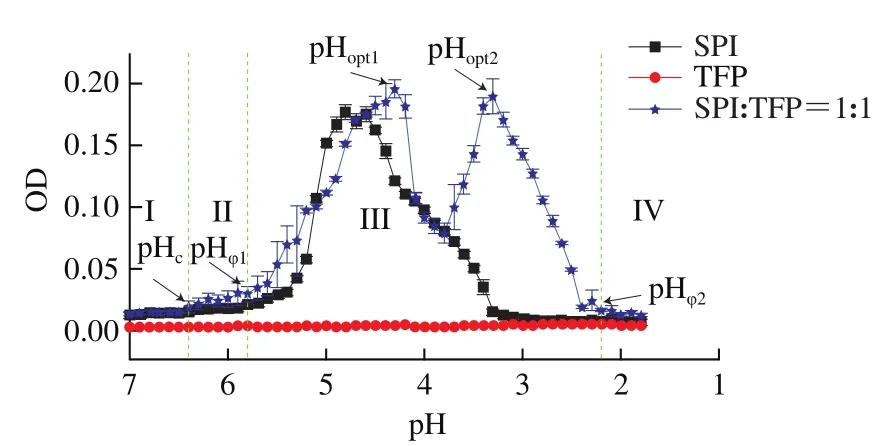
图1 SPI、TFP和SPI-TFP混合液的浊度随pH值的变化Fig. 1 Turbidity of SPI, TFP and SPI-TFP mixture as a change of pH
2.2.2 SPI和TFP质量比对SPI-TFP复合凝聚的影响
复合体系中蛋白质与多糖的比例会影响复合体系电荷的平衡,从而改变相转变的临界pH值。由图2a可知,随着体系中TFP比例的增大,SPI-TFP混合液的吸收峰变宽,最大吸收峰逐渐降低。在豌豆分离蛋白与黄芩胶的复合凝聚研究中也发现了类似现象。在SPI-TFP混合液中,当SPI∶TFP<1时,SPI与TFP之间发生了弱相互作用,体系浊度较低。体系中由于过量阴离子基团的存在,聚合物之间存在强烈的静电斥力,不利于凝聚的发生。当SPI∶TFP>1时,体系中存在较多SPI,可与TFP链结合的SPI增多,体系浊度值较高。由图2b可知,随着体系中TFP比例的增大,形成复合凝聚体的关键pH值发生变化。在SPI-TFP混合液中,当SPI∶TFP>1时,TFP比例的增大使得SPI表面的正电荷能结合的负电荷增加,在一定程度上促进了复合物的形成,所以复合凝聚的pH和pH向高pH值方向移动。当SPI∶TFP<1时,随着体系中TFP比例的增大体系的负电荷增多,需要更多正电荷进行中和,SPI分子在较低pH值下带的电荷较高,因而pH向低pH值方向移动。
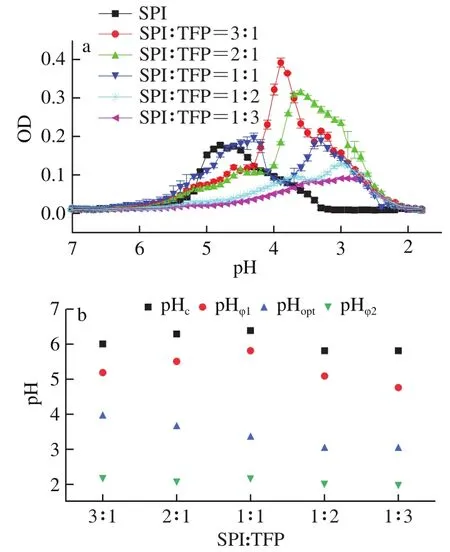
图2 不同质量比SPI-TFP混合液的浊度(a)和关键pH值(b)随pH值的变化Fig. 2 Turbidity (a) and critical pH (b) of SPI-TFP mixtures with different mass ratios as a change of pH
2.2.3 离子浓度对SPI-TFP复合凝聚的影响
盐离子对聚合物表面的电荷具有屏蔽作用,从而影响蛋白质与多糖之间的复合作用。大量研究表明较低浓度的盐离子有利于复合凝聚体的生成,较高浓度的盐离子则会抑制两者的作用。由图3a可知,在SPI-TFP离子混合液(1∶1,/)中,随着NaCl浓度增大,复合体系浊度的最大值呈现先增大后减小的趋势。在低浓度的盐离子下,复合凝聚现象的出现在一定程度上能增强SPI与TFP的溶解,从而促进两者相互作用的发生。NaCl浓度为20 mmol/L时,复合体系浊度的峰值最大,说明此时盐离子对SPI和TFP复合的促进作用最大。当NaCl浓度大于20 mmol/L时,复合体系浊度的峰值开始减小,说明此时盐离子开始抑制SPI与TFP之间的复合作用。由图3b可知,在SPI-TFP离子混合液(1∶1,/)中,随着NaCl浓度增大,复合物形成的关键pH值(pH、pH、pH)总体向更高的pH值移动,表明Na中和了部分TFP羧基基团所带的负电荷。
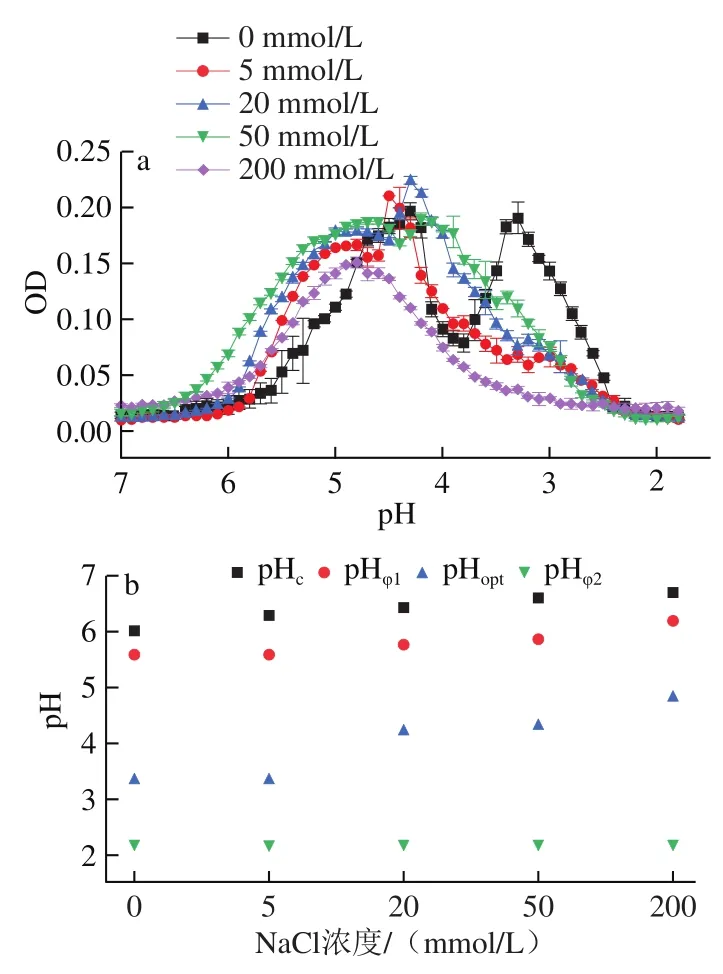
图3 不同NaCl浓度SPI-TFP离子混合液的浊度(a)和关键pH值(b)随pH值的变化Fig. 3 Turbidity (a) and critical pH (b) of SPI-TFP mixtures with different NaCl concentrations as a change of pH
2.3 SPI-TFP复合凝聚的Zeta电位分析
DLVO胶体溶液理论表明,电位值越高,溶液的斥力位能越大,体系的稳定性越好;当Zeta电位的绝对值大于30 mV时,体系基本处于稳定状态。如图4a所示,TFP储备液在pH 2.0~7.0范围内都带负电荷;当pH>3.5时,TFP储备液电位的绝对值均大于30 mV,表明TFP在溶液中充分溶解,溶液处于稳定状态。在SPI储备液中,当pH值为4.7左右时,溶液的Zeta电位为0,这与文献报道的等电点一致。pH值为2.0~7.0时,SPI-TFP混合溶液(1∶1,/)的电位值在SPI与TFP储备液之间;当pH<4.7时,带相反电荷的SPI和TFP之间会形成凝聚体。
由图4b可知,SPI-TFP混合溶液随着TFP比例的增加,SPI与TFP在低pH值(pH 2.0)发生中和,提高TFP的添加比例,会使溶液的负电荷增加。因此,形成凝聚体需要溶液提供更多正电荷,体系的电荷中和点向更低的pH值方向移动。在pH 5.0~7.0,所有混合溶液的Zeta电位值变化相对较小;当pH<5.0时,SPI-TFP混合液的Zeta电位值迅速增加,SPI-TFP混合物的电荷中和点与pH(pH 3.0~4.0)相近。
由图4c可知,复合物形成区域(pH>4.5)SPI-TFP体系的Zeta电位绝对值随NaCl浓度的增加而降低。这与NaCl的静电屏蔽效应有关,在较高的离子强度下,SPI与TFP间的静电相互作用由于屏蔽了两种生物聚合物上的带电活性位点而减弱,从而导致过量的羧基不能与阳离子氨基结合,抑制了SPI与TFP的相互作用,降低了体系的稳定性。Liu Jingbo等发现NaCl浓度大于100 mmol/L会降低卵清蛋白/葡聚糖硫酸盐复合体系的稳定性。
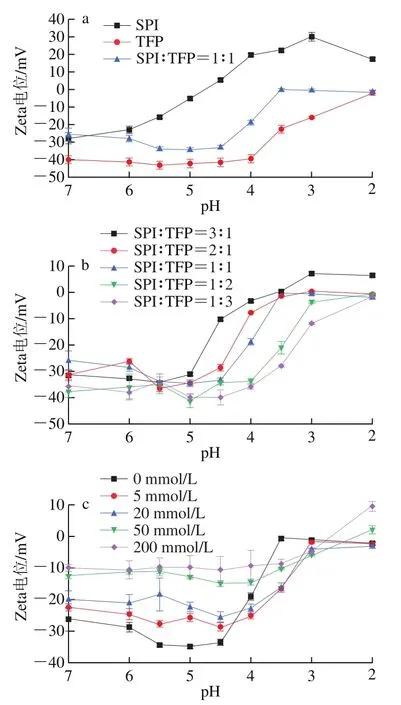
图4 pH值(a)、质量比(b)和离子强度(c)对SPI-TFP混合溶液Zeta电位的影响Fig. 4 Effects of pH (a), mixing ratio (b) and ionic strength (c) on zeta potential of SPI-TFP mixtures
2.4 SPI-TFP复合凝聚的荧光光谱分析
蛋白质的内源荧光光谱可以反映蛋白质的三级结构和极性变化,常用来表征蛋白质与多糖的相互作用。由图5可知,在相同pH值条件下,与SPI溶液相比,SPI-TFP混合液(1∶1,/)的最大荧光强度降低,对应的波长发生红移(由333 nm移动到335 nm)。SPI-TFP复合物的形成可能改变了色氨酸残基的微环境,猝灭SPI固有荧光使荧光强度下降,表明疏水相互作用参与了复合物的形成。
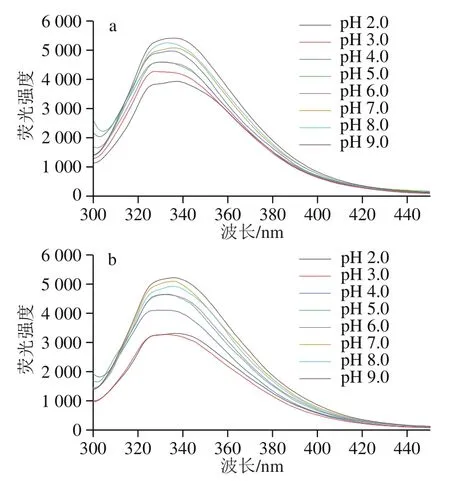
图5 SPI(a)和SPI-TFP混合液(b)在不同pH值下的荧光光谱图Fig. 5 Fluorescence spectra of SPI (a) and SPI-TFP mixture (b) at different pHs
2.5 SPI-TFP复合凝聚的傅里叶变换红外光谱分析
为进一步分析复合凝聚过程中SPI与TFP之间的相互作用,测定了SPI储备液与SPI-TFP混合液(1∶1,/)在不同pH值下的傅里叶变换红外光谱。如图6a所示,加入TFP后,在pH值相同条件下,SPI酰胺I带从1 660 cm红移至1 650 cm、酰胺II带的特征峰从1 530 cm蓝移至1 540 cm,说明TFP与SPI发生了疏水相互作用,引起了SPI二级结构的变化。与SPI储备液相比,SPI-TFP混合液的酰胺A带吸收峰的强度和位置均发生改变,表明SPI与TFP间存在氢键相互作用。由图6b可知,与SPI储备液相比,SPI-TFP混合液的-螺旋和-折叠的总相对含量有所增加,无规卷曲的相对含量降低。-螺旋和-折叠属于相对规则的构象,表明添加TFP后SPI的有序结构增加,刚性增强,也进一步证明了TFP能够抑制SPI的聚集。
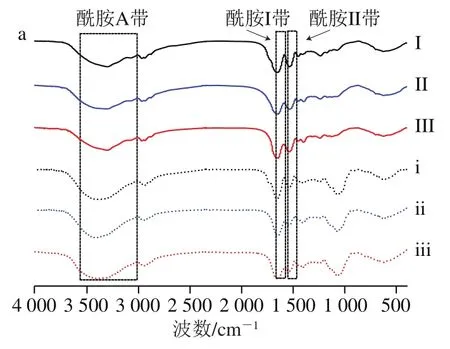

图6 SPI储备液和SPI-TFP混合液在不同pH值下的红外光谱图(a)和二级结构相对含量(b)Fig. 6 FTIR spectra (a) and secondary structure contents (b) of SPI and SPI-TFP mixture under different pH conditions
2.6 pH值对SPI-TFP复合凝聚微观结构的影响
由图7可知,pH 7.0时,SPI储备液和SPI-TFP混合液(1∶1,/)的微观图像上没有观察到凝聚体的出现,表明SPI和TFP处于共溶状态。此时SPI-TFP混合液的粒径分布图可观察到2 个散射强度相对相等的峰,与SPI溶液的峰形相差不大,表明SPI与TFP之间没有形成凝聚体。pH 6.0时,SPI储备液和SPI-TFP混合液均开始出现微小颗粒。SPI颗粒的形成是由于蛋白质的自聚集;SPI和TFP开始形成可溶性复合凝聚体。与SPI储备液相比,此时SPI-TFP混合液中峰的数目减少,且粒径分布更为集中。pH 5.0接近SPI的等电点,此时SPI储备液中观察到致密且团聚的SPI聚集体,粒径分布表现为一个窄而尖的峰。SPI-TFP此时处于不溶性复合凝聚体的形成区,因而能观察到较多微小颗粒。pH值降至3.0时,SPI储备液中能观察到较多蛋白质颗粒,这与此时SPI的溶解度较低有关。此时,SPI-TFP混合液中SPI与TFP的相互作用较强,可观察到较为致密且大的凝聚体。卵清蛋白/羧甲基纤维素复合凝聚体的研究中也观察到类似的微观结构。
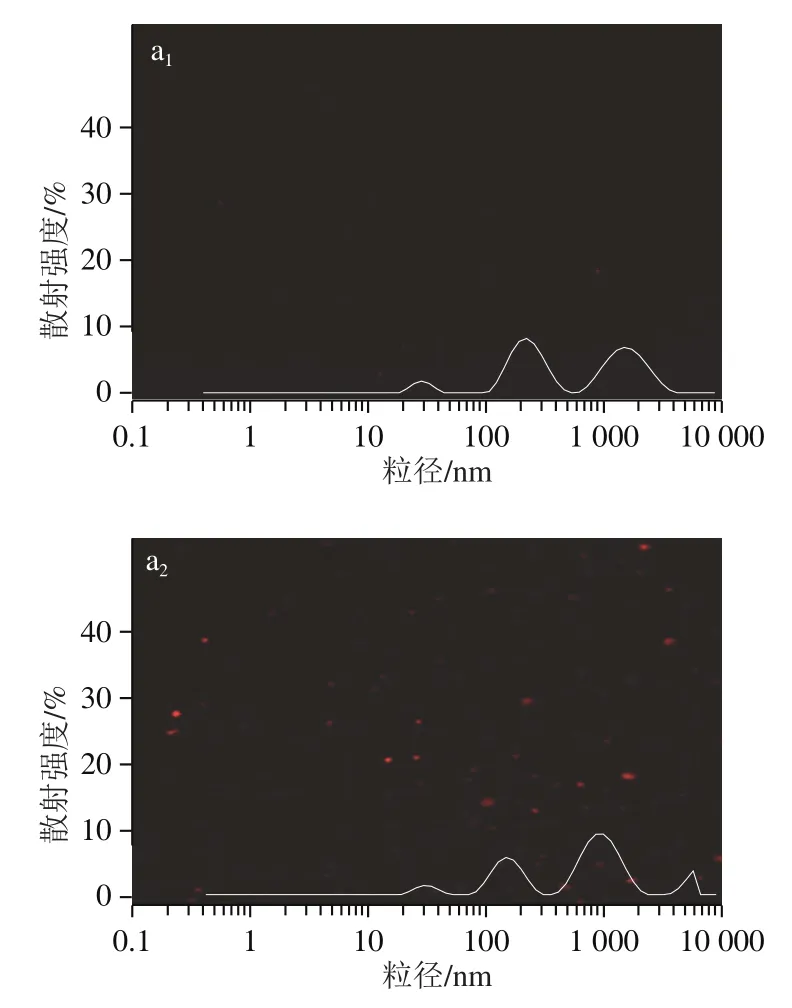
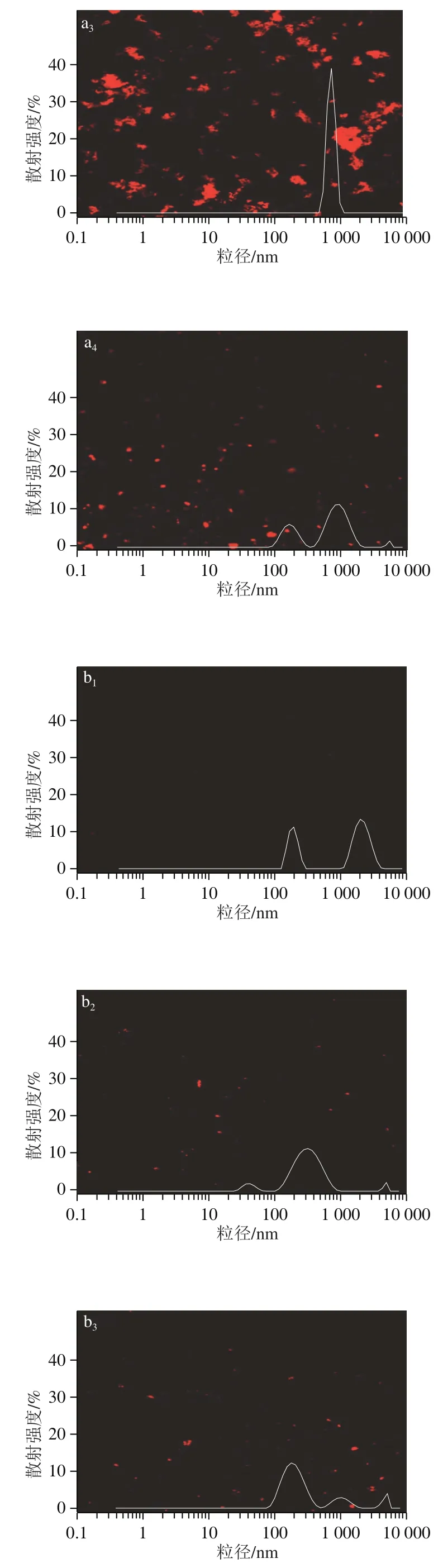
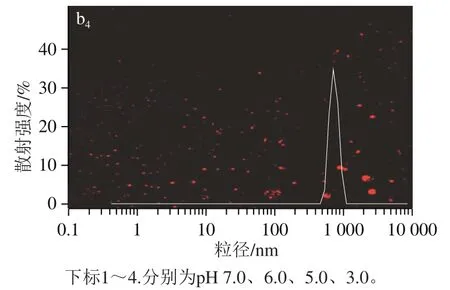
图7 不同pH值下SPI储备液(a)和SPI-TFP混合液(b)的共焦图像及粒度分布Fig. 7 Confocal image and particle size distribution of (a) SPI and SPI-TFP mixture (b) at different pHs
2.7 SPI-TFP凝聚体流变学特性分析
2.7.1 pH值及质量比对SPI-TFP复合体系黏度的影响
由图8a可知,随着剪切速率的增大,不同pH值的SPITFP混合液(1∶1,/)及SPI储备液(pH 6.4)表现出剪切稀化行为,即黏度随着剪切速率的增大而减小,呈典型的非牛顿流体特征。黏度减低的原因是随着剪切速率的增大,复合凝聚体分子间的连接被削弱甚至被破坏导致黏度降低。pH 3.0时,SPI-TFP混合液的总体黏度最高,表明此时两者的相互作用最强,复合凝聚体趋于聚集络合,体系黏度较大。pH 6.0时,由于蛋白与多糖均带负电荷,在体系中存在静电斥力,对流体流动的趋势具有较大的阻碍作用,所以此时SPI-TFP混合液的黏度较高。如图8b所示,随着TFP添加比例的增大,SPI-TFP混合液的总体黏度逐渐增大。这是因为在较高的多糖浓度下,分子链间的相互作用增加,从而使溶液的黏度增加。斯托克斯定律表明,在一定程度上,体系较高的黏度能减少分子间的运动,会延缓两相分离,提高体系的稳定性,这表明添加适量的TFP,能提高复合体系的稳定性。
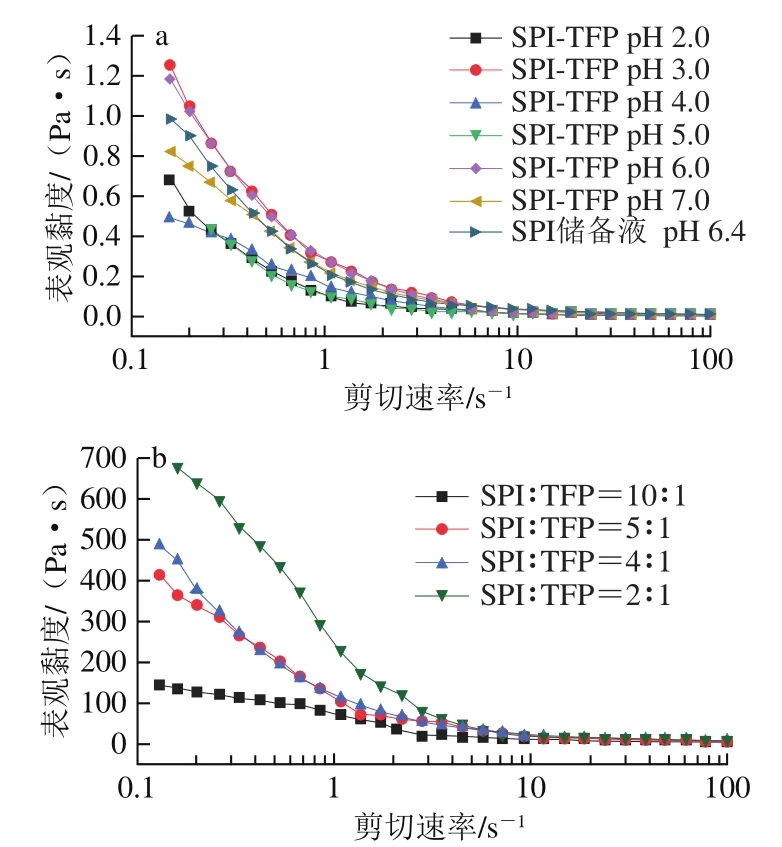
图8 不同pH值(a)和质量比(b)SPI-TFP混合液的黏度Fig. 8 Viscosity of SPI-TFP mixtures at different pHs (a) and mass ratios (b)
2.7.2 质量比和离子浓度对SPI-TFP复合体系黏弹性影响
如图9a所示,整个测定过程中,’始终大于”,表明凝聚体都表现出弹性大于黏性的流变学特性,在SPI/壳聚糖凝聚体、罗勒籽胶/-乳球蛋白中也有类似的发现。2 种聚电解质形成的凝聚体的流变学性质依赖于其分子间相互作用的强度,越强的相互作用会导致越强的黏弹性质。在SPI-TFP混合液中,当SPI∶TFP=2∶1时总体的’最高,表明在pH 3.0、SPI与TFP质量比为2∶1时,两者的相互作用最强。进一步增加或减少TFP的含量,总体上均会引起’的降低。由于空间位阻效应,高支化多糖在混合体系中比线性大分子更难形成缠绕结构,因此,过多的TFP会导致形成较弱的网络结构。
如图9b所示,当剪切频率为10 Hz,NaCl浓度为20 mmol/L时,’和”值达到最大值,当盐浓度大于20 mmol/L时,’和”降低。即盐离子浓度为20 mmol/L时,对SPI和TFP复合的促进作用最大,当盐离子浓度大于20 mmol/L时,盐离子开始抑制SPI与TFP之间的相互作用。这些结果与浊度和Zeta电位随离子强度的变化一致。
图9 pH 3.0下不同质量比(a)和NaCl浓度(b)的SPI-TFP混合液的G’和G”Fig. 9 G’ and G” of SPI-TFP mixtures with different mixing ratios (a) and NaCl concentrations (b) at pH 3.0
3 结 论
研究pH值、离子浓度和蛋白质/多糖质量比对SPI和TFP复凝聚过程的影响。结果表明:SPI-TFP混合物在酸化过程中(pH 7.0~2.0)会出现4 个相区(I)共溶区、II)可溶性复合凝聚体区、III)不溶性复合凝聚体区和IV)共溶区)以及4 个关键pH值(pH、pH、pH和pH)。当SPI∶TFP>1时,与复合物形成相关的关键pH值(pH和pH)向高pH值方向移动。当SPI∶TFP<1时,pH向低pH值方向移动。随着体系中TFP比例的增大,SPI-TFP混合液的最大吸收峰逐渐降低。当NaCl浓度小于20 mmol/L时,盐离子能增强SPI与TFP之间的相互作用;当NaCl浓度大于20 mmol/L时,盐离子开始抑制SPI与TFP之间的相互作用。SPI-TFP混合液(1∶1,/)在pH 3.0处总体黏度最大,此时两者的相互作用最强,形成的凝聚体数量最多且粒径最大;SPI-TFP混合液的总体黏度随体系中TFP添加比例的增加而增大。SPI-TFP混合液均表现出弹性大于黏性的流变学特性,当剪切频率达到10 Hz,NaCl浓度为20 mmol/L时,SPI-TFP混合液(1∶1,/)的’和”值达到最大值。综上所述,通过控制TFP与SPI混合的条件可实现提高体系稳定性的目的,为TFP作为新的功能性多糖在植物蛋白饮料中的应用提供理论基础。未来可从SPI和TFP的分子结构特性进一步解析两者相互作用的机理。
