二氢杨梅素固体自微乳的制备及表征
2022-09-01岳晶晶王立增褚兰玲解文静张佳靓吕奕文
黄 娟,岳晶晶,冯 璇,王立增,褚兰玲,解文静,张佳靓,吕奕文
(1.常熟理工学院生物与食品工程学院,江苏 常熟 215500;2.南京林业大学轻工与食品学院,江苏 南京 210037;3.宏胜饮料集团有限公司,浙江 杭州 311200)
二氢杨梅素广泛存在于葡萄科、杜鹃科、杨梅科、大戟科、藤黄科及柳科等植物中,生理活性广泛且安全性好,具有抗氧化、抗炎、抗肿瘤、解酒保肝、抗病原微生物及调血脂等多方面的药理作用,并在减少动脉粥样硬化病变方面也有显著效果。另外,二氢杨梅素可能具有预防斑块破裂和随后的血栓性闭塞的潜在作用。
然而,由于二氢杨梅素含有邻三酚羟基结构,分子稳定性不高,在加工、运输及储存过程中,易被氧化,稳定性较差。pH值、温度和金属离子等变化均对其稳定性有一定的负面影响。此外,二氢杨梅素在常温和冷水中溶解度较低,导致其在消化过程中难以被人体吸收。由于其溶解性低、稳定性差,二氢杨梅素通常在体内的半衰期较短,代谢过快,导致其生物利用度低,难以在食品中得到有效利用。
自微乳是由药物、助乳化剂、亲水性乳化剂和油相组成的各向同性混合物,具有热力学稳定性,在胃肠蠕动或环境温度适宜的温和搅拌下能自发形成透明或半透明水包油型分散体系。自微乳可以增加药物的溶解度和溶出速率,避免受到酶的降解,增加在胃肠道的吸收,最终提高生物利用度。然而,自微乳虽有制备工艺简单、适合规模化生产的优点,但由于液体制剂存在剂型较为单一、制剂难以随身携带、活性成分与胶囊材料间易发生相互作用、成本相对较高、贮存过程中易出现结晶析出或分层现象等问题,使其仍难以在实际生产中大量应用。自微乳目前仅在药物方面有相关报道,而在功能食品领域基本处于空白。因此,将液体自微乳固体化并应用于功能食品中具有重大意义。
二氧化硅性质稳定,不与一般酸反应,可用于食品领域,是较为理想的吸附材料。本实验创新地采用食品级原料制备二氢杨梅素自微乳,使用二氧化硅吸附,得到固体化的二氢杨梅素自微乳。同时对该固体自微乳进行理化性质、红外光谱、X射线衍射、体外释放和体外模拟消化的分析,以期改善二氢杨梅素稳定性差、溶解度差的问题,提高生物利用度,使其能够广泛应用于食品工业中。
1 材料与方法
1.1 材料与试剂
二氢杨梅素(纯度≥99%) 西安绿如泉生物科技有限公司;辛酸癸酸甘油三酯(octyl and decyl glycerate,ODO) 上海上德化工有限公司;吐温60广东润华化工有限公司;十聚甘油单油酸酯 济南东润精化科技有限公司;聚甘油蓖麻醇酯 上海佑创实业有限公司;二氧化硅 郑州佳味源实业有限公司;胃蛋白酶、胰酶、胆酸盐 上海阿达玛斯试剂有限公司;固体自微乳配方中的原料均为食品级,其他试剂均为分析纯。
1.2 仪器与设备
ME503T电子天平 梅特勒-托利多仪器(上海)有限公司;HCJ-8D磁力搅拌水浴锅 常州朗越仪器制造有限公司;HJ-6磁力搅拌器 常州市亿能实验仪器厂;Centrifuge 5424高速离心机 德国Eppendorf公司;ZS90粒度仪 英国马尔文仪器有限公司;a-1900PC紫外-可见分光光度计 上海浦元仪器有限公司;Ultra Plus扫描电子显微镜(scanning electron microscope,SEM)德国Zeiss公司;Nicolet IS5傅里叶变换红外光谱仪美国Thermo Scientific公司;D8-Discover X射线衍射仪德国Bruker公司。
1.3 方法
1.3.1 样品的制备
1.3.1.1 液体自微乳的制备
称取0.6 g二氢杨梅素,加入到39.4 g ODO中,置于磁力搅拌器上,200 r/min搅拌至二氢杨梅素完全溶解。向混合物中加入24 g吐温60、24 g十聚甘油单油酸酯和12 g聚甘油蓖麻醇酯,置于磁力搅拌器上,200 r/min搅拌10 min,得到二氢杨梅素液体自微乳。
1.3.1.2 固体自微乳的制备
称取适量二氢杨梅素液体自微乳,并加入一定量的二氧化硅粉末,搅拌混合均匀,得到二氢杨梅素固体自微乳。
1.3.1.3 待测样品的制备
简单混合物:按1.3.1.1节和1.3.1.2节的配方量,分别按顺序称取二氢杨梅素、二氧化硅、ODO、吐温60、十聚甘油单油酸酯和聚甘油蓖麻醇酯,搅拌混合均匀。
液体自微乳水分散液:称取0.5 g液体自微乳加入到10 mL去离子水中,200 r/min下搅拌30 min即得。
固体自微乳水分散液:称取0.5 g固体自微乳加入到10 mL去离子水中,200 r/min下搅拌30 min即得。
混悬液:称取0.001 5 g二氢杨梅素和0.5 g羧甲基纤维素钠,加入去离子水10 mL,3 000 r/min下搅拌2 h即得。
1.3.2 二氧化硅添加比例筛选
通过测定休止角、豪斯纳比(Hausner ratio,HR)以及卡尔指数(Carr’s index,CI)评价不同质量比的二氧化硅与二氢杨梅素液体自微乳(0.2、0.4、0.6和0.8)对固体自微乳粉末的流动性及压缩度的影响。
1.3.2.1 休止角测定
将漏斗固定在铁架台上,使其尖端在特定高度()。将混匀的固体自微乳粉末倒入漏斗,待其形成的椎体粉末尖端与漏斗尖端刚好触碰,记录此时粉堆的半径(),计算休止角:

1.3.2.2 豪斯纳比和卡尔指数测定
取2 g的固体自微乳粉末(),置于20 mL量筒中,将粉末轻轻按压至体积不再变化。记录按压前后的体积,分别记为和,计算HR:

固体自微乳粉末的堆密度()计算如下:

固体自微乳粉末的振实密度()的计算如下:

根据式(3)~(4),计算CI:

1.3.3 微观结构测定
将样品置于双面碳导电胶布上,并固定于干净的载玻片上,加速电压为20 kV,采用SEM,分别放大20 000 倍和50 000 倍后,观察二氧化硅和固体自微乳整体及表面的微观结构。
1.3.4 X射线衍射测定
将二氢杨梅素、二氧化硅、简单混合物和固体自微乳样品分别于X射线衍射仪进行测试。测试条件:铜靶Kα射线源,电流40 mA,电压40 kV,扫描范围5°~60°,步长0.02°,扫描速率10°/min。
1.3.5 傅里叶变换红外光谱测定
分别对二氢杨梅素、二氧化硅、固体自微乳和简单混合物进行红外光谱分析。取少量样品,与溴化钾按照质量比1∶100均匀混合,15 MPa条件下使用电动压片机压片30 s。对压片后得到的透明薄层样品在4 000~400 cm范围内进行红外光谱扫描,分辨率为4 cm,测试过程中累计16 次扫描信号得到样品红外光谱图。
1.3.6 二氢杨梅素含量测定
使用电子天平准确称取8 mg二氢杨梅素标准品,置于100 mL容量瓶中,用无水乙醇稀释定容,得二氢杨梅素的母液。分别取0.25、0.5、0.75、1.0、1.25、1.5 mL母液,置于10 mL容量瓶中,用无水乙醇稀释定容,得二氢杨梅素标准液。将不同质量浓度的二氢杨梅素标准液于290 nm波长处测定吸光度,记录数据,绘制标准曲线。
取0.5 g液体自微乳样品,置于50 mL容量瓶中,用无水乙醇稀释定容。于290 nm波长处测定吸光度,对照标准曲线,计算样品中二氢杨梅素含量。
取0.075 g固体自微乳样品,置于25 mL容量瓶中,用无水乙醇稀释定容。3 000 r/min离心10 min,取上清液于290 nm波长处测定吸光度,对照标准曲线,计算样品中二氢杨梅素含量。
1.3.7 体外释放
采用透析袋法(截留分子质量为14 kDa)进行体外释放研究。为保证漏槽条件,释放介质为无水乙醇和pH 6.8的磷酸盐缓冲液(30∶70,/)。将2 mg二氢杨梅素()溶于5 mL无水乙醇中,得到二氢杨梅素乙醇溶液。将二氢杨梅素乙醇溶液、液体自微乳和固体自微乳装入透析袋中,置于200 mL的释放介质中,100 r/min下搅拌,温度37 ℃。释放过程中分别于15、30、60、120、180、240、360、480、600 min取3 mL样品用于分析检测,同时补充等体积新鲜的释放介质。用紫外分光光度计于290 nm波长处测定样品的吸光度,对照标准曲线,计算二氢杨梅素的质量浓度()。根据下式计算二氢杨梅素的累积释放率,绘制二氢杨梅素的体外释放曲线。
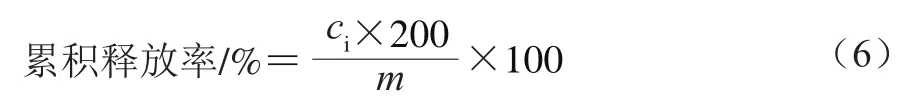
1.3.8 体外模拟胃消化
取8.33 mL 11.8 mol/L浓盐酸加入去离子水中,得到1 L pH 1.2盐酸溶液。分别准确称取2 mg的二氢杨梅素、液体自微乳和固体自微乳,加入12.5 mL pH 1.2盐酸溶液中。随后加入1.6 mL胃蛋白酶溶液(25 000 U/mL)和5 μL 0.3 mol/L氯化钙溶液。最后使用1 mol/L盐酸溶液将溶液的pH值调整为1.2,并加入pH 1.2盐酸溶液,使胃消化液总体积为20 mL。置于37 ℃恒温水浴锅中,100 r/min孵育2 h后,得到胃消化阶段待测样品。
1.3.9 体外模拟小肠消化
向模拟胃消化后的溶液中加入依据药典配制好的11 mL pH 6.8的磷酸盐缓冲溶液中,再加入2.5 mL配制好的69 mg/mL胆酸盐溶液和40 μL 0.3 mol/L氯化钙溶液。使用1 mol/L氢氧化钠溶液将样品pH值调整为6.8,加入5 mL胰酶溶液(800 U/mL),置于37 ℃恒温水浴锅中,100 r/min孵育2 h。在孵育过程中不断加入0.5 mol/L氢氧化钠溶液,使样品pH值保持在6.8。孵育结束后,用量筒测量肠消化液总体积。取少量肠消化液,3 000 r/min离心10 min,取上层液体作为肠消化阶段待测样品。
1.3.10 平均粒径测定
分别取少量未经消化的液体自微乳水分散液和固体自微乳水分散液、含液体自微乳和固体自微乳的胃消化液和肠消化液,采用动态光散射技术分别测定其平均粒径。为防止多重散射现象,测定前样品需用去离子水稀释100 倍。检测波长633 nm,温度25 ℃,角度90。
1.3.11 生物可给率测定
分别取1 mL含二氢杨梅素、液体自微乳和固体自微乳的肠消化液,用无水乙醇稀释后于紫外分光光度计290 nm波长处测定吸光度,对照标准曲线,计算二氢杨梅素的质量浓度,按下式计算二氢杨梅素的生物可给率。

1.3.12 加速稳定性考察
为了评估二氢杨梅素的化学稳定性,将混悬液、液体自微乳水分散液、液体自微乳和固体自微乳置于带盖的样品瓶中,于50 ℃恒温箱中贮存12 d,在不同的时间间隔测定二氢杨梅素的保留率。
1.4 数据处理
2 结果与分析
2.1 不同二氧化硅添加比例的固体自微乳粉末流动性及压缩度分析
固体自微乳粉末的流动性和压缩度是决定生产过程能否顺利进行的关键因素。普遍认为,粉末的休止角不超过30°,流动性较好;CI<21、HR<1.25时,粉末的可压缩性较小,可用于工业生产。如表1所示,二氧化硅与液体自微乳的质量比≥0.6时,固体自微乳粉末的休止角<30°,CI<21,HR<1.25,表明此比例的固体自微乳粉末具有较好的流动性,较小的压缩性,可用于工业化生产;随着二氧化硅的添加量越多,固体自微乳的休止角、CI和HR越小,表明粉末的流动性越好,可压缩性越小。综合经济成本,认为二氧化硅和液体自微乳的质量比为0.6时,不仅拥有较好的流动相和可压缩性,且较为经济、合理。

表1 不同比例二氧化硅制备的固体自微乳粉末的外观、流动性和压缩度Table 1 Appearance, flowability and compressibility of solid selfemulsifying delivery system prepared with different silica contents
2.2 固体自微乳外观及微观结构分析
如图1所示,液体自微乳呈琥珀色,为油性液体,澄清无沉淀,具有较好的均一性;固体自微乳为白色酥松粉末;固体自微乳水分散液放置2 h后,外观基本不变,稳定性良好。
固体吸附材料的吸附能力通常与其微观下的形貌特征有着密切的关系。如图2所示,未吸附的二氧化硅的微观形态类似球形颗粒,表面有类似绒毛的结构与孔道结构,为二氧化硅增加了比表面积,使其对材料(尤其是液体材料)的吸附能力更强,适合作为液体自微乳的吸附材料。在吸附液体自微乳后(图3),二氧化硅颗粒表面的类绒毛结构与孔道结构消失,颗粒整体略微膨大,表面粗糙且不平整,这表明液体自微乳已被吸附在二氧化硅颗粒内部的孔道之中,展现了其优秀的吸附能力。

图1 液体自微乳(A)、固体自微乳(B)、固体自微乳水分散液(C)的外观Fig. 1 Appearance of liquid self-emulsifying delivery system (A) , solid self-emulsifying delivery system (B) , and aqueous dispersion formed by solid self-emulsifying delivery system (C)
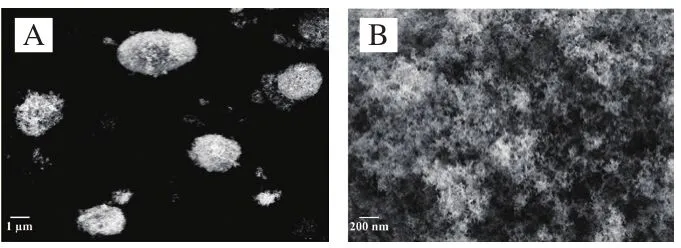
图2 20 000 倍(A)和50 000 倍(B)下二氧化硅的SEM图Fig. 2 SEM images of silica particles at × 20 000 (A) and× 50 000 (B) magnification

图3 20 000 倍(A)和50 000 倍(B)下固体自微乳的SEM图Fig. 3 SEM images of solid self-emulsifying delivery system at× 20 000 (A) and × 50 000 (B) magnification
2.3 二氧化硅与不同二氢杨梅素样品的X射线衍射分析
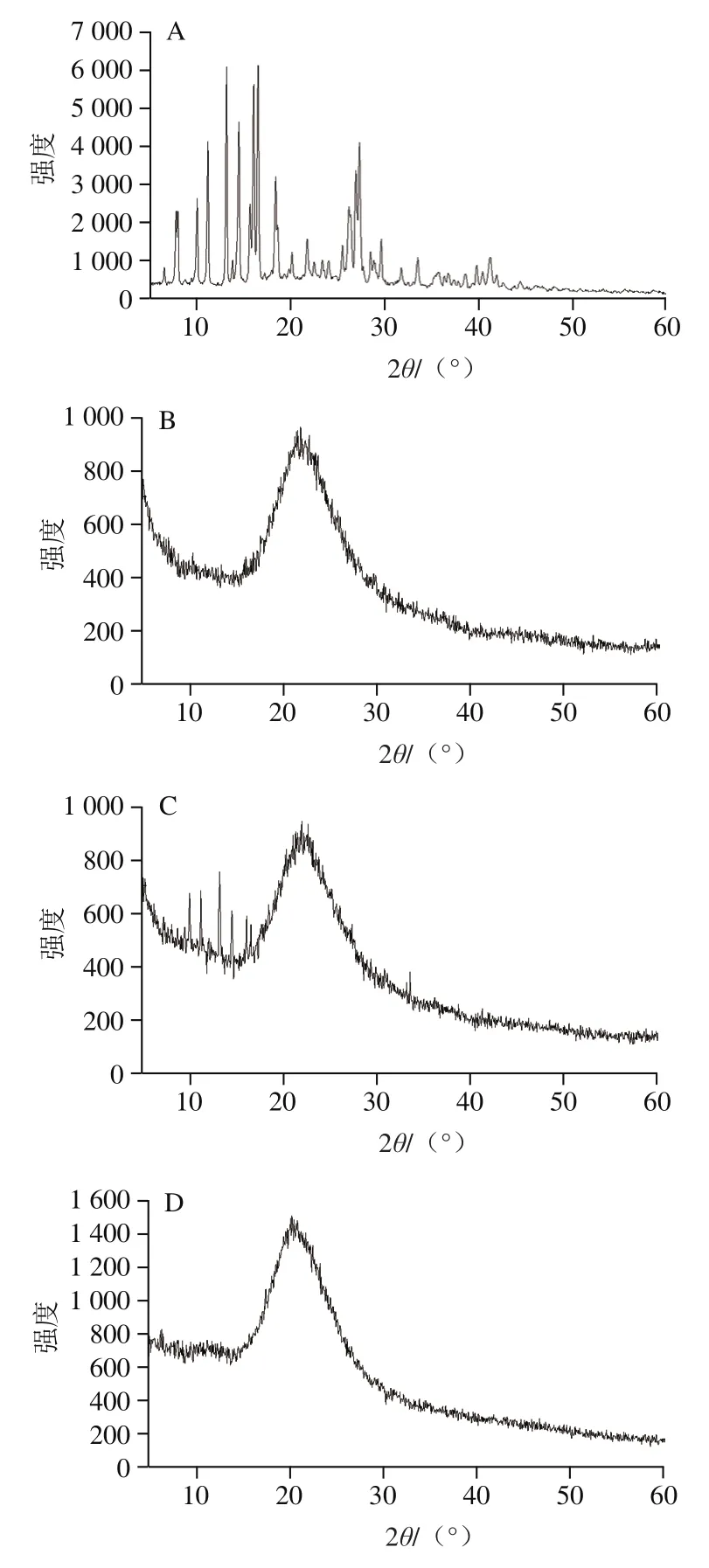
图4 二氢杨梅素(A)、二氧化硅(B)、简单混合物(C)和固体自微乳(D)的X射线衍射图谱Fig. 4 X-ray diffraction patterns of dihydromyricetin (A), silicon dioxide (B),simple mixture (C) and solid self-emulsifying delivery system (D)
如图4A所示,二氢杨梅素的X射线衍射分析图中有较多尖锐的特征峰,且多数尖锐峰集中在210°~30°间。与文献对比发现,213.20°、16.56°、27.34°等处的特征峰为结晶态的二氢杨梅素,表明二氢杨梅素原料具有特定的晶型。由图4C可知,二氢杨梅素与二氧化硅简单混合物的特征峰并不明显但仍然存在,表明在简单混合物中同样存在结晶态的二氢杨梅素,简单的物理混合并不会改变二氢杨梅素的晶型。而固体自微乳与二氧化硅的X射线衍射曲线相似(图4D与4B),无法观察到二氢杨梅素的尖锐特征峰,仅观察到二氧化硅的吸收峰(221.8°),表明在固体自微乳中二氢杨梅素的晶型发生变化。二氢杨梅素溶解于液体自微乳的油脂中,主要以无定形或者溶解态存在。结晶态的物质较难溶于水,同时难以被人体吸收,这也是二氢杨梅素难以应用的原因之一。因此,将二氢杨梅素制成固体自微乳,使结晶态的二氢杨梅素以无定形或溶解态存在,便于人体吸收,得以在食品中应用。
2.4 二氧化硅和不同二氢杨梅素样品的红外光谱分析

图5 二氢杨梅素(A)、二氧化硅(B)、简单混合物(C)和固体自微乳(D)的红外光谱Fig. 5 Fourier transform infrared spectra of dihydromyricetin (A) ,silicon dioxide (B) , simple mixture (C) and solid self-emulsifying delivery system (D)
通过红外光谱分析考察固体自微乳的制备过程及辅料对二氢杨梅素化学性质的影响。二氢杨梅素的红外光谱中(图5A),在1 638.02、3 345.14、3 504.12 cm处有特征吸收峰。根据文献[24],这3 个特征吸收峰对应酚羟基、羰基的伸缩振动,为二氢杨梅素保持活性的功能基团。与图5A相比,简单混合物与固体自微乳的红外光谱中(图5C、D)这3 个特征峰相对不明显,但仍然存在,这与二氢杨梅素在固体自微乳中含量较少有关。对比固体自微乳与简单混合物的红外光谱,发现二者的吸收峰几乎一致,固体自微乳没有新的吸收峰。可以得出,在固体自微乳的制备过程中,二氧化硅及其他成分未与二氢杨梅素发生额外反应,没有新的化学键生成,制备过程也未对二氢杨梅素的化学性质产生影响,保持二氢杨梅素活性的功能基团仍然存在。此外,二氧化硅的红外光谱中(图5B),在1 098.88、470.72 cm处有特征吸收峰,而简单混合物和固体自微乳的分析图谱中都存在二氧化硅的特征吸收峰,证明二氧化硅也并未发生反应,而是将其他成分物理吸附在自身的孔径内。
2.5 自微乳中二氢杨梅素的含量分析
二氢杨梅素的标准曲线为=0.078 9-0.003 9,线性相关系数为0.999 1,二氢杨梅素在2~12 μg/mL质量浓度范围内呈线性相关。
液体自微乳和固体自微乳中二氢杨梅素质量分数分别(0.64±0.05)%和(0.30±0.03)%,测得的二氢杨梅素的含量皆趋近于理论值(液体自微乳和固体自微乳中二氢杨梅素理论值分别为0.6%和0.375%),表明二氢杨梅素未与其他成分进行任何化学反应,仍然保持其活性。
2.6 不同二氢杨梅素样品的体外释放分析
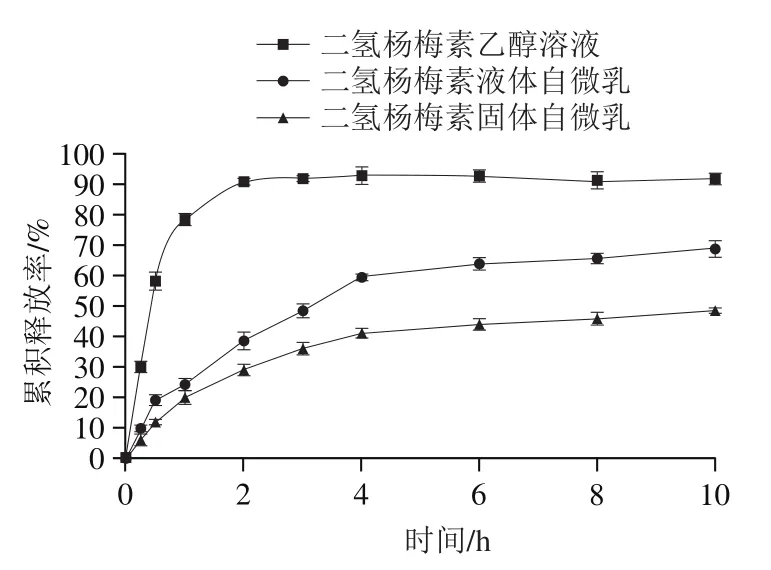
图6 二氢杨梅素乙醇溶液、液体自微乳和固体自微乳的体外释放曲线Fig. 6 In vitro release curves of dihydromyricetin in ethanol solution,liquid and solid self-emulsifying delivery system
如图6所示,二氢杨梅素乙醇溶液在释放介质中释放速率较快,在2 h内基本释放,累积释放率约为90%。液体自微乳与固体自微乳在释放介质中有明显的缓释作用,二者皆能够持续释放8 h以上。其中,液体自微乳的释放速率和累积释放率都高于固体自微乳,推测是由于固体自微乳中液体自微乳被吸附在二氧化硅的孔径内,溶出时需从二氧化硅孔洞中释放,毛细力和虹吸特征延长释放时间,减缓溶出速率。
2.7 不同二氢杨梅素样品的体外模拟胃肠消化分析
如图7所示,未经消化的液体和固体自微乳水分散液的平均粒径分别为(30.2±1)nm和(30.5±0.8)nm;模拟胃部消化后,液体和固体自微乳的平均粒径仅有小幅度的增加,分别为(35.6±1.5)nm和(36.0±1.2)nm,表明这两种自微乳都可以自发形成乳液,且该乳液能在模拟胃消化环境中保持一定的稳定性,使其形态和结构都相对完整,避免被胃部的酶类提前降解,从而降低吸收效果。模拟肠消化后,液体和固体自微乳的粒径都明显增大,增大至(282.3±2)nm和(284.1±1.9)nm,能够推断出两种自微乳都在模拟肠道消化时开始进入消化过程,被肠道吸收。自微乳成分中的吐温60、ODO和聚甘油蓖麻醇酯等脂质类物质能够增加二氢杨梅素的溶解度和溶出速率,促进自微乳在胆酸盐和胰脂肪酶的作用下加速水解。根据文献报道,脂解产物(游离脂肪酸、表面活性剂和溶解的生物活性物质)、胆盐和磷脂被组装成混合胶束和囊泡,运输到肠道并被肠道细胞吸收。
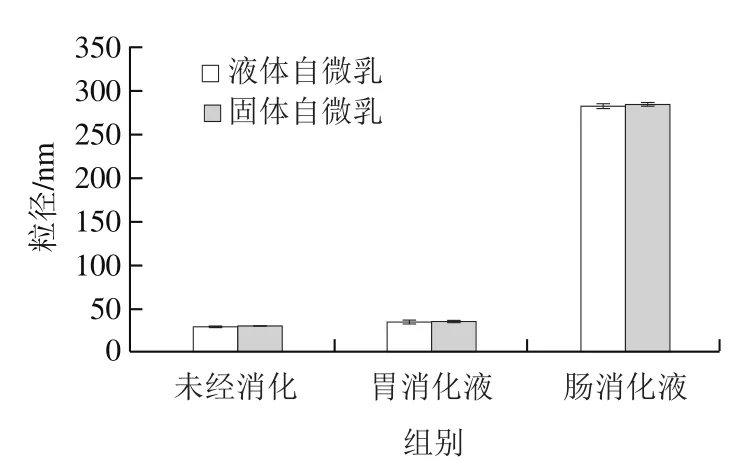
图7 体外模拟胃肠消化前后液体和固体自微乳的平均粒径Fig. 7 Average particle sizes of dihydromyricetin-loaded liquid and solid self-emulsifying delivery systems before and after in vitro simulated gastrointestinal digestion
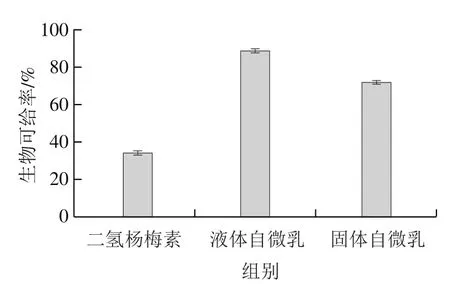
图8 经模拟胃肠消化后二氢杨梅素、液体自微乳和固体自微乳的生物可给率Fig. 8 Bioaccessibility of dihydromyricetin-loaded liquid and solid selfemulsifying delivery systems
经模拟胃肠消化后,溶解在消化介质中的二氢杨梅素为被肠道吸收的活性物,与生物可给率有关。如图8所示,经模拟胃肠消化后,二氢杨梅素的生物可给率为(34.01±1.1)%,液体与固体自微乳的生物可给率高于二氢杨梅素,分别为(88.31±1.1)%和(71.58±0.9)%。其中,液体自微乳的生物可给率较固体自微乳更高,其原因可能与体外释放相同,是由于固体自微乳中液体自微乳被二氧化硅吸附,释放时不能及时溶出导致的。因此,在实际应用中,与二氢杨梅素和其液体自微乳相比,其固体自微乳制剂可以长时间进行释放,延长二氢杨梅素胃肠道消化吸收时间,有效提高生物利用度。
2.8 不同二氢杨梅素样品的加速稳定性分析
如图9所示,二氢杨梅素在混悬液中的保留率急剧下降,这与水中存在大量活性氧有关。与混悬液相比,液体自微乳水分散液中二氢杨梅素的保留率有一定提高,这是因为液体自微乳水分散液形成的乳液中乳化剂和助乳化剂界面膜的保护和隔离作用。但由于乳液中油滴和水接触的比表面积很大,加之乳液中复杂的液体环境,加速12 d后液体自微乳水分散液中二氢杨梅素的保留率仅在32%左右,表明乳化剂和助乳化剂界面膜对二氢杨梅素的保护能力不足。由图9可知,与液体自微乳水分散液相比,液体自微乳中二氢杨梅素的保留率明显增大。这是由于非水的环境,液体自微乳内部没有大量的活性氧,氧化仅发生在液体自微乳和空气接触的表面,有限的表面使液体自微乳中二氢杨梅素的稳定性较好。将液体自微乳固体化后,液体自微乳封装于二氧化硅的孔穴中。相较于液体状态,虽然增大了活性氧和二氢杨梅素接触的比表面积,但由于二氧化硅的封装作用,在加速氧化过程中,固体自微乳中二氢杨梅素的保留率与液体自微乳相比仅出现了轻微下降,且下降趋势不明显。这些结果表明,固体自微乳可以改善二氢杨梅素的贮存稳定性。
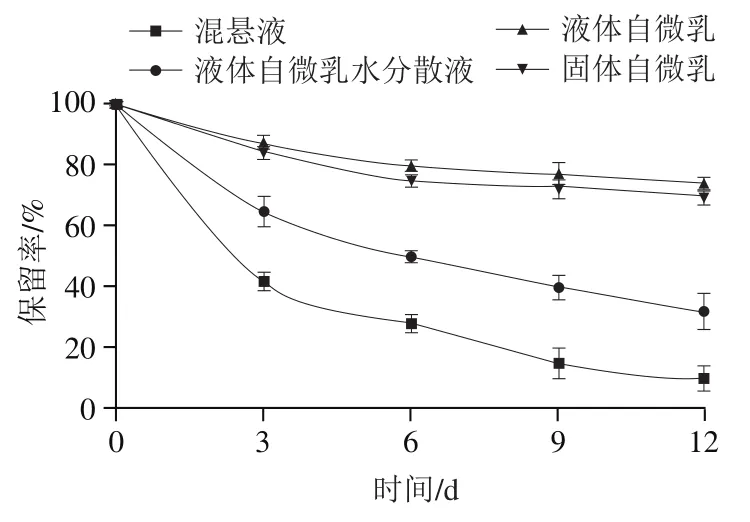
图9 混悬液、液体自微乳水分散液、液体和固体自微乳的二氢杨梅素保留率Fig. 9 Retention rates of dihydromyricetin in suspension, aqueous dispersion formed by liquid self-emulsifying delivery system, and liquid and solid self-emulsifying delivery systems
3 结 论
本实验旨在构建负载二氢杨梅素的固体自微乳,提高二氢杨梅素的水溶解性和生物利用度。采用二氢杨梅素液体自微乳和二氧化硅介孔材料物理混合的方式制备二氢杨梅素固体自微乳。二氧化硅和液体自微乳质量比不小于0.6时,可制备出外观疏松且流动性好的固体粉末。制备得到的二氢杨梅素液体自微乳和固体自微乳分别为琥珀色透明液体和白色粉末。X射线衍射分析结果表明固体自微乳中二氢杨梅素以无定型或者溶解态形式存在。制备固体自微乳的过程中,二氢杨梅素并未与其他成分产生不需要的化学反应,没有新的化学键生成,仍保持活性。体外释放时,液体和固体自微乳释放时间较长,表明将二氢杨梅素自微乳化对其释放起到了控制和减缓释放的作用,使其在制成口服用的制剂时能够进一步提高生物利用度。相比于液体自微乳,由于二氧化硅的阻碍作用,固体自微乳中的二氢杨梅素释放更为缓慢,更能适应口服制剂的要求。体外模拟消化结果表明二氢杨梅素液体和固体自微乳在模拟肠消化液中粒径变化较大,表明主要在模拟肠消化液中消化降解。自微乳可以提高二氢杨梅素的生物可给率,二氧化硅在一定程度上可延长二氢杨梅素的胃肠消化吸收时间。固体自微乳可改善二氢杨梅素的化学稳定性。本研究为二氢杨梅素的载体化提供了一种新颖而有效的策略,为今后在功能性食品开发中的应用奠定了基础。但固体自微乳体系仍然存在固体吸附剂选择的局限性,开发新型、安全且高效的固体吸附剂将是该领域未来的研究方向。
