伯氏肩孔南极鱼dusp1基因在冷应激中的功能研究
2022-08-30胡玲红王化敏陈良标
王 映 胡玲红 王化敏 陈良标 ,
(1. 上海海洋大学国家海洋生物科学国际联合研究中心, 上海 201306; 2. 上海海洋大学水产种质资源发掘与利用教育部重点实验室, 上海 201306; 3. 上海海洋大学水产科学国家级实验教学示范中心, 上海 201306)
对于水生生物而言, 水温是物种生存范围限制的主要决定因素之一[1]。对于鱼类而言, 鱼的体温取决于外部水环境的变化。温度是其行为, 生理和分子过程的关键调节因素[2]。当温度下降到生存范围的极限时, 会影响其呼吸系统和生理行为[3,4]。极低的温度会直接导致鱼类死亡, 这给水产养殖业造成了巨大的经济损失。因此, 探究鱼类低温耐受性的分子机制对于渔业发展和科学研究都具有重要的意义。
尽管许多研究表明, 鱼类可以通过广泛的生化、代谢和生理调节逐步建立寒冷的适应性表型[5,6]。例如产生特定温度的同工酶[6], 改变膜脂质的含量和不饱和脂肪酸的水平[7], 合成分子伴侣[8], 改变线粒体的密度及其特性等[9]。 然而, 这需要经过漫长的适应演变过程。随着转录组和基因组学在鱼类物种中的应用, 一些南极鱼类的抗寒基因被相继报道, 如Yang等[10]发现将南极鱼(Lycodichthys dearborni)的Ⅲ型抗冻蛋白(AFP Ⅲ)四聚体导入烟草中能提高烟草的抗寒性能。将鳞头犬牙南极鱼(Dissostichus mawsoni)的CaM基因在斑马鱼(Danio rerio)胚胎成纤维ZF4细胞中过表达后能够显著提高细胞的抗寒能力[11], 将D. mawsoni的ZPC5基因在斑马鱼胚胎中过表达后能提高胚胎的低温耐受性[12], 这表明南极鱼在适应低温环境的过程中进化出了一些新基因用于抵抗极限低温的侵袭。
Dusp1是一种双特异性蛋白磷酸酶, 可对3个主要MAPK亚家族成员(MAPK/JNK, MAPK/p38和MAPK/ERK)中的苏氨酸和酪氨酸残基进行去磷酸化[13]。Hu等[14]研究发现, 低温胁迫诱导了罗非鱼(Oreochromis niloticus)和斑马鱼(D. rerio)鳃中dusp1的大量表达, 这提示我们dusp1可能参与了鱼类的低温抵抗性能。将斑马鱼细胞中的dusp1基因进行敲降后, 发现低温胁迫下dusp1敲降的细胞凋亡比对照组显著增多[15], 这表明dusp1参与了鱼类冷应激过程, 并在低温情况下对细胞有保护功能,但其具体的分子机制并不清楚。
伯氏肩孔南极鱼(Trematomus bernacchii)是南极鱼亚目南极鱼科的一种鱼类, 长期生活在温度极低的南极地区, 是进行低温适应性进化研究的良好样本。此外, 鉴于先前研究报道dusp1对低温下斑马鱼细胞和胚胎具有应激保护作用, 并且通过比对斑马鱼和南极鱼dusp1基因序列发现其高度相似,因此我们推测生活在南极的伯氏肩孔南极鱼dusp1基因在寒冷应激方面可能会发挥一定作用。因此,在本研究中, 通过对伯氏肩孔南极鱼dusp1编码区的克隆, 并将其构建到真核表达载体中, 在293T细胞中过表达后, 通过低温胁迫实验检测了dusp1基因过表达的细胞与对照组细胞的ROS含量变化和细胞凋亡情况, 同时探究了其相关的分子机制, 揭示了伯氏肩孔南极鱼dusp1基因在抗寒中的功能,为进一步探究冷胁迫下硬骨鱼类dusp1的功能奠定了基础。
1 材料与方法
1.1 实验材料
本研究所采用的伯氏肩孔南极鱼是从南极中山站的海冰中钻孔垂钓所得, 将其保存在−80℃冰箱中运回实验室后直至使用。
1.2 南极鱼dusp1基因的克隆及真核表达载体的构建
使用TRIzol (Invitrogen, 美国)试剂, 根据说明书操作从伯氏肩孔南极鱼的肌肉组织中提取总RNA。采用1%琼脂糖凝胶电泳检测RNA完整性,采用分光光度计Nanodrop ND-2000 (Thermo Fisher Scientific, 美国)对RNA浓度和质量进行检测。使用反转录试剂盒(TaKaRa, 日本)按照说明书操作进行cDNA第一链的合成。根据GenBank数据库中伯氏肩孔南极鱼dusp1基因(GenBank登录号:XM_034121366.1)的编码序列设计特异性引物dusp11F和dusp1R1(表 1)进行目的基因的扩增, 随后将目的基因的PCR产物纯化后连接到pEASY®-T5 Zero克隆载体(Transgen, 北京), 转化至Trans1-T1(Transgen, 北京)感受态细胞中, 将阳性单克隆扩大培养后送至生工生物工程(上海)股份有限公司进行测序验证。
以测序正确的质粒为模板进行PCR扩增dusp1基因的编码序列(Coding sequence, CDS), 由于缺乏特异性抗体我们通过在终止密码子之前加上一段商业化的HIS标签(表 1), 之后进行PCR扩增,随后将目的条带采用胶回收试剂盒(Omega, 美国)进行切胶回收纯化, 利用In-Fusion®HD Cloning试剂盒(TaKaRa, 日本), 与实验室保存的真核表达载体pcDNA3.1(+)根据说明书操作步骤进行无缝克隆连接, 所用的无缝克隆引物列于表 1中。随后将连接产物转化至Trans-T1 (Transgen, 北京)感受态细胞中, 经涂板、菌落PCR验证、测序和阳性克隆扩大培养后, 使用去内毒素质粒提取试剂盒(Promega, 美国)提取质粒, 用于细胞转染。

表1 本研究所用引物Tab. 1 Primers for this study
1.3 293T细胞系的转染、蛋白表达和亚细胞定位分析
将293T细胞置于含10%胎牛血清(Gibco, 美国)和1%双抗的DMEM高糖培养基(Hyclone, 美国)中,放置在温度为37℃, 二氧化碳浓度为5%, 95%湿度的培养箱中进行培养。待细胞的汇合度达到70%—80%时, 采用TurboFect转染试剂(Thermo Fisher Scientific, 美国)根据说明书操作进行空载质粒和pcDNA3.1-dusp1载体的转染。为了检测DUSP1蛋白和磷酸化p38蛋白的表达情况进行了Western Blot分析, 收集转染后48h的细胞用于DUSP1蛋白的表达分析, 随后收集低温胁迫下实验组和对照组的细胞进行磷酸化p38蛋白分析, 采用PBS洗涤两次后加入RIPA裂解液(含1 mmol/L PMSF)收集细胞总蛋白, 采用BCA蛋白定量试剂盒(Thermo Fisher Scientific, 美国)测定蛋白浓度, 之后将对照组和实验组蛋白各取30 μg进行Western Blot检测, 所用一抗为鼠抗HIS抗体(华安, 杭州)和p-p38抗体(华安,杭州), 二抗为HRP标记的羊抗小鼠抗体(华安,杭州)。
将转染后的细胞在37℃最适生长温度培养24h后采用免疫荧光技术检测蛋白在细胞中的定位情况, 具体操作为将生长于6孔板中的细胞在室温下用4%多聚甲醛固定30min。用PBS洗涤2次后, 采用通透封闭缓冲液(0.1%Triton X-100, 1%BSA)封闭30min。然后, 将实验组和对照组中的细胞与针对HIS(1﹕100)的商业单克隆抗体(Abcam, 英国)一起于37℃孵育1h。以10min的间隔用PBS洗涤细胞2次, 随后与GFP-Alexa 488 偶联的羊抗小鼠(Invitrogen, 美国)二抗在室温下孵育1h。采用PBS洗涤细胞两次各5min, 用4',6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole, DAPI, Sigma,美国)进行细胞核染色5min, 水洗3次, 每次5min, 最后采用倒置荧光显微镜(Carl Zeiss, 德国)观察荧光在细胞中的分布情况并拍照。
1.4 293T细胞低温处理形态观察和ROS检测
将转染空载质粒和dusp1重组质粒的细胞进行18℃/10h、18℃/15h、13℃/10h和13℃/15h的低温胁迫处理后, 采用倒置荧光显微镜观察细胞形态并拍照。随后吸弃培养基, 并用PBS轻轻清洗细胞,吸弃PBS后, 加入1 mL浓度为20 μmol/L的采用不含血清的培养基稀释的ROS荧光探针DCFH-DA工作液。随后将细胞放回相应处理温度的培养箱中避光孵育30min, 收集细胞至棕色避光管中并用PBS洗涤2次后每孔加入500 μL不含血清的培养基重悬细胞, 采用流式细胞仪(BD Accuri C6, 美国)上机检测。实验组和对照组均设置3个重复孔, 并进行3次生物学实验重复。
1.5 细胞凋亡检测
将转染24h后的细胞吸弃培养基后, 加入预冷的PBS洗涤细胞2次, 随后加入0.25%的胰酶(不含EDTA)消化, 消化时间不宜过长, 看到细胞收缩变圆即可加入培养基终止以防止假阳性。800 r/min离心5min后弃掉上清, 加入预冷的PBS洗涤细胞2次, 加入100 μL1×Binding Buffer到含有1×105—5×105个细胞的棕色避光管中, 加入5 μL购买于碧云天公司的碘化丙啶(Propidium iodide, PI)染色试剂室温下避光染色10min, 后加入400 μL1×Binding Buffer, 采用流式细胞仪(BD Accuri C6, 美国)检测细胞凋亡情况。
1.6 细胞RNA的提取和caspase-3的定量PCR检测
采用TRIzol (Invitrogen, 美国)试剂, 提取各组细胞的RNA, 采用上述方法经过质检和浓度测定后, 使用Prime Script RT试剂盒(TaKaRa, 日本), 将1 μg总RNA反转录为单链cDNA。使用FastStart Universal SYBR Green Master Kit(Roche, 瑞士)和Light-Cycler480(Roche, 瑞士)进行qPCR分析, 以β-actin为参考基因(表 1), 根据GenBank数据库中caspase-3基因的所有转录本共有区域设计特异性引物(表 1),通过Pfaff[16]描述的方法定量基因的表达。
1.7 基因序列分析
通过ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder/)预测dusp1的开放阅读框及编码的氨基酸序列; 蛋白质分子质量, 理论等电点, 不稳定系数,脂肪系数和亲水性系数使用protparam(https://web.expasy.org/protparam/)预测; 使用NCBI的BLASTP程序搜索不同物种的dusp1同源基因序列。采用Mega7.0软件和DNAMAN软件对伯氏肩孔南极鱼和其他物种的dusp1基因进行同源性比对分析。
1.8 数据处理
实验数据以平均值±标准差(Mean±SD)表示。用GraphPad Prism 8软件对实验数据进行单因素方差分析(One-way ANOVA)及作图, 当P<0.05时认为差异显著(以*表示), 当P<0.01时认为差异极显著(以**表示)。
2 结果
2.1 伯式肩孔南极鱼dusp1基因的序列分析及同源比对
伯式肩孔南极鱼dusp1基因的开放阅读框为1128 bp, 编码376个氨基酸残基。通过protparam在线软件分析伯氏肩孔南极鱼dusp1基因的氨基酸序列发现, 其理论等电点为7.52, 不稳定系数为57.62,脂肪系数为87.90, 亲水性系数为–0.012, 表明其为亲水性蛋白。通过多物种的氨基酸序列比对显示,伯氏肩孔南极鱼与人(Homo sapiens)和小鼠(Mus musculus)的对应物分别享有72.55%和70.92%的氨基酸相似性, 与青鳉(Oryzias latipes)和斑马鱼(D.rerio)享有88.15%和82.69%的同源性, 与斜带石斑鱼(Epinephelus coioides)、红鳍东方鲀(Takifugu rubripes)、尼罗罗非鱼(O. niloticus)和虹鳟(Oncorhynchus mykiss)分别享有93.94%、91.22%、90.69%和86.28%的序列相似性, 这表明dusp1基因在哺乳类和鱼类中都具有序列的高度保守性。此外, 对其蛋白的保守结构域分析发现, 第67至第69位氨基酸为其核定位信号序列(Nuclear localization sequence,NLS: aa 67—69), 在其氨基酸272—277位的催化域中包含一个必需的半胱氨酸残基(Cys272), 这在人、小鼠及其他比对的鱼类中都是相同的, 预示着该半胱酸残基对于DUSP1结构保持的重要性。
2.2 载体构建、蛋白表达及细胞定位分析
以pcDNA3.1(+)质粒为骨架构建了表达南极鱼dusp1基因的真核表达载体(图 1A), 分别将空载质粒和重组质粒转染293T细胞后, 通过免疫荧光检测了蛋白的分布情况, 发现绿色荧光信号分布在细胞核中, 之后采用细胞计数方法统计转染效率约为80%, 而在对照组中未观察到荧光信号(图 1B)。为了验证dusp1基因在细胞中的蛋白表达情况, 分别收集了对照组和实验组细胞的总蛋白进行Western Blot分析, 结果显示, 在41 kD处出现一条明显的蛋白条带, 但在转染空载的细胞中未检测到 (图 1C)。这表明, 伯氏肩孔南极鱼dusp1基因在293T细胞中成功地进行了表达, 可进行下一步的功能验证。
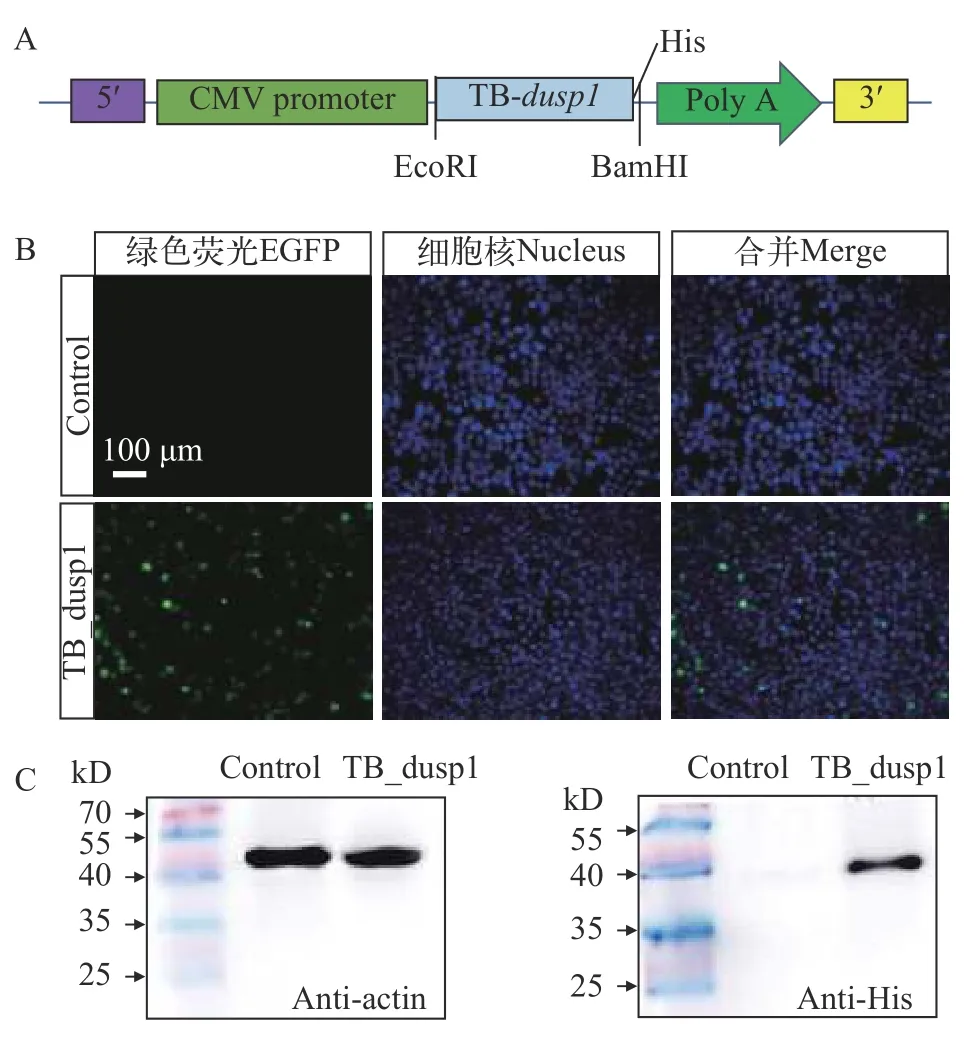
图1 dusp1的载体构建和蛋白表达分布Fig. 1 Vector construction and the distribution of dusp1 protein expression in cells
2.3 细胞形态学观察
为探索伯氏肩孔南极鱼dusp1基因在低温下发挥的功能, 在转染细胞后24h将过表达dusp1组细胞和转染空载质粒组细胞放入18℃和13℃低温培养箱中分别处理10h和15h后对细胞形态进行观察, 结果表明(图 2), 空载质粒转染组细胞在18℃/10h后出现皱缩, 细胞呈梭形分布, 少量细胞开始变圆, 细胞触角数量减少, 而过表达dusp1组仅有少量细胞出现轻微皱缩。在18℃/15h后转染空载组中有大量细胞变圆, 细胞触角大量收缩, 细胞聚拢成团, 而转染dusp1组仅有少量细胞皱缩变圆, 仍有大量细胞触角分布。在13℃/10h后转染空载质粒组细胞均变圆呈斑块状聚集, 少量细胞死亡并从皿底脱落,过表达dusp1组细胞此时开始变圆, 在皿底仍分布有少量细胞触角, 在13℃/15h后转染空载质粒组细胞碎裂, 大量细胞死亡并从皿底脱落, 转染dusp1组细胞此时开始出现斑块状聚集, 仅有少量细胞死亡。以上结果表明南极鱼dusp1的过表达能够减轻低温胁迫对细胞形态的损伤, 对于维持细胞形态完整具有重要作用。

图2 不同温度处理下细胞形态学分析Fig. 2 Cell morphological analysis at different treatment temperatures
2.4 ROS检测
ROS在低温诱导的细胞凋亡中起着关键作用。采用荧光探针DCFH-DA对过表达dusp1组和转染空载质粒组细胞中的ROS进行了标记, 并采用流式细胞仪对两组细胞中ROS含量进行检测发现,在18℃/10h和18℃/15h处理后, 转染空载质粒组细胞中ROS含量与过表达dusp1组相比分别上调了约2.9倍和1.7倍(图 3B、3C和3F), 在13℃/10h和13℃/15h处理后, 转染空载质粒组细胞中ROS含量比过表达dusp1组高约1.4和1.7倍(图 3D、3E和3F), 这表明南极鱼dusp1在细胞中的过表达可减轻低温刺激下ROS的积累。

图3 不同温度处理下细胞ROS含量变化Fig. 3 Intracellular ROS detection of cells under different temperature conditions
2.5 细胞凋亡检测
为检测低温胁迫下细胞的凋亡情况, 采用PI对细胞进行染色并用流式细胞仪检测了细胞的凋亡率(图 4), 在低温18℃/10h和18℃/15h处理后, 转染空载组细胞死亡率分别为(8.42±0.03)%和(16.8±2.15)%, 过表达dusp1组细胞死亡率分别为(2.29±0.03)%和(10.3±1.07)%, 在13℃/10h和13℃/15h处理后, 转染空载质粒组细胞死亡率分别为(19.3±3.15)%和(25.3±3.78)%, 过表达dusp1组细胞死亡率分别为(16.4±2.21)%和(20.2±2.37)%。所有实验组细胞凋亡率显著低于对照组(P<0. 05)。由以上结果可知过表达dusp1基因可显著减少低温下细胞的凋亡率。
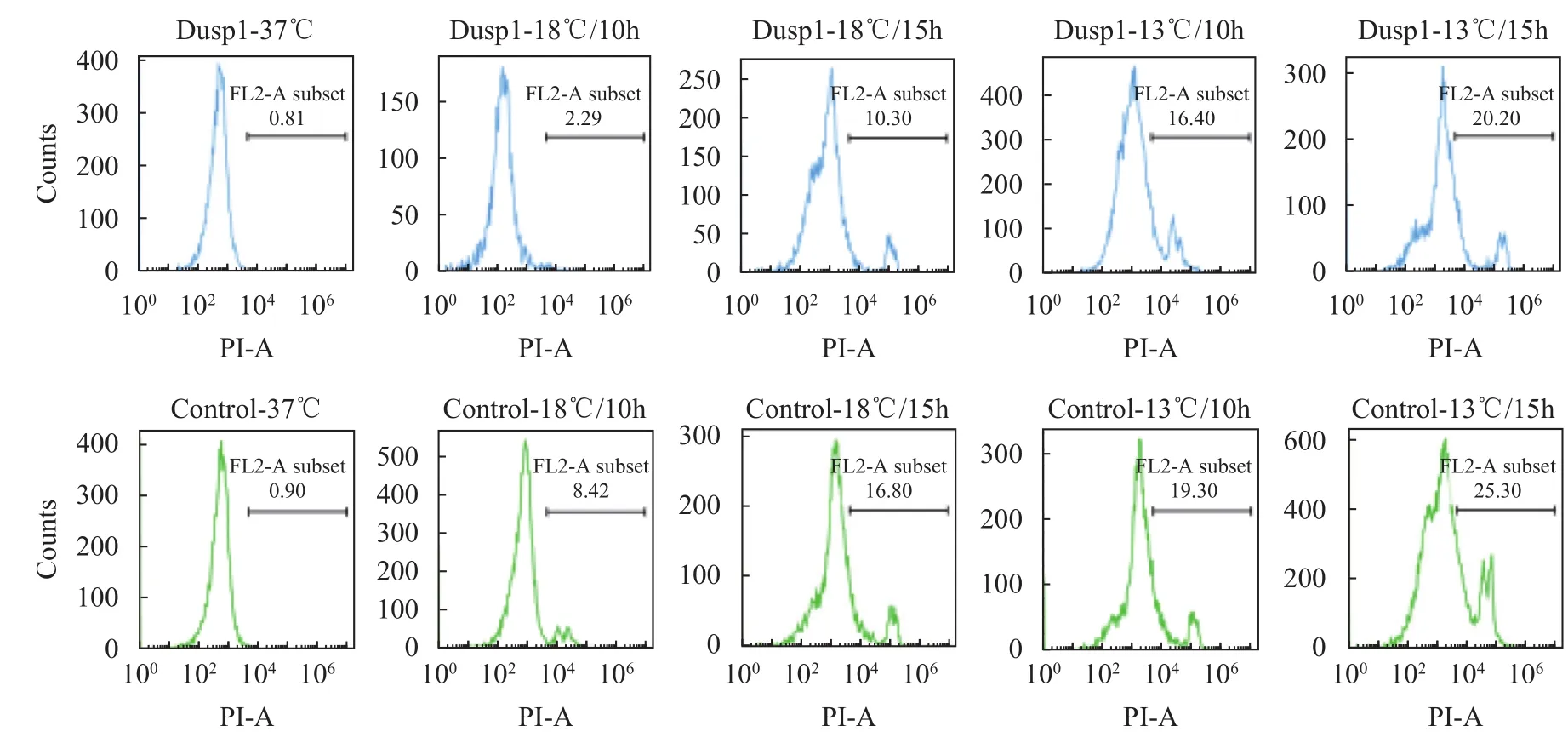
图4 不同温度处理下细胞凋亡检测Fig. 4 Cell apoptosis under different temperature conditions
2.6 相关凋亡基因表达情况检测
ROS的过量产生会引起促凋亡基因p38的积累从而诱导细胞发生凋亡, 而caspase-3是细胞凋亡过程中的关键执行分子。我们通过Western Blot和RT-qPCR技术检测了过表达dusp1组和转染空载质粒组细胞在低温胁迫下p38的磷酸化水平和caspase-3的mRNA水平(图 5)。结果表明, 在低温胁迫后, 过表达dusp1组细胞中p38的磷酸化水平和caspase-3的mRNA水平显著低于转染空载质粒组, 这表明过表达dusp1能有效抑制促凋亡基因的表达,缓解细胞在低温下的死亡进程。
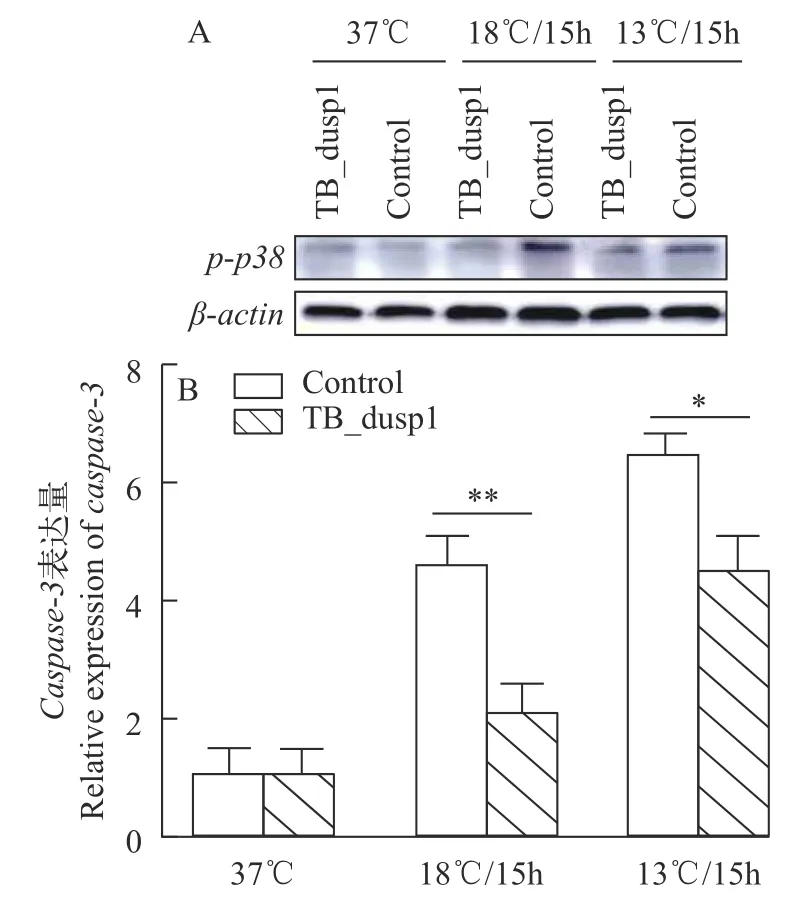
图5 p38磷酸化水平和caspase-3的mRNA表达水平检测Fig. 5 The levels of phosphorylated p38 and the mRNA expression of caspase-3
3 讨论
双特异性磷酸酶(Dual-specificity phosphatase,dusp1)也称作丝裂原活化蛋白激酶磷酸酶(Mitogen-activated protein kinase phosphatase-1, MKP-1)是一组既可以使酪氨酸残基去磷酸化, 又可使丝氨酸/苏氨酸残基去磷酸的酶分子[17]。这些酶分子的结构高度保守, 均包含非催化的N端结构域和C端的催化结构域。后者包含高度保守的蛋白酪氨酸磷酸酶(PTPase)活性位点序列(I/V)HCXAGXXR(S/T/G)。N端结构域包含一个保守的模块序列, 称为激酶相互作用基序(KIM), 该序列介导MAPK底物的差异识别和结合, 并且还包含决定亚细胞定位的核定位(NLS)或输出(NES)信号[18]。在本研究中,通过氨基酸序列相似性比对发现在第67至第69位氨基酸发现其核定位信号序列(RRR), 表明了dusp1定位于细胞核中, 这与我们的亚细胞定位分析结果一致。在人和小鼠的N端保守模块中该序列组成为RRRAK, 其中位于第57位的赖氨酸残基(Lys57)可被P300乙酰化, 增强其与p38的相互作用,从而增加其磷酸酶活性并中断MAPK信号传导[19]。在本研究中, 伯氏肩孔南极鱼dusp1在其N端的保守模块序列为RRRAR, 将赖氨酸突变为精氨酸(Arg,R), 但与人和小鼠相比, 均同为碱性氨基酸。因此,笔者推测其在鱼类中的功能与哺乳动物类似, 该精氨酸也可能介导其与p38的相互作用从而影响MAPK信号传导。此外, 在其氨基酸272-277位的催化域中包含一个必需的半胱氨酸残基(Cys272), 这与人和小鼠相同[20]。所有这些证据都表明dusp1在人类、小鼠和鱼类中都享有高度的保守性, 可能执行相似的功能。
研究表明ROS是诱导细胞死亡的介质之一, 在细胞死亡信号通路中扮演了重要角色。在自然界中, 植物在遭受低温刺激时会导致ROS含量的大量积累[21]。在细胞中, Chen等[22]研究发现, 冷刺激是导致宫颈癌细胞和斑马鱼ZF4细胞中ROS积累的主要因素。此外, Chen等[23]通过对生活在极限温度下的南极鱼转录组分析发现许多抑制ROS的基因大量上调, 这表明在寒冷胁迫下ROS的积累是一种普遍现象。但ROS的过度积累则会造成细胞氧化应激损伤, 进而引发细胞凋亡。在本研究中, 我们发现低温刺激会导致对照组细胞中ROS的大量上调,而在过表达伯氏肩孔南极鱼dusp1的细胞中ROS含量显著低于对照组, 细胞凋亡率也显著减少, 这表明在低温刺激下dusp1会减轻细胞中ROS的积累,并在长时间的低温处理中有利于缓解细胞凋亡的发生, 延长细胞的存活时长。
丝裂原激活的蛋白激酶(MAPK)是一类中央信号分子, 由P38、ERK和JNK 三个亚家族组成, 可对多种刺激作出反应, 控制着不同的细胞过程, 包括增殖、细胞存活和细胞死亡[24]。据报道, 细胞中p38/MAPK或其上游激酶的活化可诱导凋亡, 而阻断p38/MAPK的活化可防止多种细胞凋亡的发生[25—27]。活性氧(ROS)可以激活p38, 从而触发随后的凋亡程序, 例如某些细胞中caspase蛋白酶家族的激活。Caspase蛋白酶家族包括10个以上的成员, 被认为是细胞凋亡的下游执行者。其中,caspase-3被认为是蛋白水解级联反应的重要组成部分, 并在凋亡过程中起着关键作用[28]。我们先前的研究表明低温刺激会引发细胞内ROS的积累进而诱导p38/MAPK的表达, 触发细胞凋亡的发生[22]。在本研究中我们通过检测对照组和实验组细胞中p38的磷酸化水平,发现南极鱼dusp1的过表达显著降低了细胞中p38的磷酸化水平和caspase-3的表达。由于dusp1是一种特异性的使p38去磷酸化而失活的酶分子,因此, 我们认为在对照组细胞中由于低温刺激导致了ROS的积累引起p38的过度激活加剧了细胞凋亡进程致使caspase-3过度活化。而在实验组中dusp1的过表达可通过灭活过度活化的p38进而减缓低温刺激下caspase-3的激活进程来缓解细胞凋亡的发生。
先前的研究表明对斑马鱼细胞进行dusp1基因敲降后, 在低温胁迫下, 实验组细胞凋亡显著高于对照组[15], 这表明伯氏肩孔南极鱼dusp1基因与斑马鱼dusp1基因在功能上有一定的保守性, 但其具体的分子调控机制并不清楚。本研究首次证明了dusp1通过P38/MAPK信号通路参与了鱼类细胞冷应激的调控, 为探究dusp1在低温下调控细胞命运的分子机制提供了新的证据。
综上所述, 本研究首次报道了伯氏肩孔南极鱼dusp1基因在低温应激过程中可以缓解细胞受低温侵袭的程度, 并且这种保护作用主要是通过抑制p38/MAPK的过度磷酸化实现的, 表明了伯氏肩孔南极鱼的dusp1基因在抗寒功能中具有重要作用,为探究极地鱼类低温适应性进化机制研究提供了新的证据同时也为进一步探究冷胁迫下硬骨鱼类dusp1的功能奠定了基础。
