斑马鱼模型淋巴系统研究进展①
2022-08-30王拥军梁倩倩河南中医药大学康复医学院郑州450046
陈 岩 徐 浩 王拥军 梁倩倩 (河南中医药大学康复医学院,郑州 450046)
哺乳动物淋巴系统可维持组织间体液平衡,进行免疫监视和吸收胃肠道脂肪酸,病理情况下,淋巴系统介导炎症免疫应答以及作为主要途径参与肿瘤细胞转移过程[1-2]。斑马鱼的淋巴系统在分子结构与解剖学上与哺乳动物类似,具有胚胎透明、繁殖能力强、与人类具有同源基因以及在进化过程中高度保守性等特点,使斑马鱼成为研究淋巴发育和淋巴疾病的一种潜在理想模型[3-4]。本文分别从斑马鱼淋巴管形成和发育、定位及检测方法、影响斑马鱼淋巴管发育的主要信号分子和通路以及采用斑马鱼模型进行抗淋巴活性药物筛选等方面进行综述。
1 斑马鱼淋巴管形成和发育
阐明斑马鱼淋巴管形成和发育对采用斑马鱼模型进行药物筛选及疗效评估等具有重要意义。斑马鱼淋巴系统从解剖学角度可分为3 个部分:面部淋巴(facial lymphatic sprout,FLS)、肠道淋巴管(supra intestinal lymphatic vessel,SIL)和躯干淋巴管。FLS 发育最早,受精后1.5~2 d 即可观察到,萌芽于主静脉血管内皮细胞形成头窦;受精后第3天,耳部淋巴管从面侧部淋巴管发出,与大脑后脑静脉伴行;受精后第4天,内侧面部淋巴管从面侧部淋巴管处形成,并朝向腹主动脉延伸;受精后第5天,FLS通过颈淋巴管连接胸导管(thoracic duct,TD)[5]。
SIL发育与肠血管密切相关,SIL有2对,分别称为左、右SIL(R-SIL、L-SIL)。SIL 最佳观测时间为受精后第4天,此时可观测到SIL延伸至肠系膜前动脉(anterior mesenteric artery,AMA),同时与肠上动脉(supra intestinal artery,SIA)和胰腺原基形成网络状结构;受精后第5 天,淋巴管随着SIA 和右侧肠下静脉(right sub-intestinal vein,R-SIV)延伸,其中,右上肠淋巴管(upper right intestinal lymphatic,UR-IL)沿着SIA走形,右下肠淋巴管(lower right intestinal lymphatic,LR-IL)沿着R-SIV 走形,左下肠淋巴管(lower left intestinal lymphatic,LL-IL)沿左肠下静脉(left subintestinal vein,L-SIV)走形。同时,一些细小淋巴管分支将R-SIL、L-SIL和TD连接起来;受精后第6天,LR-IL 出现分叉,形成两根独立的淋巴管,沿着R-SIV 彼此紧密伴行;受精后第7 天,R-SIL 和L-SIL延伸至尾部,几乎发育完全。
相对于FLS 和SIL,躯干淋巴管构成更为简单,因此大部分研究者倾向于将躯干淋巴管作为研究对象。躯干淋巴管包括TD、节间淋巴管(intersomitic lymphatic vessel,ISLV)、背纵淋巴管(dorsal longitudinal lymphatic vessel,DLLV)及脊索旁淋巴管(parachordal lymphatic vessel,PLV)。受精后36 h,躯干部淋巴管萌芽于后主静脉(posterior cardinal vein,PCV);受精后54 h,PLV 开始形成,并逐渐延伸至腹侧参与TD 形成,此时,萌芽于PCV 的静脉芽与节间动脉(arterial intersegmental vessel,AISV)相吻合形成节间静脉(venous intersomitic vessel,VISV)[6];受精后第5天,DLLV 和TD 发育完全,采用激光共聚焦显微镜观察转基因斑马鱼(fli1:EGFP)躯干(图1),从腹侧到背部水平面,淋巴管排列顺序为TD、PLV、ISLV、DLLV,而血管排列依次为PCV、背大动脉(dorsal artery,DA)、背纵动脉(dorsal longitudinal artery,DLA),其中DLLV 和DLA 伴行,TD 和DA 伴行,此外,躯干部垂直排列的管道分别为ISLV、AISV和VISV,但在转基因斑马鱼中无法区分。

图1 斑马鱼躯干淋巴管Fig.1 Trunk lymphatic vessel of zebrafish
2 斑马鱼淋巴管定位方法
斑马鱼淋巴管常伴行于血管,因此,准确定位淋巴管可更好地进行研究,可根据淋巴管和血管不同发育时间、相对位置关系进行区分,也可采用透射电镜、血管造影及转基因杂交技术进行观察区分。
2.1 发育时间 淋巴管发育时间晚于血管。血管系统在受精后24 h 发育完全,淋巴管系统在受精后第2天萌芽于主静脉血管内皮细胞。
2.2 位置关系 躯干淋巴管常伴行于血管,可从解剖位置定位淋巴管,如DLLV 和DLA 伴行;ISLV连接DLLV 与TD,并与AISV 紧密伴行;TD 位于DA和PCV间,与DA伴行[7]。
2.3 透射电镜观察形态学 斑马鱼淋巴管与血管形态不同,可采用透射电镜观察,成年斑马鱼TD 由1层较薄的单层上皮细胞构成,而PCV 和DA 具有较厚且更复杂的细胞壁[8]。
2.4 应用血管造影 受精后14 d,转基因斑马鱼(fli1:EGFP)经皮下注射荧光微粒后,血管造影显示DA 和PCV 呈红色。受精3周后,对转基因斑马鱼进行淋巴管造影,皮下注射荧光微粒,TD 可被标记为红色。
2.5 转基因杂交 采用激光共聚焦显微镜观察转基因斑马鱼(gata1:DsRed;fli1:EGFP),其后代可显示淋巴管和血管为不同颜色,PVC 和DA 中存在清晰的血液流动,呈红色。TD 中则无血液流动,呈绿色。此外,ISLV、VSIV和ASIV相互分离(图2)。
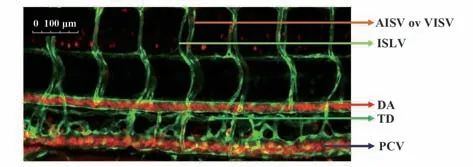
图2 转基因斑马鱼(gata1:DsRed;fli1:EGFP)的血管和淋巴管Fig.2 Vascular and lymphatic of hybridization of transgenic fish(gata1:DsRed;fli1:EGFP)
3 调节斑马鱼淋巴管发育的主要信号分子及信号通路
斑马鱼淋巴管在形成和发育过程中受部分信号分子及通路影响。斑马鱼淋巴管内皮细胞萌芽于胚胎时期,Prox1 的出现标志着淋巴管开始发育,Prox1 对区分淋巴管内皮细胞(lymphatic endothelial cells,LECs)与静脉内皮细胞(vein endothelial cells,VECs)至关重要,而LECs迁移由Pkd1决定[9]。LECs发育则需要VEGF-C,VEGF-C 又称淋巴生长因子,通过其受体VEGFR-3 发挥作用,VEGF-C 由多种细胞分泌,包括淋巴平滑肌细胞,而VEGFR-3 主要在内皮细胞中表达[10]。
VEGF-C/VEGFR-3通路在淋巴管形成中起决定作用[11]。VEGFR 信号通路有2 个主要分支,即丝裂原活化蛋白激酶(MAPK)和磷酸肌醇(PI3K)通路。MAPK 通路在VEGFR 下游,在TD 形成早期发挥重要作用,抑制MAPK通路则导致淋巴管生成减少[12]。另一方面,研究发现ARAP3 是PI3K 的下游信号分子,可调节LECs迁移,是胚胎淋巴发育所必需的[13]。
多种信号分子通过调控VEGF-C/VEGFR-3表达或与之相互作用调控淋巴管发育,如CLP24 是一种跨膜蛋白,涉及VEGFR-2 和VEGFR-3 信号通路,敲除CLP24 可导致TD 和PLV 损伤[14]。此外,LPA1 是溶血磷脂酸(lysophosphatidic acid,LPA)受体,位于斑马鱼头部和背主动脉附近,通过影响VEGF-C/VEGFR-3信号通路调控淋巴管发育[15]。敲除LPA1 可剂量依赖性导致TD 缺失、心包和躯干水肿,过表达VEGF-C 可部分改善这种情况。此外,胶原蛋白和Ccbe1 蛋白可通过Erk 信号增强VEGF 表达从而促进淋巴管生成[16]。E2fs 可通过调控Ccbe1和Flt4 促使静脉萌芽和淋巴管形成[17]。而Sox18 与VEGF-C 相互作用可调控淋巴管发育,并在动静脉分化后参与淋巴管从主静脉中萌芽过程[18]。此外,RasGRP1 是淋巴管发育过程中的另一个重要分子,敲除RasGRP1 可导致TD 损伤,并伴有心包和躯干水肿,可通过过表达Hras逆转这一过程[19]。
最近研究表明,VEGF-C/VEGFR3 通路不是唯一促使淋巴萌芽的途径。Prox1 是最早的淋巴标志物,在淋巴囊、淋巴管形成中扮演重要角色,同时,对维持血管和淋巴的表型起关键作用。Prox1 作为监测基因,在淋巴萌芽、增殖和迁移中发挥重要作用[20-22]。PCV 淋巴萌芽处检测到Prox1b 表达强烈,敲除Prox1b会导致TD缺失[23]。
部分信号通路可不依赖于VEGF-C/VEGFR3 而影响淋巴管生成,如VEGF-D 可补偿斑马鱼头部淋巴发育过程中的VEGF-C 缺失[24]。另一种途径是Apelin 不依赖于VEGF-C 而直接激活Akt1/2 磷酸化,但不能逆转受精后4 d 斑马鱼由于缺乏VEGF-C导致的淋巴发育缺陷[25]。此外,HOXC9/stabin2 可通过促进Erk 磷酸化调控斑马鱼PLV 和TD 形成,与VEGF-C/VEGFR-3途径不相关[26]。BMP是另一种独立影响淋巴管生成的信号分子,BMP 1 型、2 型受体Bmpr2a 和Bmpr2b、Alk3 和Alk3b 及SMAD5 均 为BMP 信号通路必不可少的细胞介质,敲除其表达可导致斑马鱼淋巴管缺陷,说明BMP信号通路的每一种成分在淋巴管发育过程中都可能具有独特的功能,而BMP2/BMPR2 的功能是双向的[27];另一项研究报道,过表达BMP2可阻碍淋巴管形成[28]。
4 细胞间质环境对淋巴管发育的影响
除相关信号分子及通路外,细胞间质环境也会影响淋巴管发育。毛细淋巴管主要由Ⅰ型纤维型胶原构成,主要与间质基质直接相连,但其与周围基质相互作用一直被忽视。MMP2是一种基质金属蛋白酶。DETRY 等[29]通过透射电子显微镜和共聚焦反射显微镜观察斑马鱼间充质样细胞中MMP2迁移与胶原纤维重构之间的关系,敲除MMP2 可导致淋巴管生成减少和血管分支减少,表明MMP2 作为间质胶原酶可调控淋巴管生成。
COFFINDAFFER-WILSON 等[30]通过药物调节斑马鱼组织间液流动发现,增加或减少组织间液流动可影响淋巴管形态,导致淋巴水肿,可见适当的间液流动对淋巴管生成和发育是必要的。
5 斑马鱼淋巴管检测方法
斑马鱼淋巴管检测方法有多种,如光子延时成像、微血管造影、免疫组织化学和电子显微镜等。YANIV 等[31]采用光子成像系统示踪转基因斑马鱼LECs 迁移显示,与其他脊椎动物一样,斑马鱼淋巴系统具有多种形态学及分子学特点,并进行体内细胞跟踪实验证实LECs起源于静脉。HOFFMAN等[32]采用双相微血管造影技术检测胚胎和幼年时期转基因斑马鱼淋巴管,可实时测定促淋巴生成因子对毛细淋巴管发育的作用,有利于广泛筛选促淋巴管生成药物,并阐明淋巴管生长途径。SHIMODA等[33]通过免疫组织化学和电子显微镜观察成年斑马鱼淋巴管形态,Prox1免疫组化方法可显示斑马鱼躯干部沿DA和PCV方向有2条淋巴干,总主静脉周围有较大的淋巴窦,此外,Prox1 免疫组化染色也可检测病理生理条件下淋巴管功能。
6 斑马鱼模型在抗淋巴活性药物筛选中具有重要价值
肿瘤中新生淋巴管生长在肿瘤细胞转移扩散中具有自身规律,首先转移至肿瘤周围的前哨淋巴结,再转移至身体其他部位。目前,用于防止淋巴管生长的选择性药物尚未被批准用于临床,抗淋巴管生成药物具有重要潜在临床应用价值。目前采用斑马鱼筛选出的具有抗淋巴活性的药物化合物已被批准应用,包括山柰酚(植物中发现的天然产物)、来氟米特(嘧啶生物合成抑制剂)以及桂利嗪和氟桂利嗪(Ⅳ型钙通道拮抗剂)。小鼠体内淋巴管生成实验证实山柰酚、来氟米特和氟桂利嗪具有抗淋巴活性,阻止淋巴管生长。山柰酚是VEGFR2/3激酶活性抑制剂,能够降低肿瘤相关淋巴管密度及转移性乳腺癌异种移植模型中淋巴结转移发生率。虽然斑马鱼可用于筛选、识别以及研究哺乳动物抗淋巴化合物,但次级筛选也是必要的,以确保药物在肿瘤环境中的有效性[34-35]。
7 展望
淋巴管生成与多种疾病密切相关,包括淋巴水肿、炎症、肥胖、动脉粥样硬化和癌症,但对淋巴管发育的机制知之甚少,缺乏一种快速、精确测量淋巴管发育的方法[36]。斑马鱼具有发育快、实验周期短、胚胎透明、易观察、药物筛选周期短等特点,是研究活体淋巴管的潜在理想模型。目前斑马鱼已用于血管生成、抗血管生成、肿瘤发生、糖尿病及其并发症、骨或软骨疾病等疾病药物有效性筛选的重要模型,并被广泛用于评估药物疗效和毒性,尤其是多成分药物、草药和提取物[37-44]。但斑马鱼尚未被用于评估药物对淋巴系统的作用,因此,课题组认为随着斑马鱼淋巴管机制研究的发展,斑马鱼将成为评价影响淋巴管生成药物作用的重要动物模型。